HOKUTO編集部
1年前
開発が進むKRAS阻害薬、 期待される新薬は? (村上晴泰氏 静岡がんセンター化学療法センター長)

現在、 進行非小細胞肺癌 (NSCLC) に対して、 KRAS阻害薬のほか、 既存薬とは作用機序が異なる新規薬剤の臨床開発が盛んに行われており、 対象患者の拡大や耐性克服が期待されている。 また、 KRAS阻害薬に細胞障害性抗癌薬、 免疫チェックポイント阻害薬などを併用することで、 高い治療効果を目指す検討も積極的に行われており、 1次治療も視野に入れた治療戦略が注目されている。
本コンテンツについて
第65回日本肺癌学会では、 静岡県立静岡がんセンター化学療法センター長・新規治療開発科部長・呼吸器内科医長の村上晴泰氏が 「KRAS阻害薬の現状と期待される新薬の臨床開発の動向」 について発表した。 その概略を以下にまとめる。
KRASとは
KRAS変異と癌細胞の増殖メカニズム
KRAS (Kristen rat sarcoma virus)は、 GTP (グアノシン三リン酸) をGDP (グアノシン二リン酸) に加水分解する低分子量のGTPaseの1つであり、 GTPが結合した活性型(ON)とGDPが結合した不活性型(OFF)の2つが存在する。
このONとOFFを行き来することで細胞内のシグナル伝達経路のスイッチとしての役割を担っているが、 KRAS遺伝子に変異が生じると、 活性型KRAS蛋白が蓄積し、 癌細胞の増殖・生存シグナル伝達が増強されると考えられている。
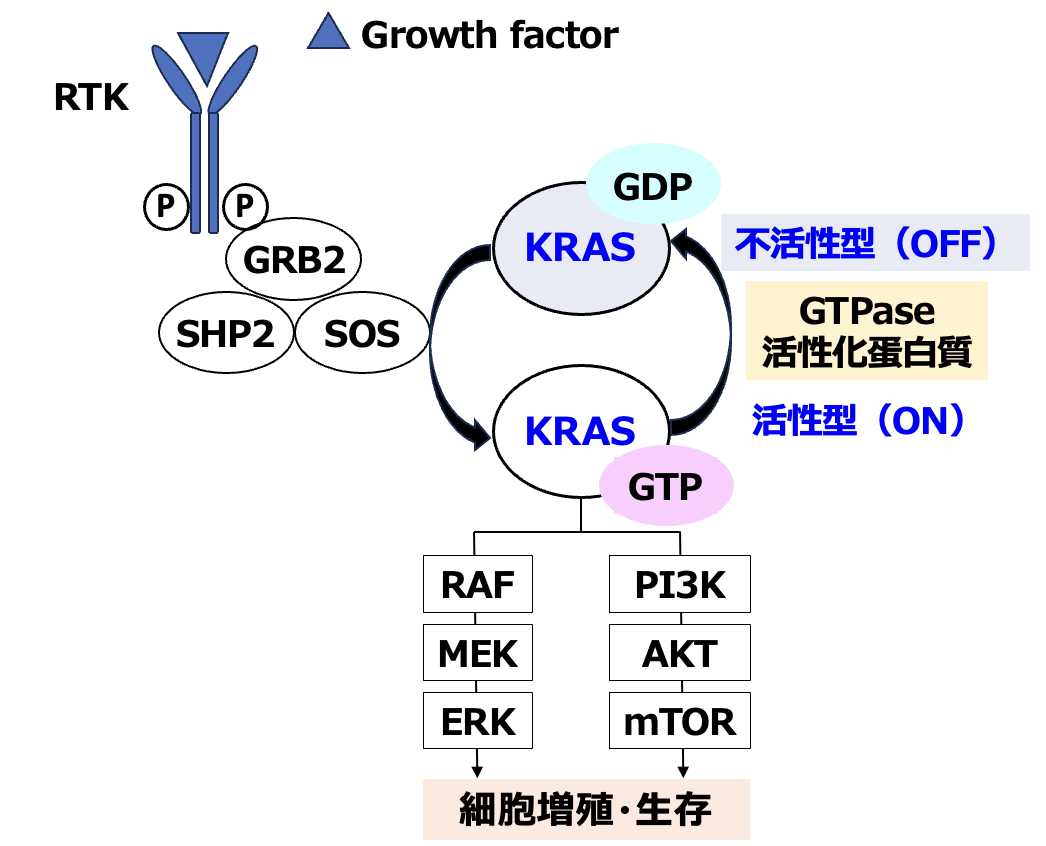
(静岡県立静岡がんセンター 村上晴泰氏提供)
KRAS阻害薬の現状
単剤療法は2次治療以降で推奨
現在国内で使用できるKRAS阻害薬は、 2022年1月に 「がん化学療法後に増悪した KRAS G12C 変異陽性の切除不能な進行・再発の非小細胞肺癌」 を適応として承認されたソトラシブ(商品名ルマケラス錠120mg)のみである。
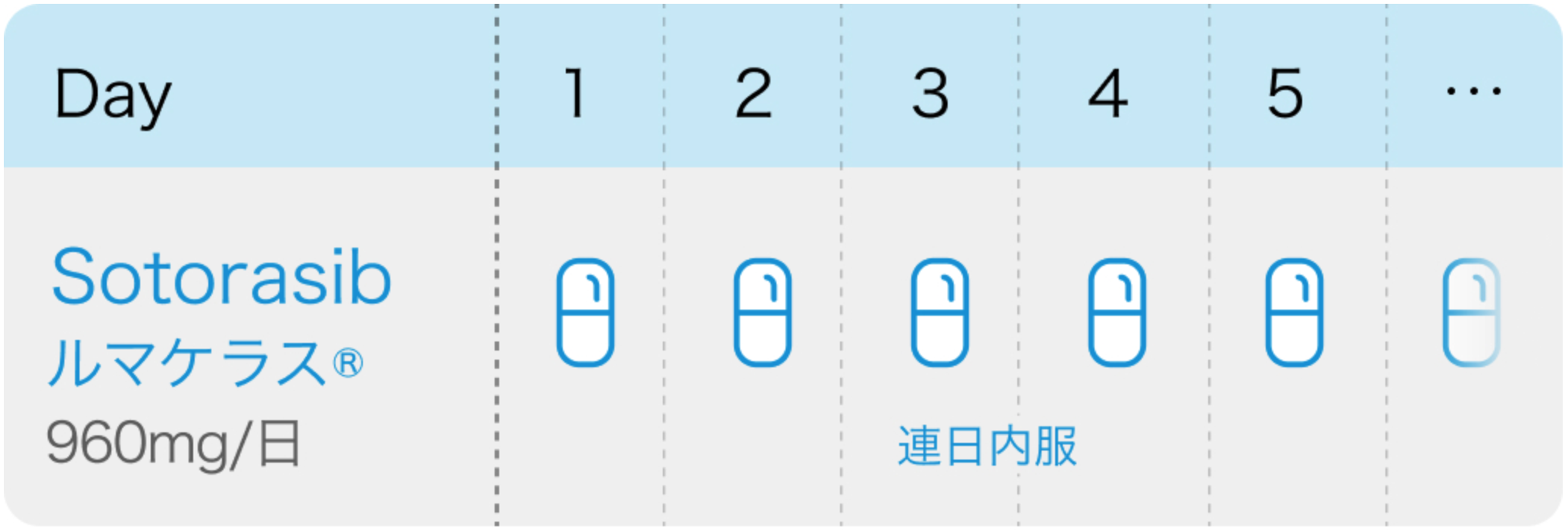
ソトラシブは、 活性部位 (活性型KRASのGTP結合部位) とは別の部位 (不活性型KRASのSwitcⅡポケット) に結合することで不活性型から活性型への変換を阻害し、 腫瘍増殖抑制作用を発揮するKRAS (OFF) 阻害薬である。
『肺癌診療ガイドライン2024年』では KRAS G12C変異陽性患者に対し、 ソトラシブ単剤療法を2次治療以降で行うことが推奨されている¹⁾。
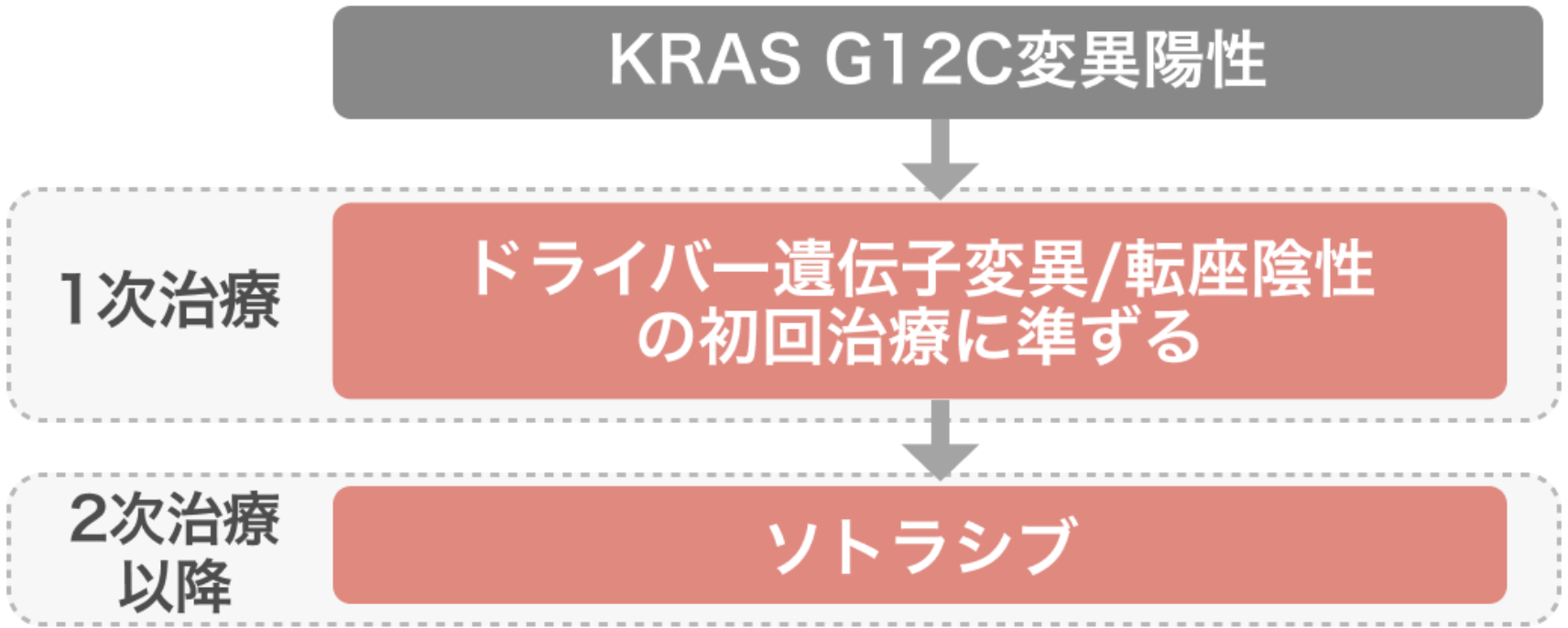
肺癌診療ガイドライン2024をもとにHOKUTO編集部作図
この根拠となっている第Ⅲ相試験CodeBreak 200 (NCT04303780)では、 プラチナ製剤および/または免疫チェックポイント阻害薬の前治療歴があるKRAS G12C変異陽性の進行NSCLC患者を対象として、 ソトラシブの有効性および安全性がドセタキセルを対照に比較検証された。
主要評価項目である盲検独立中央判定 (BICR) によるRECISTv1.1に基づくPFS中央値は、 ドセタキセル群では4.5ヵ月 (95%CI 3.0-5.7ヵ月) であったのに対し、 ソトラシブ群では5.6ヵ月 (同4.3-7.8ヵ月)と有意な改善が認められた (HR 0.66、 95%CI 0.51-0.86、 p=0.0017)。
重要な副次評価項目であるORRにおいても、 ドセタキセル群の13.2%(95%CI 8.6-19.2%)に対して、 ソトラシブ群では28.1%(95%CI 21.5-35.4%)と有意(p<0.001)に高かった。
Grade3以上で多く認められた有害事象は、 ソトラシブ群では下痢、 肝機能障害、 ドセタキセル群では、 疲労、 脱毛、 血液毒性などであった²⁾。
化学療法との併用で1次治療も視野に
ソトラシブ単剤療法については、 前述のようにガイドラインにおいて2次治療以降が推奨されているが、 現在は化学療法との併用による1次治療も視野に入れて開発が進められている。
化学療法の前治療歴がないKRAS G12C変異陽性の進行非扁平上皮NSCLC患者を対象に、 ソトラシブ+化学療法 [カルボプラチン(CBDCA) + ペメトレキセド(PEM)] 併用療法の有効性および安全性を評価した単群第Ⅱ相試験SCARLET (jRCT2051210086) では、 BICRに基づくORRは88.9%(80%CI 78.5-94.8%)と良好な結果が報告されている³⁾。
また、 KRAS G12C変異陽性の進行NSCLC患者を対象に、 同併用療法の安全性および有効性を1次治療群、 2次治療群に層別化して評価した国際第Ib相試験CodeBreaK 101 (NCT04185883)では、 1次治療群のORRは65%(95%CI 46.5-80.3%)、 PFS中央値は10.8ヵ月(95%CI 5.4ヵ月-NE、 追跡期間中央値 9.2ヵ月)であり、 再現性のある良好な結果が示された⁴⁾。
これらの結果を受け現在は、 KRAS G12C変異陽性でPD-L1の発現1%未満の進行NSCLCを対象に、 ソトラシブ+CBDCA+PEMと抗PD-1抗体ペムブロリズマブ+CBDCA+PEMを主要評価項目をPFSとし比較検証する第Ⅲ相試験CodeBreaK 202 (NCT05920356) が進行中である。
次世代のKRAS(OFF)阻害薬
期待される新薬の臨床開発の動向
さらに、 ソトラシブの臨床開発が成功したことを受けて、 KRAS G12Cを標的としたKRAS(OFF) 阻害薬をはじめ、 さまざまな薬剤の開発が盛んに行われているという。

(静岡県立静岡がんセンター 村上晴泰氏提供)
DivarasibとOlomorasibは、 ソトラシブやAdagrasib(海外で臨床導入)より選択的かつ強力なKRAS(OFF)阻害薬である。
Divarasib
Divarasibについては、 KRAS阻害薬の前治療歴がないKRAS G12C変異陽性の進行固形癌患者(NSCLC患者を含む)を対象とした同薬単剤の第I相試験において、 良好な安全性プロファイルが示され、 かつPFS中央値は13.8ヵ月、 ORRは55.6%と良好な成績が示された⁵⁾。
この結果を受けて、 現在はKRAS G12C変異陽性の進行NSCLCの2次治療以降において、 Divarasib単剤の有効性および安全性をソトラシブまたはAdagrasibを対照に主要評価項目をPFSとして評価する第Ⅲ相試験Krascendo 1 (NCT06497556)が進行中である。
村上氏は、 「ソトラシブやAdagrasibが早期試験の結果を基に承認されたのに対して、 早期試験でより良好な成績を示しているDivarasibが第Ⅲ相試験に基づき承認されるかどうかが注目されている」 と述べた。
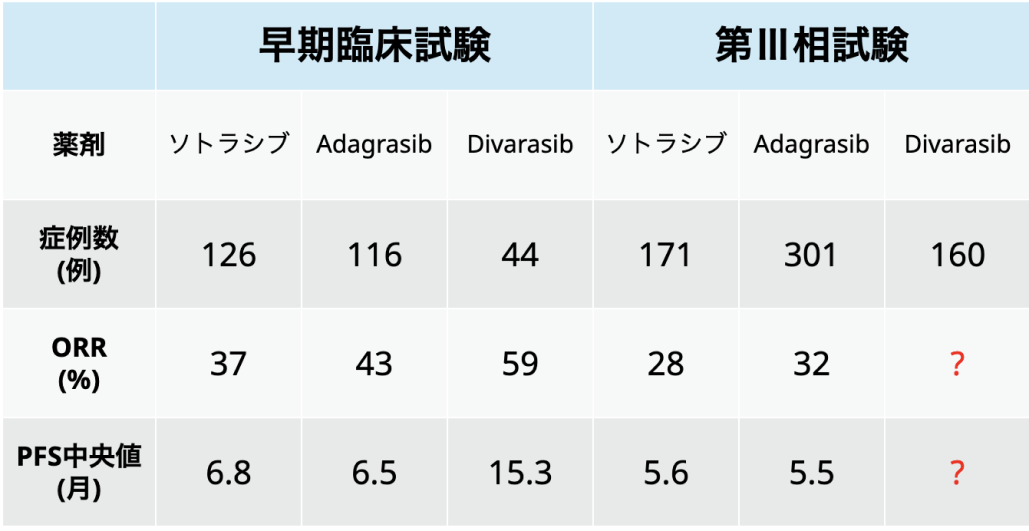
(村上晴泰氏提供資料を基に編集部作成)
Olomorasib単剤および併用療法
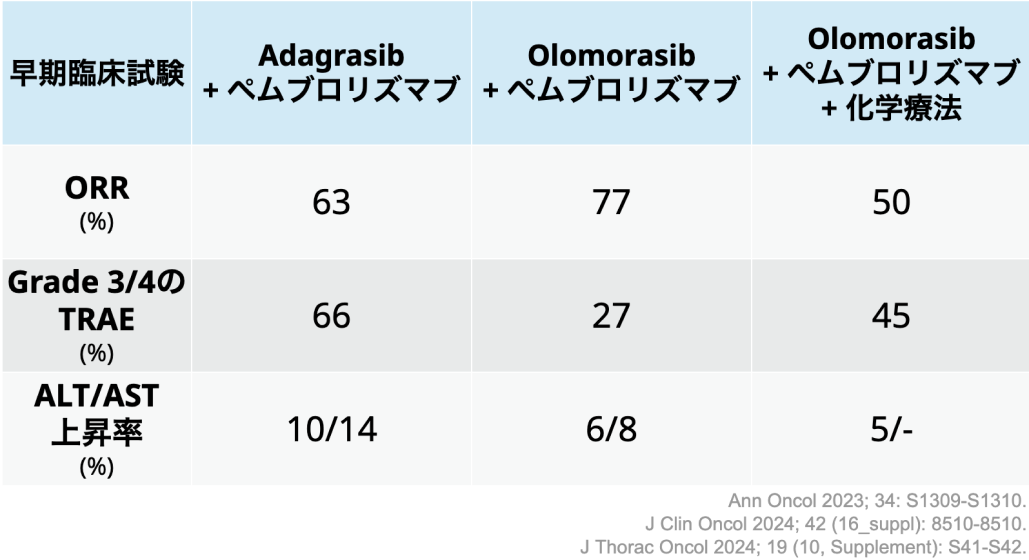
Olomorasibについては、 KRAS G12C変異陽性の進行固形癌患者(NSCLC患者を含む)を対象に同薬の有効性および安全性を評価した第Ⅰ/Ⅱ相試験LOXO-RAS-20001(NCT04956640)が実施され、 第Ia相の単剤投与パートにおいて、 既存のKRAS阻害薬に比べてグレード3以上の有害事象の頻度が低いなど良好な安全性が示された。 またKRAS阻害薬既治療の患者に対してもPFS中央値が8.1ヵ月と一定の効果を示した⁶⁾。
また、 同試験の第Ib相における、 NSCLC患者を対象としたOlomorasib+ペムブロリズマブ併用療法パートおよびOlomorasib+ペムブロリズマブ+化学療法(ペメトレキセド+プラチナ製剤)パートにおいて、 KRAS阻害薬の前治療歴がない1次治療の患者に対してORRが77%と良好な抗腫瘍活性が示されている⁷⁾⁸⁾。
この結果を受けて現在は、 KRAS G12C変異陽性の進行NSCLC患者における1次治療として、 ①PD-L1が50%以上の患者を対象にペムブロリズマブへのOlomorasibの併用を検証、 ②PD-L1の発現に関わらずペムブロリズマブ+化学療法(ペメトレキセド+プラチナ製剤) へのOlomorasiの併用を検証--を行う国際第Ⅲ相試験SUNRAY-01(NCT06119581)が進行中である。
村上氏は、 「Adagrasibについてもペムブロリズマブとの併用を検証した第Ⅲ相試験が行われており良好な抗腫瘍効果が報告されているものの、 Olomorasibについては、 グレード3以上の有害事象および肝機能障害の発現頻度が低いことが強みになると考えられる」 と考察した。
(村上晴泰氏提供資料を基に編集部作成)
KRAS(ON)阻害薬
こうしたKRAS(OFF)阻害薬の開発に加えて、 シャペロンを利用して複合体を形成することで標的タンパク質を阻害し、 活性型RASによる腫瘍増殖シグナルを抑制するKRAS(ON)阻害薬の開発も進められている。 現在開発中のKRAS(ON)阻害薬としてはRMC-6236などがあり、 また同様の作用機序を有する既存薬として、 ラパマイシン(別名 : シロリムス)、 シクロスポリンがあるという。
KRAS G12X変異陽性の進行固形癌患者(NSCLC患者を含む)を対象としたRMC-6236の第I相試験(NCT05379985)では、 許容できる安全性プロファイルと一定の効果が示されている⁹⁾。
タンパク質分解誘導キメラ分子
さらにタンパク質分解誘導キメラ分子(PROTAC)の開発も進められている。 PROTACは、 2つの異なる機能を有した活性領域とリンカーで構成されたヘテロ機能性分子であり、 1つはE3ユビキチンリガーゼと結合、 もう1つは分解を目的とする標的タンパク質(KRAS G12D)と結合する。 生体内において、 不要なタンパク質を分解する機構であるユビキチン-プロテアソームのシステムを利用して細胞内の標的タンパクであるKRAS G12Dを選択的に分解・除去する。
KRAS G12D変異陽性の進行固形癌患者(NSCLC患者を含む)を対象としたASP3082(PROTAC)の第I相試験(NCT05382559)では、 許容できる安全性プロファイルと一定の効果が報告されている¹⁰⁾。
今後に期待
これらより、 村上氏は 「ソトラシブの臨床開発が成功したことにより、 KRASを不活性型に維持することで効果を発揮する次世代のKRAS (OFF) 阻害薬の臨床開発が盛んに行われており、 1次治療も視野に入れた化学療法との併用療法の開発も進められている。 またKRAS (ON) 阻害薬やタンパク質分解誘導キメラ分子などの新しい作用機序の薬剤の早期臨床開発も積極的に行われている。 今後に期待したい」 と展望した。
出典
¹⁾ 肺癌診療ガイドライン -悪性胸膜中皮腫・胸腺腫瘍含む- 2024年版
²⁾ Lancet. 2023 Mar 4;401(10378):733-746.
³⁾ J Clin Oncol 2023; 41 (16_suppl):9006-9006.
⁴⁾ J Clin Oncol 2024; 42 (16_suppl):8512-8512.
⁵⁾ J Thorac Oncol 2024; 19 (10): S42-S43.
⁶⁾ J Clin Oncol 2024; 42 (16_suppl):3007-3007.
⁷⁾ J Clin Oncol 2024; 42 (16_suppl):8510-8510.
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。