Liso-cel:リソカブタゲン マラルユーセル(ブレヤンジ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| CAR発現T細胞として44×10⁶~100×10⁶個 点滴静注 | 1 | Day 1 |
前投薬
| Infusion reaction軽減のため、 投与約30-60分前に抗ヒスタミン薬とアセトアミノフェンを投与. |
その他
| CAR-T発現生T細胞としてCD8陽性細胞 (20×10⁶~50×10⁶個) 及びCD4陽性細胞 (20×10⁶~50×10⁶個)を、 合計細胞数が体重を問わず100×10⁶個を目標に投与. |
| 投与の2日前から7日前までにリンパ球除去化学療法を行う. |
| サイトカイン放出症候群の緊急時に備えて、 トシリズマブの在庫を確保する. |
| CD8陽性細胞を投与した後にCD4陽性細胞を投与. |
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*ブリストル・マイヤーズ スクイブ株式会社の外部サイトへ遷移します。
投与スケジュール

リンパ球除去化学療法 : Liso-cel投与の2~7日前までに、 1日1回3日間、 シクロホスファミド (CPA) 300 mg/m²を60分かけて点滴静注、 フルダラビン (FLU) 30mg/m²を30分かけて点滴静注 (腎機能に応じて減量)。 シクロホスファミド投与の前後には、 0.9%生理食塩液1,000mL (500mL/時) で補液を行う。 制吐薬の使用は可能だが、 ステロイドの使用は避ける。
Liso-cel : 投与前30~60分にアセトアミノフェンおよびヒスタミンH₁受容体拮抗薬を前投与し、 体重にかかわらずCAR-T細胞を100×10⁶個 (範囲 : 44~100×10⁶個) を目標に、 約0.5mL/分で単回静注投与。
Key Data|臨床試験結果
📊 TRANSFORM試験
Lancet. 2022;399(10343):2294-2308.
初回治療に対して難治性、 又は奏効後12ヵ月以内に再発した大細胞型B細胞リンパ腫 (LBCL) 患者184例 (18~75歳) を対象とした国際共同・第III相無作為化比較試験。 Liso-cel群と標準治療 (救援化学免疫療法+自家造血幹細胞移植) 群に1:1の比率で無作為に割り付け、 主要評価項目として無イベント生存期間 (EFS) が設定された。
標準治療群では、 救援化学療法としてR-DHAP、 R-ICE、 又はR-GDPのいずれかが使用された。
【有効性】Liso-cel群 (vs 標準治療群)
- EFS中央値 10.1ヵ月 (vs 2.3ヵ月)
- ハザード比 (HR) 0.35 (95%CI 0.23–0.53)
- 全奏効割合 86% (vs 48%)
- 完全奏効率 66% (vs 39%)
- 奏効期間中央値 未到達 (vs 14.5ヵ月)
- PFS中央値 14.8ヵ月 (vs 5.7ヵ月)
- HR 0.41 (95%CI 0.25–0.66)
- OS中央値 未到達 (vs 16.4ヵ月)
- HR 0.51 (95%CI 0.26–1.00)
【安全性】有害事象 : Grade 1–2 (Grade≧3)
- 好中球減少 47% (80%)
- 貧血 39% (49%)
- 血小板減少 33% (49%)
- 悪心 53% (3%)
- サイトカイン放出症候群 (CRS) 49% (1%)
- 遷延性血球減少 該当なし (43%)
- 頭痛 42% (4%)
- 疲労 39% (0%)
- 便秘 34% (2%)
- 下痢 25% (0%)
- 食欲減退 23% (1%)
- 発熱 29% (0%)
- リンパ球減少 9% (25%)
- 浮動性めまい 22% (0%)
- 低カリウム血症 17% (4%)
- 不眠症 21% (0%)
- 低血圧 20% (3%)
- 嘔吐 20% (1%)
- 背部痛 15% (1%)
- 末梢性浮腫 16% (1%)
- 白血球減少 10% (15%)
- 発熱性好中球減少症 4% (12%)
- 低マグネシウム血症 14% (0%)
- 腹痛 12% (3%)
- 関節痛 14% (0%)
- 咳嗽 14% (0%)
- 呼吸困難 13% (1%)
- 骨痛 13% (0%)
- 振戦 12% (1%)
- 筋肉痛 12% (1%)
- 無力症 10% (1%)
- 高血圧 10% (4%)
- 頻脈 10% (0%)
- 末梢性感覚ニューロパチー 8% (0%)
- 低リン血症 7% (3%)
- 消化不良 5% (0%)
- 口内炎 5% (0%)
- 粘膜炎 4% (0%)
📊 TRANSCEND FL試験
Nat Med. 2024;30(8):2199-2207.
再発または難治性の濾胞性リンパ腫 (FL) 患者130例を対象とした単群第II相試験。 全例に抗CD20抗体およびアルキル化剤による前治療歴があり、 初回免疫化学療法から24ヵ月以内に病勢進行したPOD24例や、 両薬剤に抵抗性を示す高リスク症例を含む2次治療ライン (2L) の23例を含む。 全例にliso-celを投与し、 主要評価項目として全奏効率が設定された。
【有効性】
3L以降のFL患者 (n=101) :
- 全奏効率 97% (95%CI 91.6–99.4)
- CR率 94% (95%CI 87.5–97.8)
- 奏効までの期間中央値 1ヵ月
- 奏効期間 (DOR) 中央値 未到達 (NR)
- 12ヵ月DOR率 82%
- PFS中央値 未到達
- 12ヵ月PFS率 81%
- OS中央値 未到達
- 12ヵ月OS率 92%
2LのFL患者 (n=23) :
- 全奏効率 96% (95%CI 78.1–99.9)
- CR率 96% (全奏効例がCRを達成)
- 奏効までの期間中央値 1ヵ月
- 奏効期間 (DOR) 中央値 未到達
- 12ヵ月DOR率 90%
- PFS中央値 未到達
- 12ヵ月PFS率 91%
- OS中央値 未到達
- 12ヵ月OS率 96%
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 好中球減少 65% (58%)
- CRS 58% (1%)
- 貧血 38% (10%)
- 頭痛 29% (0%)
- 血小板減少 25% (10%)
- 便秘 20% (0%)
- 発熱 18% (0%)
- 下痢 17% (0%)
- リンパ球減少 15% (13%)
- 疲労 15% (0%)
- 振戦 14% (0%)
- 白血球減少 14% (12%)
- 無力症 12% (0%)
各プロトコル
適格基準
TRANSFORM試験³⁾の主な適格基準 :
- 18歳以上75歳以下
- ECOG PS 0~1
- 好中球数≧1,000/μL
- 血小板数 ≧5万/μL
- 腎機能 : 血清クレアチニン<1.5×ULN又は CrCl≧45mL/min
- 肝機能 : ALT≦5×ULN、 T-Bil<2.0mg/dL
TRANSCEND FL試験⁴⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0~1
- 腎機能 : 血清クレアチニン<1.5×ULN又は CrCl>30mL/min
- 肝機能 : ALT≦5×ULN、 T-Bil<2.0mg/dL
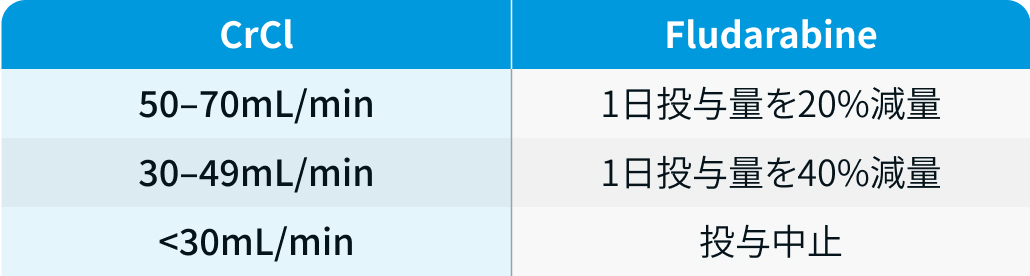
腎障害患者に対する用量調整
リンパ球除去化学療法においては、 フルダラビンを腎機能に応じて以下の通り減量する²⁾。
ブリッジング療法
臨床試験では、 白血球アフェレーシス後~リンパ球除去化学療法の間に行うブリッジング療法は、 リンパ球除去化学療法の開始7日前までに終了することが規定されていた²⁾。
TRANSFORM試験³⁾におけるブリッジング療法の実施割合 : 全体 (日本人)
- R-DHAP 14.1% (20%)
- R-ICE 31.5% (60%)
- R-GDP 17.4% (0%)
レジメンの特徴と注意点
作用機序の特徴
Liso-celは、 CD19を標的とするキメラ抗原受容体 (CAR) を導入した自家T細胞製剤であり、 CD4陽性・CD8陽性T細胞を規定比率で構成する。 CARは抗CD19抗体由来の一本鎖可変フラグメント (scFv)、 IgG4ヒンジ、 CD28膜貫通、 4-1BB共刺激、 CD3ζ活性化ドメインから構成される。 標的結合によりT細胞が活性化し、 サイトカイン産生や標的細胞の傷害が誘導される。
レジメンの位置付け
本剤は、 CD19を標的とするCAR-T療法の既往がない再発又は難治性の大細胞型B細胞リンパ腫 (DLBCL、 PMBCL、 tiNHL、 HGBCL) および濾胞性リンパ腫に適応される。 ただし、 PS3~4の患者および以下に該当する場合は投与対象ではない⁵⁾。
PS2の患者については、 その他の臨床状態を踏まえ、 投与の可否を判断する。

レジメン適用時の注意事項⁵⁾
Infusion reaction : 投与30~60分前に、 アセトアミノフェンとH1ブロッカーを前投与する。 副腎皮質ステロイド剤は、 生命を脅かす緊急時を除き使用しない。
CRS : 発熱、 低血圧、 頻脈、 悪寒、 CRP上昇、 低酸素、 頭痛、 倦怠感などに留意し、 十分な観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新のCRS管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
神経系事象 (ICANS含む) : 錯乱、 脳症、 失語、 幻覚、 精神状態変化、 譫妄、 嗜眠、 振戦、 傾眠、 意識レベル低下、 注意力・記憶・書字障害などの症状に十分留意して観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新の神経系事象管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
感染症・発熱性好中球減少症 : 活動性の感染症や炎症性疾患がある場合は、 投与を避ける。 細菌・真菌・ウイルスなどによる重度感染症や発熱性好中球減少症が発現し、 死亡例も報告されている。 状態を十分に観察し、 異常時には速やかに抗菌薬など適切な処置を行う。
ウイルス再活性化への注意 : B型・C型肝炎ウイルスキャリア又は既往感染者では、 肝炎ウイルス再活性化の可能性がある。 HIV感染者ではウイルス増加、 サイトメガロウイルス感染による肺炎や死亡の報告もある。 投与前には各種ウイルス (HBV、 HCV、 HIV、 CMV) の感染有無を確認し、 肝機能やウイルスマーカーのモニタリングを行うなど慎重な対応が求められる。
血球減少 : 好中球・血小板・リンパ球の減少や貧血などが数週間以上持続することがある。 定期的な血液検査を実施し、 患者の状態を継続的に観察する。
低γグロブリン血症 : 必要に応じて免疫グロブリン補充療法を検討する。
腫瘍崩壊症候群 : 血清電解質と腎機能を適宜評価し、 十分な観察を行う。
出典
- ブリストル・マイヤーズ スクイブ株式会社. ブレヤンジ静注 電子添文. 2025年3月改訂 (第1版).
- ブリストル・マイヤーズ スクイブ株式会社. ブレヤンジ静注 適正使用ガイド. 2025年3月作成.
- Lancet. 2022;399(10343):2294-2308.
- Nat Med. 2024;30(8):2199-2207.
- 厚生労働省. ブレヤンジ静注 最適使用推進ガイドライン 令和6年8月改訂.
最終更新 : 2025年8月6日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Liso-cel (Lisocabtagen maraleucel)
Liso-cel:リソカブタゲン マラルユーセル(ブレヤンジ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| CAR発現T細胞として44×10⁶~100×10⁶個 点滴静注 | 1 | Day 1 |
前投薬
| Infusion reaction軽減のため、 投与約30-60分前に抗ヒスタミン薬とアセトアミノフェンを投与. |
その他
| CAR-T発現生T細胞としてCD8陽性細胞 (20×10⁶~50×10⁶個) 及びCD4陽性細胞 (20×10⁶~50×10⁶個)を、 合計細胞数が体重を問わず100×10⁶個を目標に投与. |
| 投与の2日前から7日前までにリンパ球除去化学療法を行う. |
| サイトカイン放出症候群の緊急時に備えて、 トシリズマブの在庫を確保する. |
| CD8陽性細胞を投与した後にCD4陽性細胞を投与. |
概要
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*ブリストル・マイヤーズ スクイブ株式会社の外部サイトへ遷移します。
投与スケジュール

リンパ球除去化学療法 : Liso-cel投与の2~7日前までに、 1日1回3日間、 シクロホスファミド (CPA) 300 mg/m²を60分かけて点滴静注、 フルダラビン (FLU) 30mg/m²を30分かけて点滴静注 (腎機能に応じて減量)。 シクロホスファミド投与の前後には、 0.9%生理食塩液1,000mL (500mL/時) で補液を行う。 制吐薬の使用は可能だが、 ステロイドの使用は避ける。
Liso-cel : 投与前30~60分にアセトアミノフェンおよびヒスタミンH₁受容体拮抗薬を前投与し、 体重にかかわらずCAR-T細胞を100×10⁶個 (範囲 : 44~100×10⁶個) を目標に、 約0.5mL/分で単回静注投与。
Key Data|臨床試験結果
📊 TRANSFORM試験
Lancet. 2022;399(10343):2294-2308.
初回治療に対して難治性、 又は奏効後12ヵ月以内に再発した大細胞型B細胞リンパ腫 (LBCL) 患者184例 (18~75歳) を対象とした国際共同・第III相無作為化比較試験。 Liso-cel群と標準治療 (救援化学免疫療法+自家造血幹細胞移植) 群に1:1の比率で無作為に割り付け、 主要評価項目として無イベント生存期間 (EFS) が設定された。
標準治療群では、 救援化学療法としてR-DHAP、 R-ICE、 又はR-GDPのいずれかが使用された。
【有効性】Liso-cel群 (vs 標準治療群)
- EFS中央値 10.1ヵ月 (vs 2.3ヵ月)
- ハザード比 (HR) 0.35 (95%CI 0.23–0.53)
- 全奏効割合 86% (vs 48%)
- 完全奏効率 66% (vs 39%)
- 奏効期間中央値 未到達 (vs 14.5ヵ月)
- PFS中央値 14.8ヵ月 (vs 5.7ヵ月)
- HR 0.41 (95%CI 0.25–0.66)
- OS中央値 未到達 (vs 16.4ヵ月)
- HR 0.51 (95%CI 0.26–1.00)
【安全性】有害事象 : Grade 1–2 (Grade≧3)
- 好中球減少 47% (80%)
- 貧血 39% (49%)
- 血小板減少 33% (49%)
- 悪心 53% (3%)
- サイトカイン放出症候群 (CRS) 49% (1%)
- 遷延性血球減少 該当なし (43%)
- 頭痛 42% (4%)
- 疲労 39% (0%)
- 便秘 34% (2%)
- 下痢 25% (0%)
- 食欲減退 23% (1%)
- 発熱 29% (0%)
- リンパ球減少 9% (25%)
- 浮動性めまい 22% (0%)
- 低カリウム血症 17% (4%)
- 不眠症 21% (0%)
- 低血圧 20% (3%)
- 嘔吐 20% (1%)
- 背部痛 15% (1%)
- 末梢性浮腫 16% (1%)
- 白血球減少 10% (15%)
- 発熱性好中球減少症 4% (12%)
- 低マグネシウム血症 14% (0%)
- 腹痛 12% (3%)
- 関節痛 14% (0%)
- 咳嗽 14% (0%)
- 呼吸困難 13% (1%)
- 骨痛 13% (0%)
- 振戦 12% (1%)
- 筋肉痛 12% (1%)
- 無力症 10% (1%)
- 高血圧 10% (4%)
- 頻脈 10% (0%)
- 末梢性感覚ニューロパチー 8% (0%)
- 低リン血症 7% (3%)
- 消化不良 5% (0%)
- 口内炎 5% (0%)
- 粘膜炎 4% (0%)
📊 TRANSCEND FL試験
Nat Med. 2024;30(8):2199-2207.
再発または難治性の濾胞性リンパ腫 (FL) 患者130例を対象とした単群第II相試験。 全例に抗CD20抗体およびアルキル化剤による前治療歴があり、 初回免疫化学療法から24ヵ月以内に病勢進行したPOD24例や、 両薬剤に抵抗性を示す高リスク症例を含む2次治療ライン (2L) の23例を含む。 全例にliso-celを投与し、 主要評価項目として全奏効率が設定された。
【有効性】
3L以降のFL患者 (n=101) :
- 全奏効率 97% (95%CI 91.6–99.4)
- CR率 94% (95%CI 87.5–97.8)
- 奏効までの期間中央値 1ヵ月
- 奏効期間 (DOR) 中央値 未到達 (NR)
- 12ヵ月DOR率 82%
- PFS中央値 未到達
- 12ヵ月PFS率 81%
- OS中央値 未到達
- 12ヵ月OS率 92%
2LのFL患者 (n=23) :
- 全奏効率 96% (95%CI 78.1–99.9)
- CR率 96% (全奏効例がCRを達成)
- 奏効までの期間中央値 1ヵ月
- 奏効期間 (DOR) 中央値 未到達
- 12ヵ月DOR率 90%
- PFS中央値 未到達
- 12ヵ月PFS率 91%
- OS中央値 未到達
- 12ヵ月OS率 96%
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 好中球減少 65% (58%)
- CRS 58% (1%)
- 貧血 38% (10%)
- 頭痛 29% (0%)
- 血小板減少 25% (10%)
- 便秘 20% (0%)
- 発熱 18% (0%)
- 下痢 17% (0%)
- リンパ球減少 15% (13%)
- 疲労 15% (0%)
- 振戦 14% (0%)
- 白血球減少 14% (12%)
- 無力症 12% (0%)
各プロトコル
適格基準
TRANSFORM試験³⁾の主な適格基準 :
- 18歳以上75歳以下
- ECOG PS 0~1
- 好中球数≧1,000/μL
- 血小板数 ≧5万/μL
- 腎機能 : 血清クレアチニン<1.5×ULN又は CrCl≧45mL/min
- 肝機能 : ALT≦5×ULN、 T-Bil<2.0mg/dL
TRANSCEND FL試験⁴⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0~1
- 腎機能 : 血清クレアチニン<1.5×ULN又は CrCl>30mL/min
- 肝機能 : ALT≦5×ULN、 T-Bil<2.0mg/dL
腎障害患者に対する用量調整
リンパ球除去化学療法においては、 フルダラビンを腎機能に応じて以下の通り減量する²⁾。

ブリッジング療法
臨床試験では、 白血球アフェレーシス後~リンパ球除去化学療法の間に行うブリッジング療法は、 リンパ球除去化学療法の開始7日前までに終了することが規定されていた²⁾。
TRANSFORM試験³⁾におけるブリッジング療法の実施割合 : 全体 (日本人)
- R-DHAP 14.1% (20%)
- R-ICE 31.5% (60%)
- R-GDP 17.4% (0%)
レジメンの特徴と注意点
作用機序の特徴
Liso-celは、 CD19を標的とするキメラ抗原受容体 (CAR) を導入した自家T細胞製剤であり、 CD4陽性・CD8陽性T細胞を規定比率で構成する。 CARは抗CD19抗体由来の一本鎖可変フラグメント (scFv)、 IgG4ヒンジ、 CD28膜貫通、 4-1BB共刺激、 CD3ζ活性化ドメインから構成される。 標的結合によりT細胞が活性化し、 サイトカイン産生や標的細胞の傷害が誘導される。
レジメンの位置付け
本剤は、 CD19を標的とするCAR-T療法の既往がない再発又は難治性の大細胞型B細胞リンパ腫 (DLBCL、 PMBCL、 tiNHL、 HGBCL) および濾胞性リンパ腫に適応される。 ただし、 PS3~4の患者および以下に該当する場合は投与対象ではない⁵⁾。
PS2の患者については、 その他の臨床状態を踏まえ、 投与の可否を判断する。

レジメン適用時の注意事項⁵⁾
Infusion reaction : 投与30~60分前に、 アセトアミノフェンとH1ブロッカーを前投与する。 副腎皮質ステロイド剤は、 生命を脅かす緊急時を除き使用しない。
CRS : 発熱、 低血圧、 頻脈、 悪寒、 CRP上昇、 低酸素、 頭痛、 倦怠感などに留意し、 十分な観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新のCRS管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
神経系事象 (ICANS含む) : 錯乱、 脳症、 失語、 幻覚、 精神状態変化、 譫妄、 嗜眠、 振戦、 傾眠、 意識レベル低下、 注意力・記憶・書字障害などの症状に十分留意して観察を行う。 異常が認められた場合は、 製造販売業者が提供する最新の神経系事象管理アルゴリズムおよび関連情報に基づき、 適切に対応する。
感染症・発熱性好中球減少症 : 活動性の感染症や炎症性疾患がある場合は、 投与を避ける。 細菌・真菌・ウイルスなどによる重度感染症や発熱性好中球減少症が発現し、 死亡例も報告されている。 状態を十分に観察し、 異常時には速やかに抗菌薬など適切な処置を行う。
ウイルス再活性化への注意 : B型・C型肝炎ウイルスキャリア又は既往感染者では、 肝炎ウイルス再活性化の可能性がある。 HIV感染者ではウイルス増加、 サイトメガロウイルス感染による肺炎や死亡の報告もある。 投与前には各種ウイルス (HBV、 HCV、 HIV、 CMV) の感染有無を確認し、 肝機能やウイルスマーカーのモニタリングを行うなど慎重な対応が求められる。
血球減少 : 好中球・血小板・リンパ球の減少や貧血などが数週間以上持続することがある。 定期的な血液検査を実施し、 患者の状態を継続的に観察する。
低γグロブリン血症 : 必要に応じて免疫グロブリン補充療法を検討する。
腫瘍崩壊症候群 : 血清電解質と腎機能を適宜評価し、 十分な観察を行う。
出典
- ブリストル・マイヤーズ スクイブ株式会社. ブレヤンジ静注 電子添文. 2025年3月改訂 (第1版).
- ブリストル・マイヤーズ スクイブ株式会社. ブレヤンジ静注 適正使用ガイド. 2025年3月作成.
- Lancet. 2022;399(10343):2294-2308.
- Nat Med. 2024;30(8):2199-2207.
- 厚生労働省. ブレヤンジ静注 最適使用推進ガイドライン 令和6年8月改訂.
最終更新 : 2025年8月6日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
