Elranatamab:エルラナタマブ(エルレフィオ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 12mg 皮下注 | 1週目 | Day 1 (1週目) |
| 32mg 皮下注 | 1週目 | Day 4 (1週目) |
| 76mg 皮下注 | 2~24週目 | 1週間に1回 |
| 76mg 皮下注 | 25~48週目 | 2週間に1回 (奏効のみ) |
| 76mg 皮下注 | 49週目以降 | 4週間に1回 |
前投薬
| サイトカイン放出症候群を軽減するため、 1日目、 4日目、 2週目の投与前には、 約1時間前に解熱鎮痛薬・副腎皮質ホルモン薬・抗ヒスタミン薬を前投与 |
| MagnetisMM-3試験ではデキサメタゾン20mg、 アセトアミノフェン650mg、 ジフェンヒドラミン25mgが投与された. |
| Day 15以降は同様の前投薬の投与を考慮. |
その他
| 重篤なCRSに備えてトシリズマブを速やかに使用できるよう準備する. |
| 対象:免疫調節薬、 プロテアソーム阻害薬、 抗CD38抗体薬を含む少なくとも3つの標準的な治療が無効又は治療後に再発した患者. |
2025年6月24日、 用法・用量の追加承認を取得し、 一定期間経過後には4週間隔での投与も可能となった。
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
「ファイザー株式会社」 の外部サイトへ遷移します.
投与スケジュール
【1コース】28日間
【催吐性】 軽度*
【FN発症】低リスク**
*NCCN Guidelines Version 2.2025 Antiemesisを基に分類
**エルレフィオ®電子添文 (FN発症率2.2%) を基に編集部が分類
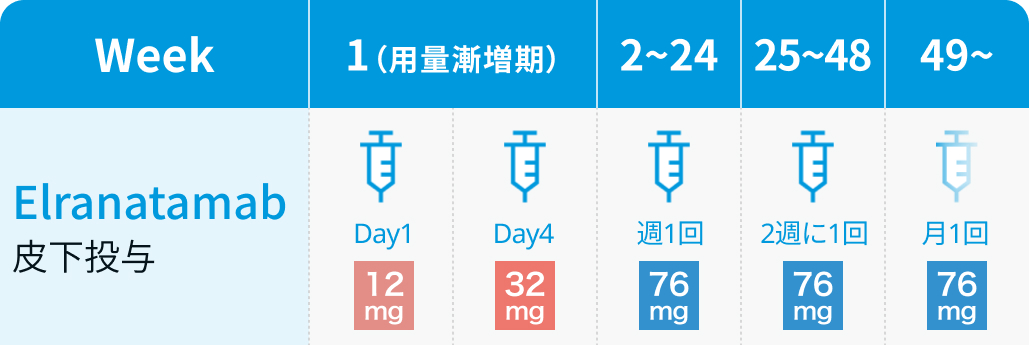
1日目に12mg、 4日目に32mgを1回皮下投与し、 8日目以降は76mgを週1回皮下投与。 24週以上投与して奏効が認められる場合、 2週間隔とし、 さらに2週間隔で24週以上継続した場合は、 4週間隔への変更が可能。
サイトカイン放出症候群を軽減するため、 1日目、 4日目、 2週目の投与前には、 約1時間前に解熱鎮痛薬・副腎皮質ホルモン薬*・抗ヒスタミン薬を前投与
*MagnetisMM-3試験³⁾では、 デキサメタゾン20mg (または同等量) が経口または静脈内で投与された。
Key Data|臨床試験結果
📊 MagnetisMM-3試験
Nat Med. 2023 Sep;29(9):2259-2267.
概要
- 試験デザイン : 非無作為化、 非盲検、 多施設国際共同、 第Ⅱ相試験.
- 対象 : 再発又は難治性の多発性骨髄腫*187例. IMiD、 PI及び抗CD38抗体のそれぞれ少なくとも1剤に対して治療抵抗性を示す (前治療のレジメン数を問わない).
- コホートA : 123例 (日本人12例を含む)、 BCMA標的治療歴のない患者.
- コホートB : 64例、 BCMA標的治療歴 (ADC又はCAR-T細胞療法) のある患者.
IMiD (免疫調整薬)、 PI (プロテアソーム阻害剤).
sCR : 厳格な完全奏効、 CR : 完全奏効、 VGPR : 最良部分奏効、 PR : 部分奏効.
全奏効率 : ORR (PR以上)、 無増悪生存期間 : PFS、 奏効までの期間 : TTR、 奏効期間 : DOR、 イベントフリー期間 : EFS、 全生存期間 : OS
【有効性】
<コホートA (BCMA標的治療歴なし)>
- 追跡期間中央値 : 38ヵ月 (0.23-20.14ヵ月).
- ORR : 61.0% (95%CI 51.8-69.6).
- sCR 13.0%、 CR 14.6%、 VGPR 27.6%、 PR 5.7%.
- MRD陰性率* : 9% (95%CI 70.84-98.88).
*sCR又はCRを達成した34例で、 検体が評価可能であった22例のうちの20例
- PFS中央値 : 未到達 (95%CI 10.4ヵ月-NE).
- 9ヵ月EFS : 63.0% (95%CI 53.2-71.4).
- 奏効例におけるTTR中央値 : 1.22ヵ月 (95%CI 0.89-7.36ヵ月).
- CR以上の奏効例におけるCR以上の奏効が得られるまでの期間の中央値 : 5.37ヵ月 (1.22-12.22ヵ月).
- DOR中央値 : 未到達 (12.0ヵ月-NE).
- 9ヵ月時点での奏効持続 : 4% (95%CI 72.7-91.4).
- OS中央値 : 未到達 (95%CI NE-NE).
- 9ヵ月OS : 3% (95%CI 61.3-77.6).
<コホートB (BCMA標的治療歴あり)>
- 追跡期間中央値 : 22ヵ月 (0.33-12.32ヵ月).
- ORR : 7% (95%CI 18.9-42.4).
- sCR 0%、 CR 7.8%、 VGPR 25.0%、 PR 1.6%.
- MRD陰性率 : sCR又はCRを達成した5例で、 検体が評価可能であった2例のうち2例がMRD陰性.
- PFS中央値 : 5ヵ月 (95%CI 19.-6.6).
- 9ヵ月EFS : 0% (95%CI 22.9-47.2).
- TTR : 92ヵ月 (0.92-6.74ヵ月).
- CR以上の奏効例におけるCR以上の奏効が得られるまでの期間の中央値 : 5.52ヵ月 (3.95-8.54ヵ月).
- DOR中央値 : 未到達 (NE-NE).
- 9ヵ月時点での奏効持続 : 1% (95%CI 60.5-95.0)
- OS中央値 : 未到達 (95%CI 6.5ヵ月-NE).
- 9ヵ月OS : 9% (95%CI 45.7-69.8).
【安全性】
- 貧血 (53.6%、 ≧Grade3 42.1%)
- 好中球減少症 (30.1%、 ≧Grade3 29.0%)
- 血小板減少症 (21.9%、 ≧Grade3 21.9%)
- リンパ球減少症 (15.3%、 ≧Grade3 13.1%)
- サイトカイン放出症候群 (CRS) (57.9%、 ≧Grade3 0.5%)
- 下痢 (35.5%、 ≧Grade3 1.1%)
- 疲労 (26.8%、 ≧Grade3 1.6%)
- 食欲減退 (26.2%、 ≧Grade3 1.1%)
- 注射部位反応 (21.3%、 ≧Grade3 0%)
- 発熱 (23%、 ≧Grade3 2.7%)
- 悪心 (21.3%、 ≧Grade3 0%)
- 低カリウム血症 (21.3%、 ≧Grade3 8.2%)
- 頭痛 (21.3%、 Grade3≧0%)
- 咳嗽 (19.7%、 ≧Grade3 0%)
- 皮膚乾燥 (13.7%、 ≧Grade3 0%)
- SARS-Cov-2検査陽性 (20.8%、 ≧Grade3 4.9%)
- 嘔吐 (14.2%、 ≧Grade3 0%)
- 肺炎 (12.0%、 ≧Grade3 0%)
- 無力症 (18.0%、 ≧Grade3 3.8%)
- 便秘 (14.2%、 ≧Grade3 0%)
- アスパラギン酸アミノトランスフェラーゼ増加 (13.7%、 ≧Grade3 3.8%)
- 上気道感染 (15.8%、 ≧Grade3 0%)
- アラニンアミノトランスフェラーゼ増加 (13.7%、 ≧Grade3 4.4%)
- 関節痛 (13.7%、 ≧Grade3 1.1%)
- 背部痛 (10.9%、 ≧Grade3 1.6%)
- 呼吸困難 (12.0%、 ≧Grade3 3.3%)
- 四肢痛 (10.9%、 ≧Grade3 0%)
- 転倒 (10.4%、 ≧Grade3 0.5%)
- 低マグネシウム血症 (10.4%、 ≧Grade3 0%)
- 不眠症 (13.1%、 ≧Grade3 0%)
- 低ナトリウム血症 (10.9%、 ≧Grade3 2.2%)
- 末梢性浮腫 (10.9%、 ≧Grade3 1.1%)
- 血中クレアチニン増加 (10.4%、 ≧Grade3 0.5%)
- COVID-19肺炎 (12.6%、 ≧Grade3 13.7%)
- 皮膚剥離 (10.4%、 ≧Grade3 0%)
- 末梢性ニューロパチー (19.1%)
- 低γグロブリン血症 (13.1%)
- 間質性肺疾患 (1.6%)
各プロトコル
有害事象発現時の休薬・中止基準
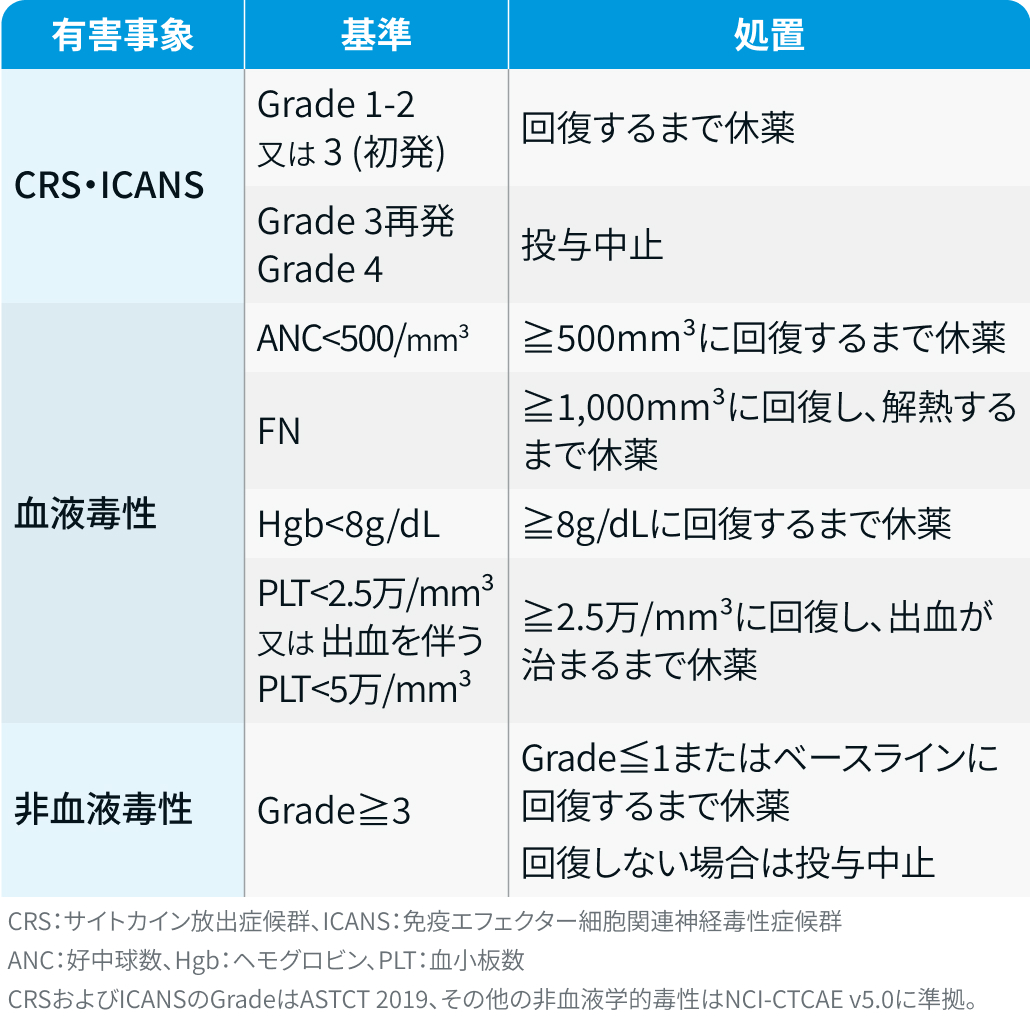
エルレフィオ®電子添文¹⁾を基に編集部作成
休薬後に再開する場合の用量調整
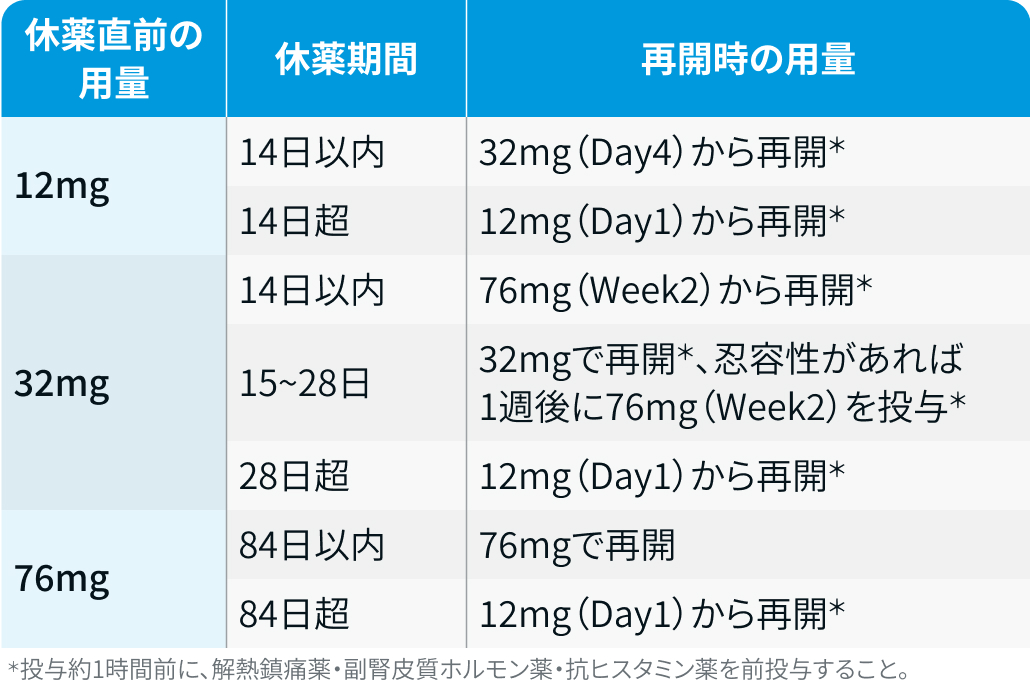
エルレフィオ®電子添文¹⁾を基に編集部作成
レジメンの特徴と注意点
特徴
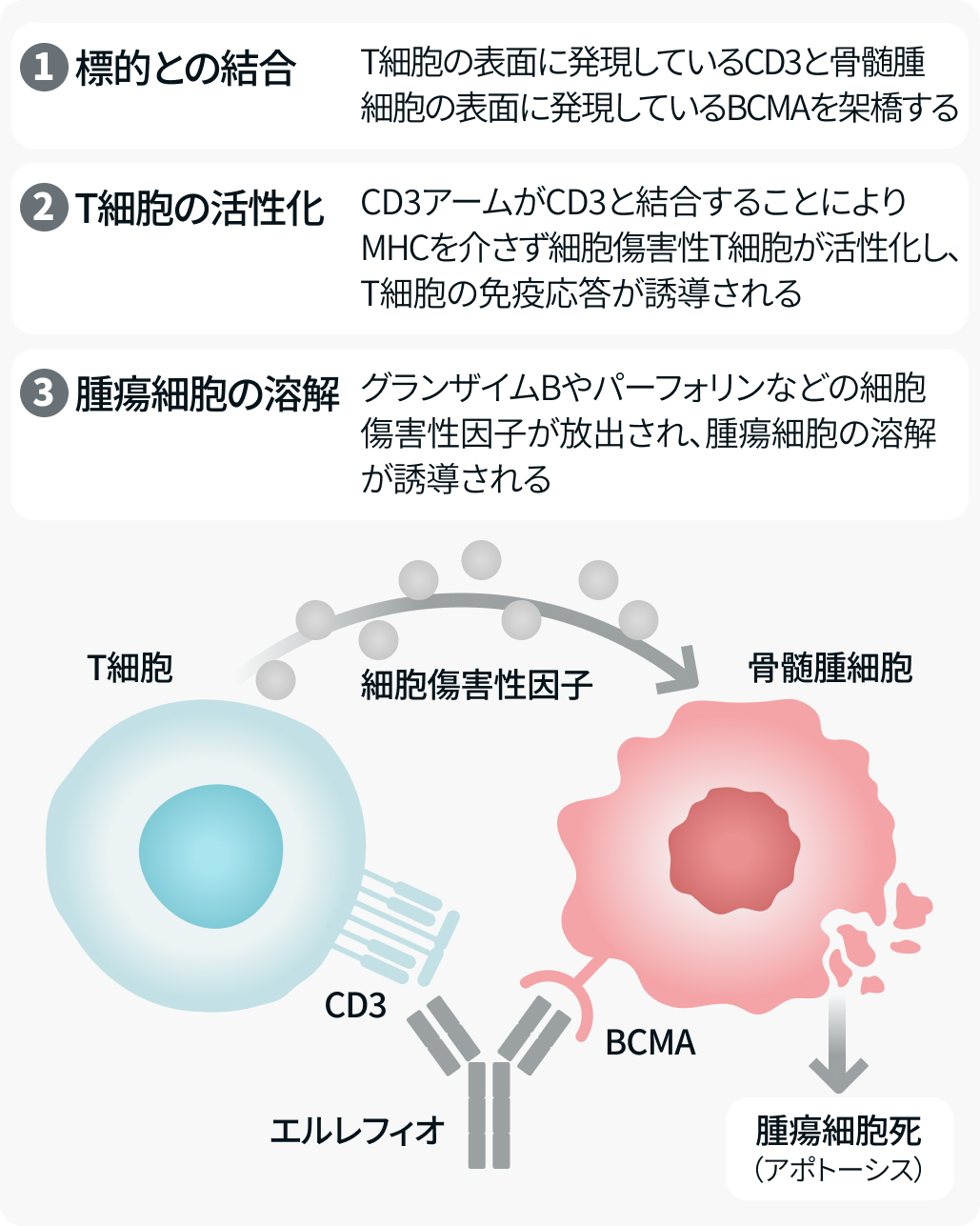
- エルラナタナブはB細胞成熟抗原 (BCMA) およびCD3に対するヒト化免疫グロブリン (Ig)G2二重特異性モノクローナル抗体.
- T細胞の細胞膜上に発現するCD3と骨髄腫細胞の細胞膜上に発現するBCMAの両者に結合することによりT細胞を活性化し、 BCMA陽性の腫瘍細胞を傷害すると考えられている (下図).
- 他の抗悪性腫瘍剤との併用について有効性及び安全性は確立していない.
- 免疫調節薬、 プロテアソーム阻害剤及び抗CD38モノクローナル抗体製剤を含む少なくとも3つの標準的な治療が無効又は治療後に再発した患者が対象.
- 注射部位は腹部が推奨されているが腹部に注射できない場合には、 大腿部を選択することも可能.
- 上肢 (三角筋、 上腕、 前腕など)への皮下注射は避ける.
作用機序
CRSのマネジメント
- CRSを軽減させるため本剤投与前に、 解熱鎮痛薬、 副腎皮質ホルモン剤及び抗ヒスタミン剤を投与する (day1、4、8は前投薬必須、 以降は使用を考慮).
- 初回投与後48時間、 2回目の投与後24時間は必ず入院管理とする. 以降の投与についても患者の状態に応じて入院管理を検討.
- 緊急時に備えてトシリズマブを速やかに使用できるように準備しておく.
- 異常が認められた場合には、 製造販売業者が提供するCRS管理ガイダンス等に従い適切な処置を行う.
- CRS発現までの期間の中央値 : 2日
- CRS回復までの期間の中央値は2日
ICANSのマネジメント
- 異常が認められた場合には、 製造販売業者が提供するICANS管理ガイダンスに従い適切な処置を行う.
- ICANS発現までの期間の中央値 : 3日
- ICANS回復までの期間の中央値 : 2日
出典
- ファイザー株式会社. エルレフィオ®皮下注 電子添文 (2025年6月改訂 第3版)
- ファイザー株式会社. エルレフィオ®皮下注 適正使用ガイド (2025年6月作成)
- Nat Med.2023 Sep;29(9):2259-2267.
最終更新 : 2025年7月3日
執筆担当 : 小澤病院薬剤部 長剛広
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Elranatamab
Elranatamab:エルラナタマブ(エルレフィオ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 12mg 皮下注 | 1週目 | Day 1 (1週目) |
| 32mg 皮下注 | 1週目 | Day 4 (1週目) |
| 76mg 皮下注 | 2~24週目 | 1週間に1回 |
| 76mg 皮下注 | 25~48週目 | 2週間に1回 (奏効のみ) |
| 76mg 皮下注 | 49週目以降 | 4週間に1回 |
前投薬
| サイトカイン放出症候群を軽減するため、 1日目、 4日目、 2週目の投与前には、 約1時間前に解熱鎮痛薬・副腎皮質ホルモン薬・抗ヒスタミン薬を前投与 |
| MagnetisMM-3試験ではデキサメタゾン20mg、 アセトアミノフェン650mg、 ジフェンヒドラミン25mgが投与された. |
| Day 15以降は同様の前投薬の投与を考慮. |
その他
| 重篤なCRSに備えてトシリズマブを速やかに使用できるよう準備する. |
| 対象:免疫調節薬、 プロテアソーム阻害薬、 抗CD38抗体薬を含む少なくとも3つの標準的な治療が無効又は治療後に再発した患者. |
概要
2025年6月24日、 用法・用量の追加承認を取得し、 一定期間経過後には4週間隔での投与も可能となった。
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
「ファイザー株式会社」 の外部サイトへ遷移します.
投与スケジュール
【1コース】28日間
【催吐性】 軽度*
【FN発症】低リスク**
*NCCN Guidelines Version 2.2025 Antiemesisを基に分類
**エルレフィオ®電子添文 (FN発症率2.2%) を基に編集部が分類

1日目に12mg、 4日目に32mgを1回皮下投与し、 8日目以降は76mgを週1回皮下投与。 24週以上投与して奏効が認められる場合、 2週間隔とし、 さらに2週間隔で24週以上継続した場合は、 4週間隔への変更が可能。
サイトカイン放出症候群を軽減するため、 1日目、 4日目、 2週目の投与前には、 約1時間前に解熱鎮痛薬・副腎皮質ホルモン薬*・抗ヒスタミン薬を前投与
*MagnetisMM-3試験³⁾では、 デキサメタゾン20mg (または同等量) が経口または静脈内で投与された。
Key Data|臨床試験結果
📊 MagnetisMM-3試験
Nat Med. 2023 Sep;29(9):2259-2267.
概要
- 試験デザイン : 非無作為化、 非盲検、 多施設国際共同、 第Ⅱ相試験.
- 対象 : 再発又は難治性の多発性骨髄腫*187例. IMiD、 PI及び抗CD38抗体のそれぞれ少なくとも1剤に対して治療抵抗性を示す (前治療のレジメン数を問わない).
- コホートA : 123例 (日本人12例を含む)、 BCMA標的治療歴のない患者.
- コホートB : 64例、 BCMA標的治療歴 (ADC又はCAR-T細胞療法) のある患者.
IMiD (免疫調整薬)、 PI (プロテアソーム阻害剤).
sCR : 厳格な完全奏効、 CR : 完全奏効、 VGPR : 最良部分奏効、 PR : 部分奏効.
全奏効率 : ORR (PR以上)、 無増悪生存期間 : PFS、 奏効までの期間 : TTR、 奏効期間 : DOR、 イベントフリー期間 : EFS、 全生存期間 : OS
【有効性】
<コホートA (BCMA標的治療歴なし)>
- 追跡期間中央値 : 38ヵ月 (0.23-20.14ヵ月).
- ORR : 61.0% (95%CI 51.8-69.6).
- sCR 13.0%、 CR 14.6%、 VGPR 27.6%、 PR 5.7%.
- MRD陰性率* : 9% (95%CI 70.84-98.88).
*sCR又はCRを達成した34例で、 検体が評価可能であった22例のうちの20例
- PFS中央値 : 未到達 (95%CI 10.4ヵ月-NE).
- 9ヵ月EFS : 63.0% (95%CI 53.2-71.4).
- 奏効例におけるTTR中央値 : 1.22ヵ月 (95%CI 0.89-7.36ヵ月).
- CR以上の奏効例におけるCR以上の奏効が得られるまでの期間の中央値 : 5.37ヵ月 (1.22-12.22ヵ月).
- DOR中央値 : 未到達 (12.0ヵ月-NE).
- 9ヵ月時点での奏効持続 : 4% (95%CI 72.7-91.4).
- OS中央値 : 未到達 (95%CI NE-NE).
- 9ヵ月OS : 3% (95%CI 61.3-77.6).
<コホートB (BCMA標的治療歴あり)>
- 追跡期間中央値 : 22ヵ月 (0.33-12.32ヵ月).
- ORR : 7% (95%CI 18.9-42.4).
- sCR 0%、 CR 7.8%、 VGPR 25.0%、 PR 1.6%.
- MRD陰性率 : sCR又はCRを達成した5例で、 検体が評価可能であった2例のうち2例がMRD陰性.
- PFS中央値 : 5ヵ月 (95%CI 19.-6.6).
- 9ヵ月EFS : 0% (95%CI 22.9-47.2).
- TTR : 92ヵ月 (0.92-6.74ヵ月).
- CR以上の奏効例におけるCR以上の奏効が得られるまでの期間の中央値 : 5.52ヵ月 (3.95-8.54ヵ月).
- DOR中央値 : 未到達 (NE-NE).
- 9ヵ月時点での奏効持続 : 1% (95%CI 60.5-95.0)
- OS中央値 : 未到達 (95%CI 6.5ヵ月-NE).
- 9ヵ月OS : 9% (95%CI 45.7-69.8).
【安全性】
- 貧血 (53.6%、 ≧Grade3 42.1%)
- 好中球減少症 (30.1%、 ≧Grade3 29.0%)
- 血小板減少症 (21.9%、 ≧Grade3 21.9%)
- リンパ球減少症 (15.3%、 ≧Grade3 13.1%)
- サイトカイン放出症候群 (CRS) (57.9%、 ≧Grade3 0.5%)
- 下痢 (35.5%、 ≧Grade3 1.1%)
- 疲労 (26.8%、 ≧Grade3 1.6%)
- 食欲減退 (26.2%、 ≧Grade3 1.1%)
- 注射部位反応 (21.3%、 ≧Grade3 0%)
- 発熱 (23%、 ≧Grade3 2.7%)
- 悪心 (21.3%、 ≧Grade3 0%)
- 低カリウム血症 (21.3%、 ≧Grade3 8.2%)
- 頭痛 (21.3%、 Grade3≧0%)
- 咳嗽 (19.7%、 ≧Grade3 0%)
- 皮膚乾燥 (13.7%、 ≧Grade3 0%)
- SARS-Cov-2検査陽性 (20.8%、 ≧Grade3 4.9%)
- 嘔吐 (14.2%、 ≧Grade3 0%)
- 肺炎 (12.0%、 ≧Grade3 0%)
- 無力症 (18.0%、 ≧Grade3 3.8%)
- 便秘 (14.2%、 ≧Grade3 0%)
- アスパラギン酸アミノトランスフェラーゼ増加 (13.7%、 ≧Grade3 3.8%)
- 上気道感染 (15.8%、 ≧Grade3 0%)
- アラニンアミノトランスフェラーゼ増加 (13.7%、 ≧Grade3 4.4%)
- 関節痛 (13.7%、 ≧Grade3 1.1%)
- 背部痛 (10.9%、 ≧Grade3 1.6%)
- 呼吸困難 (12.0%、 ≧Grade3 3.3%)
- 四肢痛 (10.9%、 ≧Grade3 0%)
- 転倒 (10.4%、 ≧Grade3 0.5%)
- 低マグネシウム血症 (10.4%、 ≧Grade3 0%)
- 不眠症 (13.1%、 ≧Grade3 0%)
- 低ナトリウム血症 (10.9%、 ≧Grade3 2.2%)
- 末梢性浮腫 (10.9%、 ≧Grade3 1.1%)
- 血中クレアチニン増加 (10.4%、 ≧Grade3 0.5%)
- COVID-19肺炎 (12.6%、 ≧Grade3 13.7%)
- 皮膚剥離 (10.4%、 ≧Grade3 0%)
- 末梢性ニューロパチー (19.1%)
- 低γグロブリン血症 (13.1%)
- 間質性肺疾患 (1.6%)
各プロトコル
有害事象発現時の休薬・中止基準

エルレフィオ®電子添文¹⁾を基に編集部作成
休薬後に再開する場合の用量調整

エルレフィオ®電子添文¹⁾を基に編集部作成
レジメンの特徴と注意点
特徴
- エルラナタナブはB細胞成熟抗原 (BCMA) およびCD3に対するヒト化免疫グロブリン (Ig)G2二重特異性モノクローナル抗体.
- T細胞の細胞膜上に発現するCD3と骨髄腫細胞の細胞膜上に発現するBCMAの両者に結合することによりT細胞を活性化し、 BCMA陽性の腫瘍細胞を傷害すると考えられている (下図).
- 他の抗悪性腫瘍剤との併用について有効性及び安全性は確立していない.
- 免疫調節薬、 プロテアソーム阻害剤及び抗CD38モノクローナル抗体製剤を含む少なくとも3つの標準的な治療が無効又は治療後に再発した患者が対象.
- 注射部位は腹部が推奨されているが腹部に注射できない場合には、 大腿部を選択することも可能.
- 上肢 (三角筋、 上腕、 前腕など)への皮下注射は避ける.
作用機序

CRSのマネジメント
- CRSを軽減させるため本剤投与前に、 解熱鎮痛薬、 副腎皮質ホルモン剤及び抗ヒスタミン剤を投与する (day1、4、8は前投薬必須、 以降は使用を考慮).
- 初回投与後48時間、 2回目の投与後24時間は必ず入院管理とする. 以降の投与についても患者の状態に応じて入院管理を検討.
- 緊急時に備えてトシリズマブを速やかに使用できるように準備しておく.
- 異常が認められた場合には、 製造販売業者が提供するCRS管理ガイダンス等に従い適切な処置を行う.
- CRS発現までの期間の中央値 : 2日
- CRS回復までの期間の中央値は2日
ICANSのマネジメント
- 異常が認められた場合には、 製造販売業者が提供するICANS管理ガイダンスに従い適切な処置を行う.
- ICANS発現までの期間の中央値 : 3日
- ICANS回復までの期間の中央値 : 2日
出典
- ファイザー株式会社. エルレフィオ®皮下注 電子添文 (2025年6月改訂 第3版)
- ファイザー株式会社. エルレフィオ®皮下注 適正使用ガイド (2025年6月作成)
- Nat Med.2023 Sep;29(9):2259-2267.
最終更新 : 2025年7月3日
執筆担当 : 小澤病院薬剤部 長剛広
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
