FCM:Ferric carboxymaltose(フェインジェクト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg | 1~ | 週1回 (最大3回*) |
| - | - | *Hb値及び体重による |
前投薬
| なし. |
その他
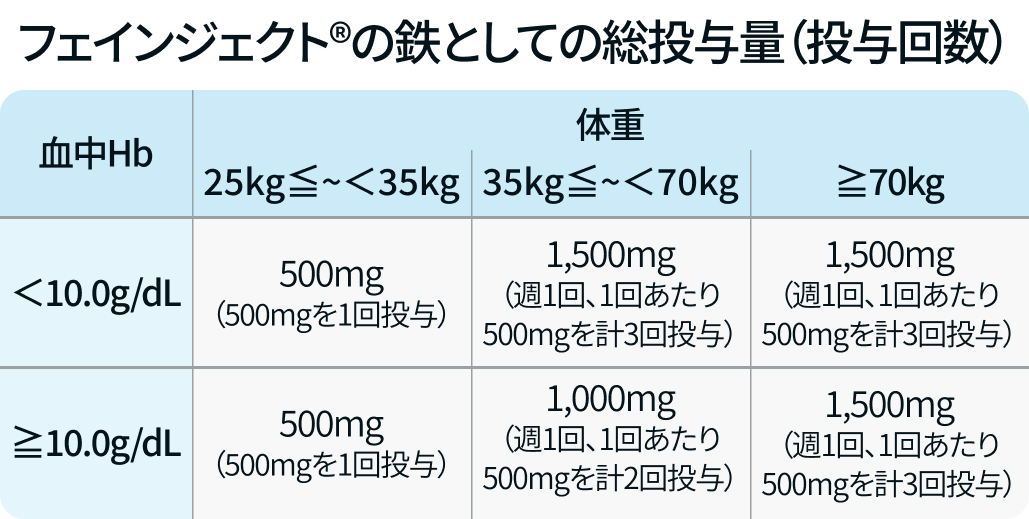
| 血中Hb値及び体重に応じて週1回500mgを静脈内投与. |
| 総投与量の上限は鉄として1500mg. |
| 再治療の必要性は投与終了後4週以降を目安に総合的に判断. |
本コンテンツは特定の治療法を推奨するものではございません.個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*総合製品情報概要は「ゼリア新薬工業株式会社」の外部サイトへ遷移します.
主な有害事象
フェインジェクト®総合製品情報概要より引用
主な有害事象
• 血中リン減少 (20.1%)
その他の副作用
- 頭痛 (4.3%)
- γGTP増加、 肝機能検査値上昇 (1%以上)
- 上腹部痛、 悪心 (1%以上)
- 蕁麻疹 (1%以上)
- 発熱、 月経過多 (1%以上)
- 倦怠感 (0.1%~1%未満)
- 背部痛、 投与部位疼痛 (頻度不明)
特徴と注意点
作用機序
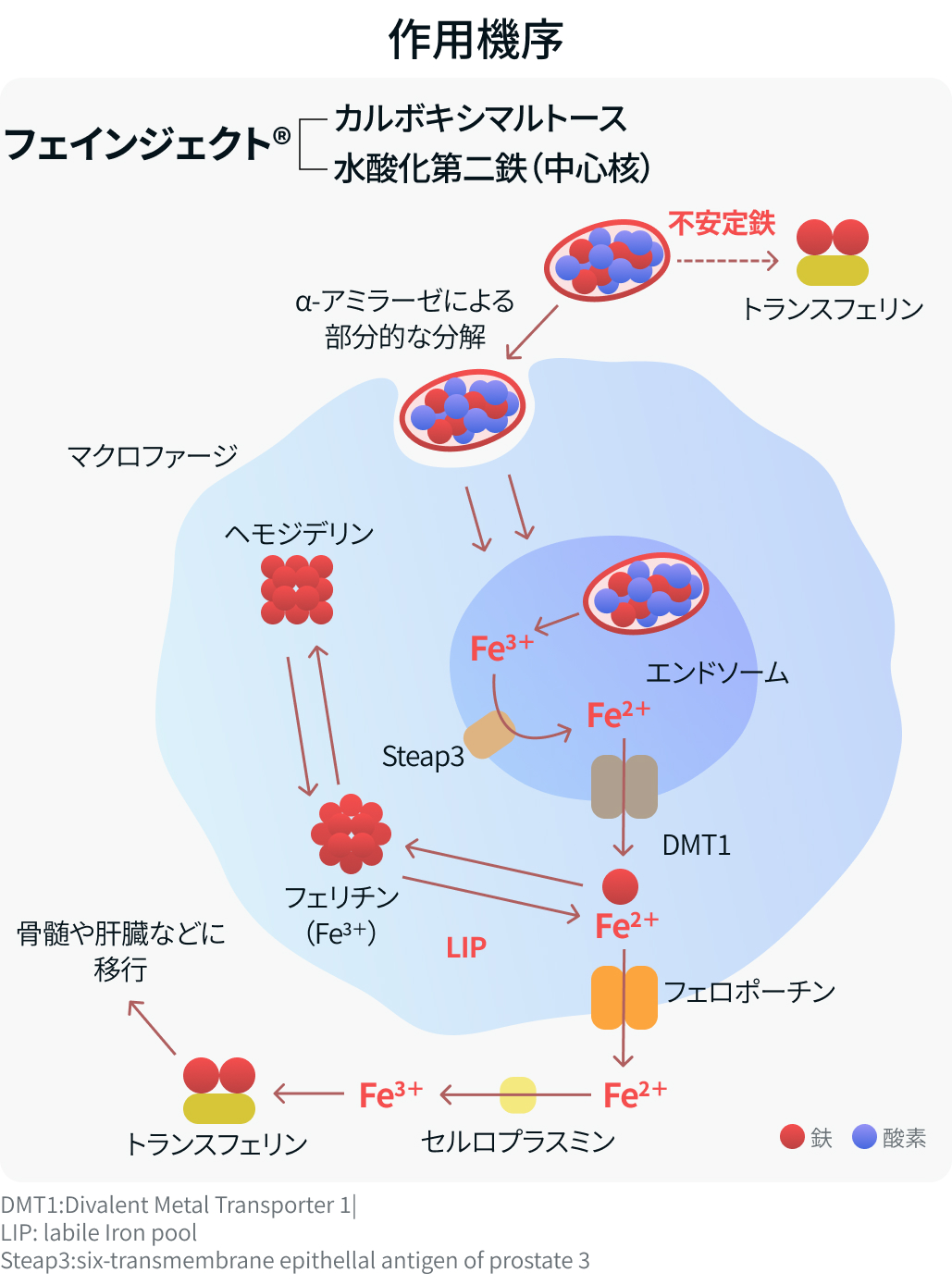
- フェインジェクト®は水和された酸化第二鉄とカルボキシマルトースからなる複合体.
- 鉄をカルボキシマルトースで包むことで遊離鉄の発生を抑え血中で安定性を示す.
- 投与後マクロファージに取りこまれエンドソームで完全に分解される.
- 鉄はフェリチンやヘモデジリンとして貯蔵され、 血中に放出された鉄はトランスフェリンと結合して骨髄に運ばれ、 赤芽球に取り込まれHb合成に利用される.
特徴と注意点
- 経口鉄剤の投与が困難又は不適当な場合に限り使用.
- 血中Hb値は本剤投与終了後4週程度まで上昇するため、 再治療の必要性は、 投与終了後4週以降を目安に血中Hb値、 血清フェリチン値、 患者の状態等から、 鉄過剰に留意して慎重に判断.
- 肝機能の悪化に注意.
- 血清フェリチン値は本剤投与後に高値を示すので本剤投与終了後4週程度は貯蔵鉄量を正確に反映しない可能性があることに注意.
- 希釈する場合は、 1バイアルあたり100mLの生理食塩液で用時希釈.
- 生理食塩液以外の 輸液は使用不可.
- 鉄として2mg/mL未満に希釈しない.
- 血管外に漏出しないよう十分注意.
- 血管外に漏出した場合には、 漏出部位周辺に皮膚の炎症 及び長期にわたる色素沈着を起こすことがあるため血管外漏出が認められた場合は、 適切な処置を行う.
- 発作性夜間ヘモグロビン尿症を合併している患者は溶血を誘発するおそれあり.
用法・用量
- 希釈しないで使用する場合:5分以上かけて緩徐に静注.
- 希釈して使用する場合:6分以上かけて点滴静注.
- 35kg未満の患者には点滴静注のみ.
- 血中Hb値は投与終了後4週程度まで上昇するため、 再治療の必要性は、 投与終了後4週以降を目安に 血中Hb値、 血清フェリチン値、 患者の状態等から、 鉄過剰に留意して慎重に判断.
関連する臨床試験の結果
国内第Ⅲ相試験 (検証的試験)¹⁾(試験番号:Z213-02)
概要
- 目的:過多月経を伴う鉄欠乏性貧血患者を対象に、 投与開始後12週時までのヘモグロビン最大変化量を主要評価項目として、 含糖酸化鉄に対する非劣性を検証.
- 対象:18歳以上50歳未満で体重35kg以上の過多月経を伴う日本人鉄欠乏性貧血患者238例.
- 投与方法:FCM群は1回投与鉄量として500mg、 含糖酸化鉄群は80mg又は120mgを治験薬投与前に選択した総投与鉄量 (1000mg又は1500mg) に達するまで投与.
- 主要評価項目:ベースラインから12週時までのヘモグロビン最大変化量.
- 副次評価項目:ヘモグロビン値の推移、 有効割合、正常割合、 鉄欠乏性貧血関連の臨床検査項目の推移など.
結果
- 12週時までのヘモグロビン最大変化量の調整済み平均値 (95%CI).
FCM群3.90g/dL (3.77、 4.04) vs 含糖酸化鉄群4.05g/dL (3.92、 4.19).
- ヘモグロビン値の推移.
ベースライン:FCM群9.198g/dL vs 含糖参加鉄群9.253g/dL.
12週時:FCM群12.76g/dL vs 含糖参加鉄群12.99g/dL.
- ヘモグロビン最大値に基づく正常割合 (95%CI):FCM群91.6% (85.1、 95.8) vs 含糖酸化鉄群95.0% (89.4、 98.1).
- ヘモグロビン最大変化量に基づく有効割合 (95%CI):両群とも97.5%.
FCM群97.5% (92.9、 99.4) vs 含糖酸化鉄群97.5% (92.9、 99.4).
- 血清フェリチン値の推移.
最大値:FCM群359.30ng/mL (2週時) vs 含糖酸化鉄群219.47ng/dL (6週時).
12週時:FCM群80.30ng/mL vs 含糖酸化鉄群94.17ng/dL.
国内第Ⅲ相試験 (一般臨床試験)²⁾ (試験番号:Z213-03)
概要
- 目的:消化器障害に伴う鉄欠乏性貧血患者を対象に、 FCM投与開始後12週時までの安全性及び有効性を確認.
- 対象:16歳以上で体重35kg以上の消化器障害に伴う日本人鉄欠乏性貧血患者39例.
- 投与方法:FCMを1回投与鉄量として500mg、 1週間以上の投与間隔で、 治験薬投与前に選択した総投与鉄量 (1000mg又は1500mg) に達するまで緩徐に静注又は点滴静注.
- 安全性評価項目:有害事象、 副作用、 臨床検査値異常変動.
- 有効性評価項目:ベースラインから12週時までのヘモグロビン最大変化量、 ヘモグロビン値の推移、 有効割合、 正常割合、 鉄欠乏性貧血患者関連の臨床検査値項目の推移など.
結果
- 血中ヘモグロビン値の最大変化量の平均 (95%CI):3.31g/dL (2.89、 3.73).
- ヘモグロビン値の推移:ベースラインの平均値は10.392g/dL、 6週時に13.19g/dL、 その後は12週時まで横ばい.
- ヘモグロビン最大値に基づく正常割合 (95%CI):76.9% (60.7、 88.8).
- ヘモグロビン最大変化量に基づく有効割合 (95%CI):ヘモグロビン最大変化量に基づく有効割合は、 84.6% (69.5、 94.1).
- 血清フェリチン値の推移:2週時に最大値417.56ng/mLとなり、 その後徐々に低下.
参考文献
最終更新:2024年8月31日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
Ferric carboxymaltose
FCM:Ferric carboxymaltose(フェインジェクト®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 500mg | 1~ | 週1回 (最大3回*) |
| - | - | *Hb値及び体重による |
前投薬
| なし. |
その他
| 血中Hb値及び体重に応じて週1回500mgを静脈内投与. |
| 総投与量の上限は鉄として1500mg. |
| 再治療の必要性は投与終了後4週以降を目安に総合的に判断. |
概要
本コンテンツは特定の治療法を推奨するものではございません.個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*総合製品情報概要は「ゼリア新薬工業株式会社」の外部サイトへ遷移します.
主な有害事象
フェインジェクト®総合製品情報概要より引用
主な有害事象
• 血中リン減少 (20.1%)
その他の副作用
- 頭痛 (4.3%)
- γGTP増加、 肝機能検査値上昇 (1%以上)
- 上腹部痛、 悪心 (1%以上)
- 蕁麻疹 (1%以上)
- 発熱、 月経過多 (1%以上)
- 倦怠感 (0.1%~1%未満)
- 背部痛、 投与部位疼痛 (頻度不明)
特徴と注意点
作用機序

- フェインジェクト®は水和された酸化第二鉄とカルボキシマルトースからなる複合体.
- 鉄をカルボキシマルトースで包むことで遊離鉄の発生を抑え血中で安定性を示す.
- 投与後マクロファージに取りこまれエンドソームで完全に分解される.
- 鉄はフェリチンやヘモデジリンとして貯蔵され、 血中に放出された鉄はトランスフェリンと結合して骨髄に運ばれ、 赤芽球に取り込まれHb合成に利用される.
特徴と注意点
- 経口鉄剤の投与が困難又は不適当な場合に限り使用.
- 血中Hb値は本剤投与終了後4週程度まで上昇するため、 再治療の必要性は、 投与終了後4週以降を目安に血中Hb値、 血清フェリチン値、 患者の状態等から、 鉄過剰に留意して慎重に判断.
- 肝機能の悪化に注意.
- 血清フェリチン値は本剤投与後に高値を示すので本剤投与終了後4週程度は貯蔵鉄量を正確に反映しない可能性があることに注意.
- 希釈する場合は、 1バイアルあたり100mLの生理食塩液で用時希釈.
- 生理食塩液以外の 輸液は使用不可.
- 鉄として2mg/mL未満に希釈しない.
- 血管外に漏出しないよう十分注意.
- 血管外に漏出した場合には、 漏出部位周辺に皮膚の炎症 及び長期にわたる色素沈着を起こすことがあるため血管外漏出が認められた場合は、 適切な処置を行う.
- 発作性夜間ヘモグロビン尿症を合併している患者は溶血を誘発するおそれあり.
用法・用量

- 希釈しないで使用する場合:5分以上かけて緩徐に静注.
- 希釈して使用する場合:6分以上かけて点滴静注.
- 35kg未満の患者には点滴静注のみ.
- 血中Hb値は投与終了後4週程度まで上昇するため、 再治療の必要性は、 投与終了後4週以降を目安に 血中Hb値、 血清フェリチン値、 患者の状態等から、 鉄過剰に留意して慎重に判断.
関連する臨床試験の結果
国内第Ⅲ相試験 (検証的試験)¹⁾(試験番号:Z213-02)
概要
- 目的:過多月経を伴う鉄欠乏性貧血患者を対象に、 投与開始後12週時までのヘモグロビン最大変化量を主要評価項目として、 含糖酸化鉄に対する非劣性を検証.
- 対象:18歳以上50歳未満で体重35kg以上の過多月経を伴う日本人鉄欠乏性貧血患者238例.
- 投与方法:FCM群は1回投与鉄量として500mg、 含糖酸化鉄群は80mg又は120mgを治験薬投与前に選択した総投与鉄量 (1000mg又は1500mg) に達するまで投与.
- 主要評価項目:ベースラインから12週時までのヘモグロビン最大変化量.
- 副次評価項目:ヘモグロビン値の推移、 有効割合、正常割合、 鉄欠乏性貧血関連の臨床検査項目の推移など.
結果
- 12週時までのヘモグロビン最大変化量の調整済み平均値 (95%CI).
FCM群3.90g/dL (3.77、 4.04) vs 含糖酸化鉄群4.05g/dL (3.92、 4.19).
- ヘモグロビン値の推移.
ベースライン:FCM群9.198g/dL vs 含糖参加鉄群9.253g/dL.
12週時:FCM群12.76g/dL vs 含糖参加鉄群12.99g/dL.
- ヘモグロビン最大値に基づく正常割合 (95%CI):FCM群91.6% (85.1、 95.8) vs 含糖酸化鉄群95.0% (89.4、 98.1).
- ヘモグロビン最大変化量に基づく有効割合 (95%CI):両群とも97.5%.
FCM群97.5% (92.9、 99.4) vs 含糖酸化鉄群97.5% (92.9、 99.4).
- 血清フェリチン値の推移.
最大値:FCM群359.30ng/mL (2週時) vs 含糖酸化鉄群219.47ng/dL (6週時).
12週時:FCM群80.30ng/mL vs 含糖酸化鉄群94.17ng/dL.
国内第Ⅲ相試験 (一般臨床試験)²⁾ (試験番号:Z213-03)
概要
- 目的:消化器障害に伴う鉄欠乏性貧血患者を対象に、 FCM投与開始後12週時までの安全性及び有効性を確認.
- 対象:16歳以上で体重35kg以上の消化器障害に伴う日本人鉄欠乏性貧血患者39例.
- 投与方法:FCMを1回投与鉄量として500mg、 1週間以上の投与間隔で、 治験薬投与前に選択した総投与鉄量 (1000mg又は1500mg) に達するまで緩徐に静注又は点滴静注.
- 安全性評価項目:有害事象、 副作用、 臨床検査値異常変動.
- 有効性評価項目:ベースラインから12週時までのヘモグロビン最大変化量、 ヘモグロビン値の推移、 有効割合、 正常割合、 鉄欠乏性貧血患者関連の臨床検査値項目の推移など.
結果
- 血中ヘモグロビン値の最大変化量の平均 (95%CI):3.31g/dL (2.89、 3.73).
- ヘモグロビン値の推移:ベースラインの平均値は10.392g/dL、 6週時に13.19g/dL、 その後は12週時まで横ばい.
- ヘモグロビン最大値に基づく正常割合 (95%CI):76.9% (60.7、 88.8).
- ヘモグロビン最大変化量に基づく有効割合 (95%CI):ヘモグロビン最大変化量に基づく有効割合は、 84.6% (69.5、 94.1).
- 血清フェリチン値の推移:2週時に最大値417.56ng/mLとなり、 その後徐々に低下.
参考文献
最終更新:2024年8月31日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
