HOKUTO編集部
3年前
『大腸がん診療における遺伝子関連検査等のガイダンス 第5版』の要点は?

『大腸がん診療における遺伝子関連検査等のガイダンス 第5版』(編: 日本臨床腫瘍学会) が2023年3月に改訂された。 第20回日本臨床腫瘍学会 (2023年3月16~18日、 福岡市) で、 同ガイダンス第5版作成ワーキンググループ委員で国立がん研究センター東病院消化管内科医長の坂東英明氏が、 目的と改訂ポイントについて解説した。
1.ガイダンス発刊の経緯
新たな遺伝子関連検査が多数承認
同ガイダンスの初版は2008年に『大腸がん患者におけるKRAS遺伝子変異の測定に関するガイダンス第1版』として発刊。
2014年の改訂時は『大腸がん患者におけるRAS遺伝子(KRAS/NRAS遺伝子)変異の測定に関するガイダンス』として刊行された。
当時、 大腸がん診療においては、 抗EGFR抗体を含む治療方針決定にRAS遺伝子検査の需要性の啓発が重要だったためだ。
その後、 図1のように新たな大腸がん遺伝子検査が次々と承認されたことを背景として、 ガイダンスの名称も若干変更しながら改訂を重ね、 今回の第5版の刊行に至った。
図1.大腸がん遺伝子検査の変遷
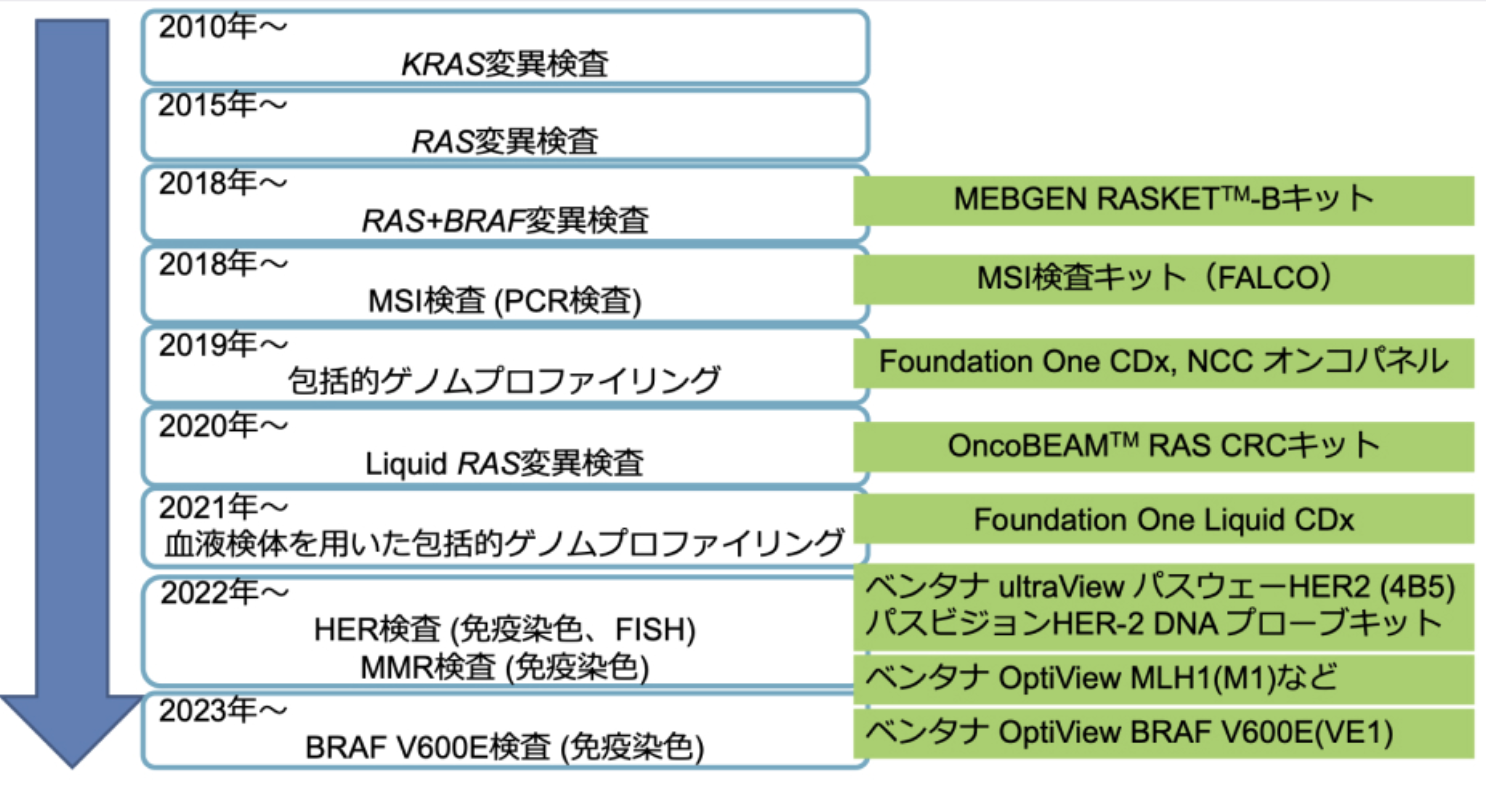
図:坂東英明氏提供
2.大腸癌治療ガイドラインとの違い
ガイダンスの目的
大腸がん領域では、 大腸癌研究会から『大腸癌治療ガイドライン』が刊行、 昨年に2022年版として改訂版が公開されている。
ガイドラインでは標準的治療と根拠が提示されているが、 同ガイダンスの目的について、 坂東氏は以下の情報を提供することだと説明した。
- 現在保険適用されている検査をどのように実施し治療に反映するのが適切か
- 新規検査技術の現状と今後の展望について
よって新規検査については、 現状で保険適用されていないものでも、 科学的に有用性が検証されている検査については推奨度を記載し、 その意義を解説している。
そのため同ガイダンスは、 新規検査の保険適用においても参照すべき学会コンセンサスとして重要な役割を果たしてきたといえる。

坂東英明氏
保険収載された新規検査
なお旧版となる第4版(2019年12月刊行)では、 以下のような未承認の新規検査の推奨度が記載されたが、 いずれもその後保険収載されている。
- 切除可能例に対するRAS/BRAF検査
2020年8月保険適用
- 補助化学療法選択におけるミスマッチ修復欠損(dMMR)検査
2020年12月保険適用
- 抗EGFR抗体薬モニタリングとしての血中循環腫瘍(ct)DNA検査
2020年8月保険適用
- がんゲノムプロファイル(CGP)検査としてのctDNA検査
2021年8月保険適用
3.改訂ポイントと推奨について
では第5版改訂のポイントは何かーー。 坂東氏は「今回の改訂ポイントはHER2検査と遺伝子パネル検査」になるとしたうえで、 主な改訂ポイントとして以下の4点を挙げた(関連記事「大腸がんで初のHER2検査、タイミングや対象は?」)。
主な改訂ポイント
- 切除不能例に対するHER2検査を推奨
- 日本病理学会の見解を参考に免疫組織化学染色(IHC)検査を専攻実施し、 2+と判定された症例にISH検査を推奨
- 治癒切除が行われた大腸がん患者に対し、 再発リスクに応じた選択を目的として、 微小残存腫瘍検出用のパネル検査実施を推奨
- 今後期待される検査として、 DNAメチル化アッセイ、 腫瘍微小環境の評価アッセイを記載
HER2検査については、 2022年3月にすでに保険適用されている (図2)。
図2.大腸がんにおける遺伝子関連検査等の臨床導入状況

図:坂東英明氏提供
同ガイダンスでの推奨
- 基本的要件「切除不能進行再発大腸がん患者に対し、 抗HER2療法の適応判定を目的として、 抗HER2療法施行前にHER2検査を推奨する」 に対し、推奨度は「強く推奨する」
- 基本的要件「治癒切除が行われた大腸がん患者に対し、 再発リスクに応じた治療選択を目的として、 微小残存腫瘍検出用のパネル検査を実施する」 に対しても、 推奨は「強く推奨する」
各要件の推奨度は、 各検査におけるエビデンス、 検査を実施した場合に想定される患者が受ける利益、 損失のバランスをもとに決定され、 各検査の国内における保険適用状況は考慮されていない。 委員がvotingを行い、 70%以上の一致が得られた場合に推奨が決定されたという。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。