新薬承認情報
6ヶ月前
【速報】ニボルマブ+GC、 切除不能尿路上皮癌の1次治療で追加承認

小野薬品工業は2024年12月27日、 抗PD-1抗体ニボルマブ (商品名オプジーボ®) について、 ゲムシタビン+シスプラチン (GC療法) との併用において、 根治切除不能な尿路上皮癌を効能または効果として追加承認を取得したと発表した。
1次治療でのニボルマブ+GCが追加承認
ニボルマブは2022年3月、 単剤療法で、 尿路上皮癌における術後補助療法を効能・効果として承認されている。 今回は尿路上皮癌に対する1次治療としての効能・効果で承認された。
CheckMate 901試験でOS、 PFS改善
今回の追加承認は、 未治療の切除不能または転移性尿路上皮癌を対象に、 GC療法+ニボルマブとそれに続くニボルマブ単剤療法の有効性および安全性について、 GC療法単独を対照に比較検討した第Ⅲ相国際共同無作為化比較試験CheckMate 901の結果に基づく。
同試験において、 ニボルマブ併用群では化学療法単独に比べ、 全生存期間 (OS) および無増悪生存期間 (PFS) の有意な改善が示された (OS中央値 : 21.7ヵ月 vs 18.9ヵ月、 HR 0.78、 p=0.0171 / PFS中央値 : 7.9ヵ月 vs 7.6ヵ月、 HR 0.72、 p=0.0012) 。
薬剤情報*
- オプジーボ® (添付文書*)
ヒト型抗ヒトPD-1モノクローナル抗体 ニボルマブ
*小野薬品工業の外部サイトへ遷移します
用法・用量
1~6サイクル目

7サイクル目以降 (最長2年間)
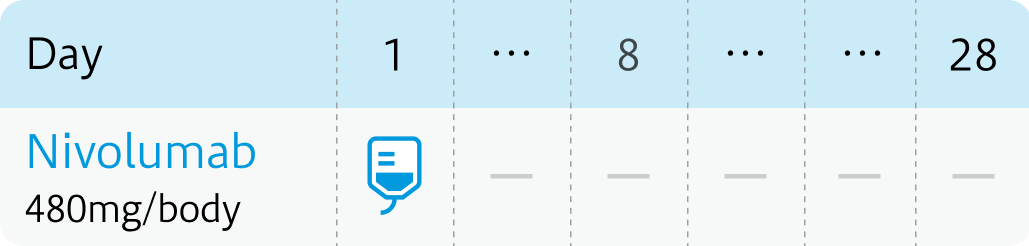
ニボルマブ360mgとシスプラチン70mg/m²をDay1に、 ゲムシタビン1000mg/m²をDay1,8に投与、 3週サイクルで最大6サイクル実施。その後、 ニボルマブ480mgを4週毎の単独維持療法に移行し、 最長2年間投与する。
関連レジメン
ゲムシタビン+シスプラチン+ニボルマブ
2023年12月18日に尿路上皮癌の1次治療 (化学療法を併用) の効能追加を申請。 2024年12月6日の二部会で報告、 2024年12月27日に正式承認となった。
【速報】ニボルマブ+GC、 切除不能尿路上皮癌の1次治療で追加承認の全コンテンツは、医師会員限定でアプリからご利用いただけます*。
*一部のコンテンツは非医師会員もご利用いただけます
臨床支援アプリHOKUTOをダウンロードしてご覧ください。
今すぐ無料ダウンロード!
こちらの記事の監修医師
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
QRコードから
アプリを
ダウンロード!