本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
レチノイド製剤 ベキサロテン
*ミノファーゲン製薬の外部サイトへ遷移します
用法用量
電子添文¹⁾/第Ⅱ、 Ⅲ相試験³⁾の用法および用量
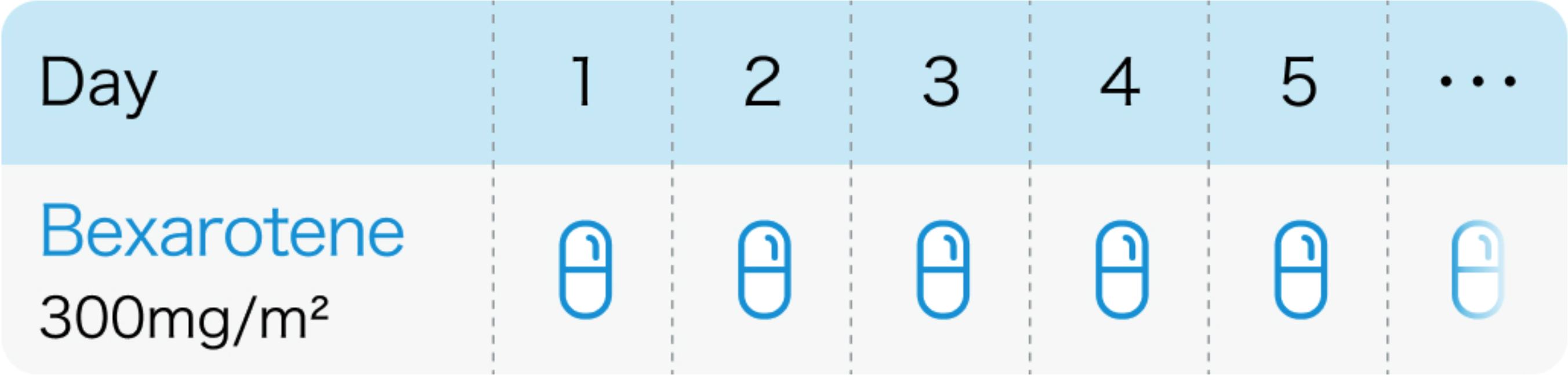
タルグレチン®電子添文 (2024年 6月改訂 第2版)、 Arch Dermatol. 2001 May;137(5):581-93.をもとに作図
1日1回300mg/m² (体表面積) を食後経口投与
タルグレチン®電子添文 (2024年6月改訂 第2版)より引用
体表面積換算での推奨カプセル数についてはタルグレチン®の電子添文参照
投与開始基準
国内第I/II相試験⁴⁾のプロトコル
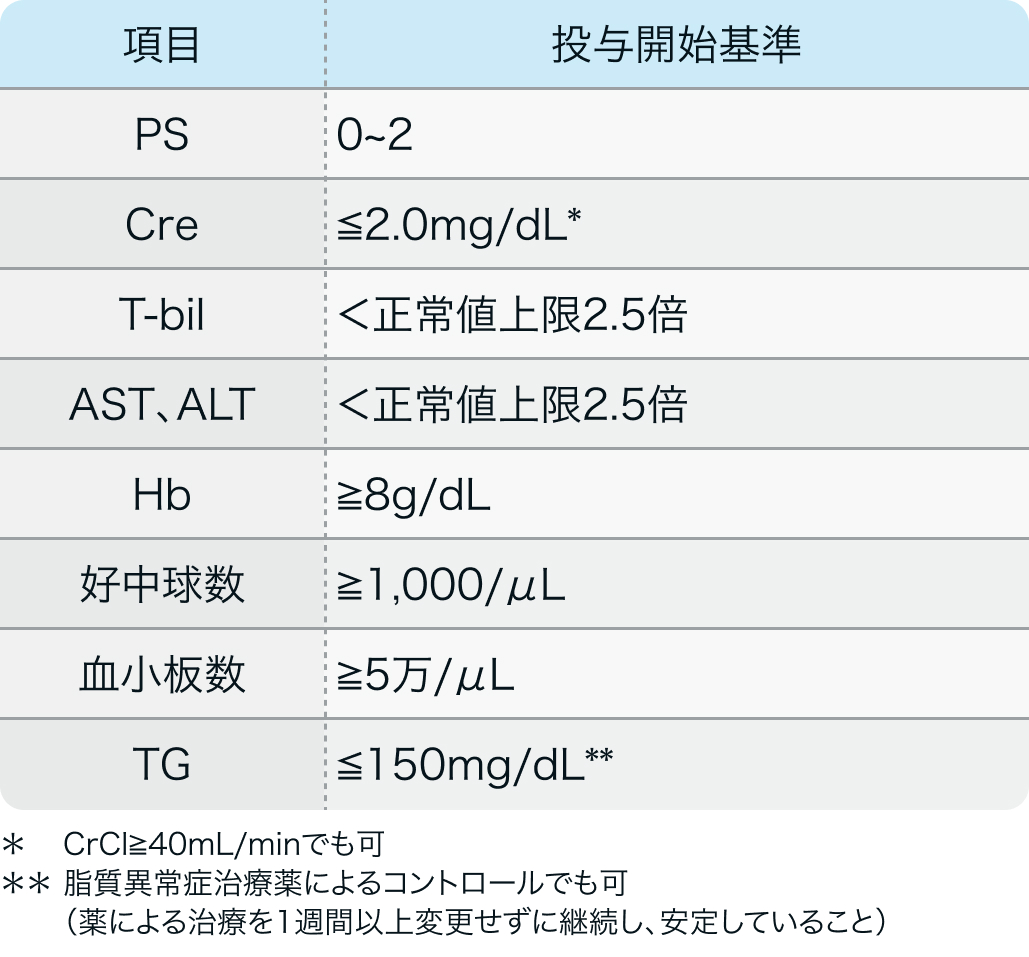
J Dermatol. 2017 Feb;44(2):135-142⁴⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

タルグレチン®電子添文 (2024年6月改訂 第2版)¹⁾より作図
初回基準量と減量レベル
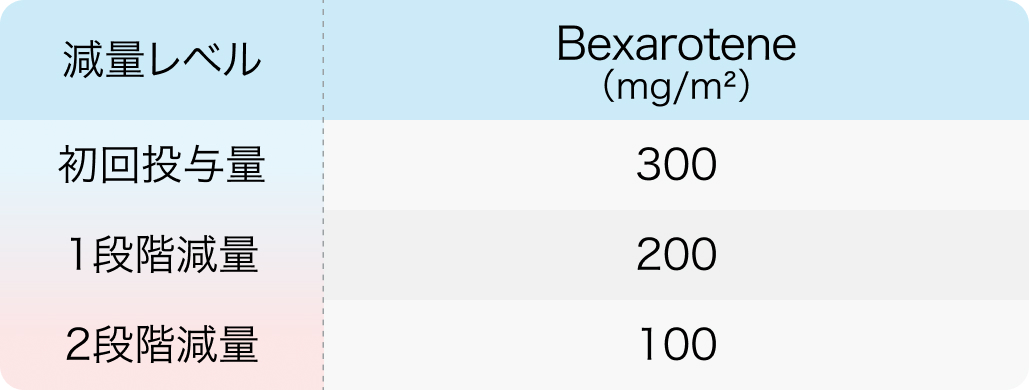
タルグレチン®電子添文 (2024年6月改訂 第2版)¹⁾より作図
主な有害事象
国内第I/II相試験⁴⁾
主な有害事象
- 鼻咽頭炎 (30.8%)
- 爪囲炎 (7.7%)
- 貧血 (30.8%)
- 白血球減少症 (38.5%)
- 好中球減少症 (38.5%)
- 甲状腺機能低下症 (92.3%)
- 高コレステロール血症 (76.9%)
- 高トリグリセリド血症 (76.9%)
- 低アルブミン血症 (15.4%)
- 食欲減退 (15.4%)
- 頭痛 (15.4%)
- 便秘 (15.4%)
- 歯肉炎 (7.7%)
- 悪心 (23.1%)
- 嘔吐 (23.1%)
- 肝機能異常 (15.4%)
- 倦怠感 (23.1%)
- 活性化部分トロンボプラスチン時間 (7.7%)
- ALT上昇 (15.4%)
- AST上昇 (15.4%)
- 血中クレアチンホスホキナーゼ増加 (23.1%)
- 好中球数減少 (23.1%)
- 体重減少 (15.4%)
- 白血球数減少 (38.5%)
- 血小板数増加 (7.7%)
J Dermatol. 2017 Feb;44(2):135-142⁴⁾より引用
エキスパートによるワンポイント
全身療法としての第一選択薬
Skin-directed therapy抵抗性の早期菌状息肉症から進行期菌状息肉症まで、 全身療法として第一選択となる薬剤である。 世界的にも皮膚T細胞リンパ腫の全身療法の第一選択として扱われている。
同ラインで使う薬剤としては、 他にレチノイドとしてetretinateがあるほか、 interferon-γもあるが、 前者は保険適応外であり、 後者は点滴による投与であるため受診頻度が増えるという問題点がある。 その他の皮膚T細胞リンパ腫においても承認されているが、 希少疾患ということもあって、 その効果に関する評価は固まっているとは言い難い。
投与スケジュールと副作用管理
通常1日1回300mg/m²を食後に経口投与する。 高TG血症を除くGrade3以上の副作用が発現した場合は、 副作用が消失、 またはGrade1以下に改善するまで休薬し、 200mg/m²で投与再開する。 発現時の投与量が200mg/日の場合は副作用が消失、 またはGrade1以下に改善するまで休薬し、 100mg/m²で投与再開する。 発現時の投与量が100mg/日の場合は副作用が消失、 またはGrade1以下に改善するまで休薬し、 100mg/m²で投与再開する。 いずれの場合も、 4週間休薬しても副作用が改善しない場合は投与を中止する。
国内第I/II相試験⁴⁾の結果
未治療を含む病期IIB以上、 および標準的初回治療抵抗性の皮膚T細胞リンパ腫患者を対象とした国内第I/II相試験³⁾ (B-1101試験、 登録13例) において、 投与開始から24週時点または中止時におけるmodified Severity Weighted Assessment Tool (mSWAT) に基づいた奏効率は61.5% (13例中8例) であった。 副作用は100%の被検者に認められている。 主な副作用は、 甲状腺機能低下症12例 (92.3%)、 高コレステロール血症及び高トリグリセリド血症各10例 (76.9%)、 好中球減少症及び白血球数減少各5例 (38.5%)、 白血球減少症4例 (30.8%)、 貧血及び好中球数減少各3例 (23.1%)、 頭痛、 悪心、 嘔吐及び倦怠感各2例 (15.4%) であった。
本剤独特の副作用として甲状腺機能低下症と高トリグリセリド血症がある。 甲状腺機能低下症に関しては、 B-1101試験では、 甲状腺機能検査異常が全ての被験者で認められたが、 Grade3以上の事象は認めていない。 定期的に遊離T4を測定しながら、 チラージンを補充することでタルグレチンの減量なくコントロールできることが多い。 高トリグリセリド血症に関してはB-1101試験でも75%の被験者で認め、 Grade3の事象も31.3%認めている。 本剤投与前に生活習慣の改善を含む高脂血症のコントロールが望まれるほか、 適正使用ガイドに基づいた高トリグリセリド血症に対する対応が必要である。
出典
- ミノファーゲン製薬. タルグレチン®電子添文 (2024年6月改訂 第2版) [最終閲覧 : 2024/08/15]
- ミノファーゲン製薬. タルグレチン®適正使用ガイド (2024年6月改訂) [最終閲覧 : 2024/8/15]
- Phase 2 and 3 clinical trial of oral bexarotene (Targretin capsules) for the treatment of refractory or persistent early-stage cutaneous T-cell lymphoma. Arch Dermatol. 2001 May;137(5):581-93. PMID: 11346336
- Phase I/II study of the oral retinoid X receptor agonist bexarotene in Japanese patients with cutaneous T-cell lymphomas. J Dermatol. 2017 Feb;44(2):135-142. PMID: 27543197
最終更新日 : 2024年8月15日
監修医師 : 近畿大学皮膚科 藤井 一恭先生
Bexarotene
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
レチノイド製剤 ベキサロテン
*ミノファーゲン製薬の外部サイトへ遷移します
用法用量
電子添文¹⁾/第Ⅱ、 Ⅲ相試験³⁾の用法および用量

タルグレチン®電子添文 (2024年 6月改訂 第2版)、 Arch Dermatol. 2001 May;137(5):581-93.をもとに作図
1日1回300mg/m² (体表面積) を食後経口投与
タルグレチン®電子添文 (2024年6月改訂 第2版)より引用
体表面積換算での推奨カプセル数についてはタルグレチン®の電子添文参照
投与開始基準
国内第I/II相試験⁴⁾のプロトコル

J Dermatol. 2017 Feb;44(2):135-142⁴⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

タルグレチン®電子添文 (2024年6月改訂 第2版)¹⁾より作図
初回基準量と減量レベル

タルグレチン®電子添文 (2024年6月改訂 第2版)¹⁾より作図
主な有害事象
国内第I/II相試験⁴⁾
主な有害事象
- 鼻咽頭炎 (30.8%)
- 爪囲炎 (7.7%)
- 貧血 (30.8%)
- 白血球減少症 (38.5%)
- 好中球減少症 (38.5%)
- 甲状腺機能低下症 (92.3%)
- 高コレステロール血症 (76.9%)
- 高トリグリセリド血症 (76.9%)
- 低アルブミン血症 (15.4%)
- 食欲減退 (15.4%)
- 頭痛 (15.4%)
- 便秘 (15.4%)
- 歯肉炎 (7.7%)
- 悪心 (23.1%)
- 嘔吐 (23.1%)
- 肝機能異常 (15.4%)
- 倦怠感 (23.1%)
- 活性化部分トロンボプラスチン時間 (7.7%)
- ALT上昇 (15.4%)
- AST上昇 (15.4%)
- 血中クレアチンホスホキナーゼ増加 (23.1%)
- 好中球数減少 (23.1%)
- 体重減少 (15.4%)
- 白血球数減少 (38.5%)
- 血小板数増加 (7.7%)
J Dermatol. 2017 Feb;44(2):135-142⁴⁾より引用
エキスパートによるワンポイント
全身療法としての第一選択薬
Skin-directed therapy抵抗性の早期菌状息肉症から進行期菌状息肉症まで、 全身療法として第一選択となる薬剤である。 世界的にも皮膚T細胞リンパ腫の全身療法の第一選択として扱われている。
同ラインで使う薬剤としては、 他にレチノイドとしてetretinateがあるほか、 interferon-γもあるが、 前者は保険適応外であり、 後者は点滴による投与であるため受診頻度が増えるという問題点がある。 その他の皮膚T細胞リンパ腫においても承認されているが、 希少疾患ということもあって、 その効果に関する評価は固まっているとは言い難い。
投与スケジュールと副作用管理
通常1日1回300mg/m²を食後に経口投与する。 高TG血症を除くGrade3以上の副作用が発現した場合は、 副作用が消失、 またはGrade1以下に改善するまで休薬し、 200mg/m²で投与再開する。 発現時の投与量が200mg/日の場合は副作用が消失、 またはGrade1以下に改善するまで休薬し、 100mg/m²で投与再開する。 発現時の投与量が100mg/日の場合は副作用が消失、 またはGrade1以下に改善するまで休薬し、 100mg/m²で投与再開する。 いずれの場合も、 4週間休薬しても副作用が改善しない場合は投与を中止する。
国内第I/II相試験⁴⁾の結果
未治療を含む病期IIB以上、 および標準的初回治療抵抗性の皮膚T細胞リンパ腫患者を対象とした国内第I/II相試験³⁾ (B-1101試験、 登録13例) において、 投与開始から24週時点または中止時におけるmodified Severity Weighted Assessment Tool (mSWAT) に基づいた奏効率は61.5% (13例中8例) であった。 副作用は100%の被検者に認められている。 主な副作用は、 甲状腺機能低下症12例 (92.3%)、 高コレステロール血症及び高トリグリセリド血症各10例 (76.9%)、 好中球減少症及び白血球数減少各5例 (38.5%)、 白血球減少症4例 (30.8%)、 貧血及び好中球数減少各3例 (23.1%)、 頭痛、 悪心、 嘔吐及び倦怠感各2例 (15.4%) であった。
本剤独特の副作用として甲状腺機能低下症と高トリグリセリド血症がある。 甲状腺機能低下症に関しては、 B-1101試験では、 甲状腺機能検査異常が全ての被験者で認められたが、 Grade3以上の事象は認めていない。 定期的に遊離T4を測定しながら、 チラージンを補充することでタルグレチンの減量なくコントロールできることが多い。 高トリグリセリド血症に関してはB-1101試験でも75%の被験者で認め、 Grade3の事象も31.3%認めている。 本剤投与前に生活習慣の改善を含む高脂血症のコントロールが望まれるほか、 適正使用ガイドに基づいた高トリグリセリド血症に対する対応が必要である。
出典
- ミノファーゲン製薬. タルグレチン®電子添文 (2024年6月改訂 第2版) [最終閲覧 : 2024/08/15]
- ミノファーゲン製薬. タルグレチン®適正使用ガイド (2024年6月改訂) [最終閲覧 : 2024/8/15]
- Phase 2 and 3 clinical trial of oral bexarotene (Targretin capsules) for the treatment of refractory or persistent early-stage cutaneous T-cell lymphoma. Arch Dermatol. 2001 May;137(5):581-93. PMID: 11346336
- Phase I/II study of the oral retinoid X receptor agonist bexarotene in Japanese patients with cutaneous T-cell lymphomas. J Dermatol. 2017 Feb;44(2):135-142. PMID: 27543197
最終更新日 : 2024年8月15日
監修医師 : 近畿大学皮膚科 藤井 一恭先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。