本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アストラゼネカ株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
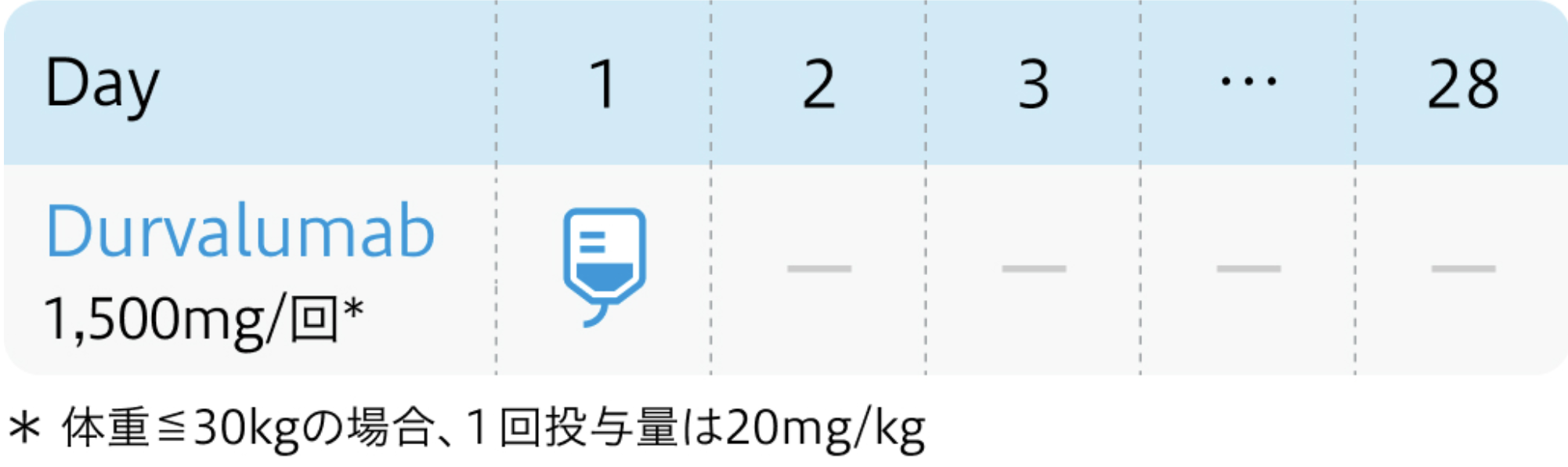
イミフィンジ®電子添文 (2023年11月改訂 第6版)¹⁾より作図
投与開始基準
HIMALAYA試験³⁾のプロトコル
18歳以上の腫瘍組織の病理組織学的所見でHCCが確認された患者
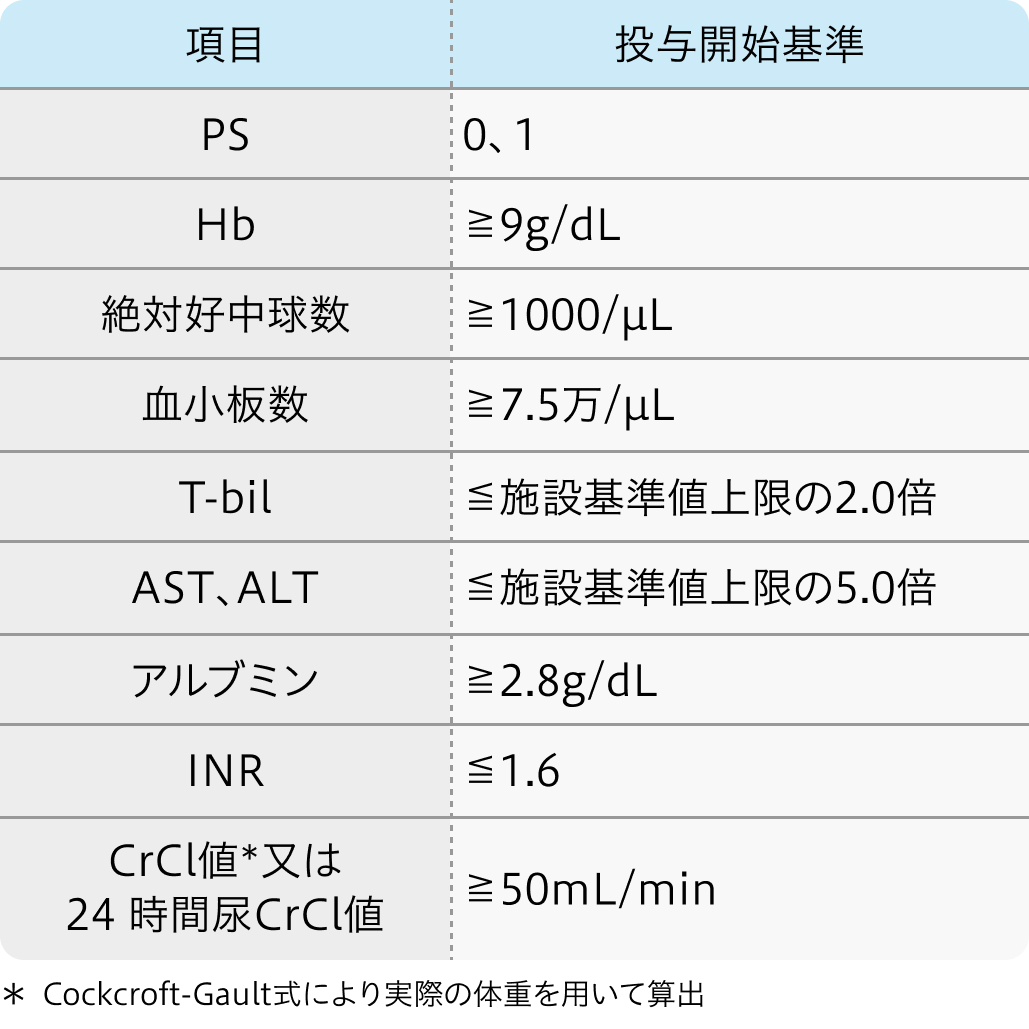
イミフィンジ®適正使用ガイド (2023年11月作成)²⁾より作図
休薬・中止基準
電子添文¹⁾の基準

イミフィンジ®電子添文 (2023年11月改訂 第6版)¹⁾より作図
主な有害事象
HIMALAYA試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- ALT増加 11.3% (3.1%)
- AST増加 14.4% (6.7%)
- 甲状腺機能亢進症 2.3% (0%)
- 甲状腺機能低下症 4.9% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 血尿 1.0% (0.3%)
Future Oncol. 2023 Dec;19(38):2505-2516³⁾より引用
上手に使うためのワンポイント
HIMALAYA試験³⁾によれば本レジメンは全体としての有害事象の頻度はやや少ないものの、 免疫介在性有害事象 (imAE) は起こっており、 頻度が高いのが肝障害、 甲状腺機能低下症、 甲状腺機能亢進症、 下痢大腸炎、 間質性肺炎、 副腎機能障害などとされている。 出現時期はまちまちであるが複合免疫療法に比べて遅い傾向にあり開始から半年以上経って出現する症例も多く注意が必要である。 さらにImAE出現の際には専門医にコンサルトしつつ速やかな対処が必要であり、 Grade2以上のImAEの際には躊躇わずにPSL1~2mg/kg/日の投与を開始することが重要である。
執筆 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
特徴と注意点
本レジメンはHIMALAYA試験³⁾においてソラフェニブに対して非劣勢が示され承認された。 進行肝細胞癌に対する現時点で唯一の単独免疫チェックポイント阻害薬レジメンである。 肝がん診療ガイドラインでは複合免疫療法の適応がない症例に対する1次治療として記されている。
デュルバルマブ1500mg (体重30kg以下は20mg/kg) 4週ごと投与というシンプルな治療でHIMALAYA試験¹⁾でのOSの中央値が16.5ヵ月 (ソラフェニブ13.7ヵ月;ハザード比:0.86) であった。 PFSはソラフェニブと同等であったがQOL悪化までの期間は7.4ヵ月vs 5.7ヵ月、 ハザード比0.77と有意に良好であった。 治療関連有害事象は全Grade/Grade3以上52.1%/8.2% (ソラフェニブ84.8%/9.4%) と比較的低かった。 ただしグレード3以上の免疫介在性有害事象が6.2%に起こっており注意が必要である。
執筆 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
関連する臨床試験|HIMALAYA試験³⁾
国際オープンラベル第Ⅲ相無作為化比較試験HIMALAYAでは、 切除不能肝細胞癌の1次治療において、 STRIDEレジメン (抗CTLA-4抗体トレメリムマブの1回投与+抗PD-L1抗体デュルバルマブの複数回投与) またはデュルバルマブ単独の複数回投与の有効性および安全性が、 標準治療であるソラフェニブを対照に検証された。 その結果、 STRIDEレジメンによる全生存期間 (OS) の有意な延長が認められた。 一方で、 デュルバルマブ単独療法はソラフェニブと比べてOSの有意な延長は認めなかった。
OS中央値
- STRIDE群 : 16.43ヵ月
(95%CI 14.16-19.58ヵ月)
HR 0.78 (96.02%CI 0.65-0.93)
- デュルバルマブ単独群 : 16.56ヵ月
(95%CI 14.06-19.12ヵ月)
HR 0.86 (95.67%CI 0.73-1.03)
- ソラフェニブ群 : 13.77ヵ月
(95%CI 12.25-16.13ヵ月)
PFS中央値
3群間で結果はほぼ同様
- STRIDE群 : 3.78ヵ月
(95%CI 3.68-5.32ヵ月)
HR 0.90 (95%CI 0.77-1.05)
- デュルバルマブ単独群 : 3.65ヵ月
(95%CI 3.19-3.75ヵ月)
HR 1.02 (95%CI 0.88-1.19)
- ソラフェニブ群 : 4.07ヵ月
(95%CI 3.75-5.49ヵ月)
出典
- アストラゼネカ株式会社. イミフィンジ®電子添文 (2026年1月改訂 第10版)
- アストラゼネカ株式会社. イミフィンジ®適正使用ガイド (2026年1月作成)
- Plain language summary of the HIMALAYA study: tremelimumab and durvalumab for unresectable hepatocellular carcinoma (liver cancer). Future Oncol. 2023 Dec;19(38):2505-2516. PMID: 37671641
最終更新日 : 2025年1月7日
執筆医 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Durvalumab
Durvalumab:Durvalumab(イミフィンジ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1500mg/回 点滴 | 1~ | Day1 |
その他
| 1コース28日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アストラゼネカ株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量

イミフィンジ®電子添文 (2023年11月改訂 第6版)¹⁾より作図
投与開始基準
HIMALAYA試験³⁾のプロトコル
18歳以上の腫瘍組織の病理組織学的所見でHCCが確認された患者

イミフィンジ®適正使用ガイド (2023年11月作成)²⁾より作図
休薬・中止基準
電子添文¹⁾の基準

イミフィンジ®電子添文 (2023年11月改訂 第6版)¹⁾より作図
主な有害事象
HIMALAYA試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- ALT増加 11.3% (3.1%)
- AST増加 14.4% (6.7%)
- 甲状腺機能亢進症 2.3% (0%)
- 甲状腺機能低下症 4.9% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 血尿 1.0% (0.3%)
Future Oncol. 2023 Dec;19(38):2505-2516³⁾より引用
上手に使うためのワンポイント
HIMALAYA試験³⁾によれば本レジメンは全体としての有害事象の頻度はやや少ないものの、 免疫介在性有害事象 (imAE) は起こっており、 頻度が高いのが肝障害、 甲状腺機能低下症、 甲状腺機能亢進症、 下痢大腸炎、 間質性肺炎、 副腎機能障害などとされている。 出現時期はまちまちであるが複合免疫療法に比べて遅い傾向にあり開始から半年以上経って出現する症例も多く注意が必要である。 さらにImAE出現の際には専門医にコンサルトしつつ速やかな対処が必要であり、 Grade2以上のImAEの際には躊躇わずにPSL1~2mg/kg/日の投与を開始することが重要である。
執筆 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
特徴と注意点
本レジメンはHIMALAYA試験³⁾においてソラフェニブに対して非劣勢が示され承認された。 進行肝細胞癌に対する現時点で唯一の単独免疫チェックポイント阻害薬レジメンである。 肝がん診療ガイドラインでは複合免疫療法の適応がない症例に対する1次治療として記されている。
デュルバルマブ1500mg (体重30kg以下は20mg/kg) 4週ごと投与というシンプルな治療でHIMALAYA試験¹⁾でのOSの中央値が16.5ヵ月 (ソラフェニブ13.7ヵ月;ハザード比:0.86) であった。 PFSはソラフェニブと同等であったがQOL悪化までの期間は7.4ヵ月vs 5.7ヵ月、 ハザード比0.77と有意に良好であった。 治療関連有害事象は全Grade/Grade3以上52.1%/8.2% (ソラフェニブ84.8%/9.4%) と比較的低かった。 ただしグレード3以上の免疫介在性有害事象が6.2%に起こっており注意が必要である。
執筆 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
関連する臨床試験|HIMALAYA試験³⁾
国際オープンラベル第Ⅲ相無作為化比較試験HIMALAYAでは、 切除不能肝細胞癌の1次治療において、 STRIDEレジメン (抗CTLA-4抗体トレメリムマブの1回投与+抗PD-L1抗体デュルバルマブの複数回投与) またはデュルバルマブ単独の複数回投与の有効性および安全性が、 標準治療であるソラフェニブを対照に検証された。 その結果、 STRIDEレジメンによる全生存期間 (OS) の有意な延長が認められた。 一方で、 デュルバルマブ単独療法はソラフェニブと比べてOSの有意な延長は認めなかった。
OS中央値
- STRIDE群 : 16.43ヵ月
(95%CI 14.16-19.58ヵ月)
HR 0.78 (96.02%CI 0.65-0.93)
- デュルバルマブ単独群 : 16.56ヵ月
(95%CI 14.06-19.12ヵ月)
HR 0.86 (95.67%CI 0.73-1.03)
- ソラフェニブ群 : 13.77ヵ月
(95%CI 12.25-16.13ヵ月)
PFS中央値
3群間で結果はほぼ同様
- STRIDE群 : 3.78ヵ月
(95%CI 3.68-5.32ヵ月)
HR 0.90 (95%CI 0.77-1.05)
- デュルバルマブ単独群 : 3.65ヵ月
(95%CI 3.19-3.75ヵ月)
HR 1.02 (95%CI 0.88-1.19)
- ソラフェニブ群 : 4.07ヵ月
(95%CI 3.75-5.49ヵ月)
出典
- アストラゼネカ株式会社. イミフィンジ®電子添文 (2026年1月改訂 第10版)
- アストラゼネカ株式会社. イミフィンジ®適正使用ガイド (2026年1月作成)
- Plain language summary of the HIMALAYA study: tremelimumab and durvalumab for unresectable hepatocellular carcinoma (liver cancer). Future Oncol. 2023 Dec;19(38):2505-2516. PMID: 37671641
最終更新日 : 2025年1月7日
執筆医 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
