本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
2週間間隔
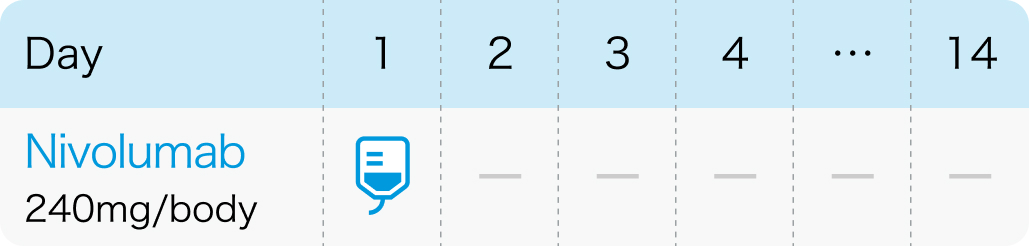
4週間間隔

1回240mgを2週間間隔または1回480mgを4週間間隔で点滴静注¹⁾
オプジーボ®電子添文 (2024年7月改訂第21版)¹⁾より作図、 引用
KCTR-D014²⁾は4週間間隔のレジメンで実施
各プロトコル
投与開始基準
NMSC-PD1試験³⁾のプロトコル例
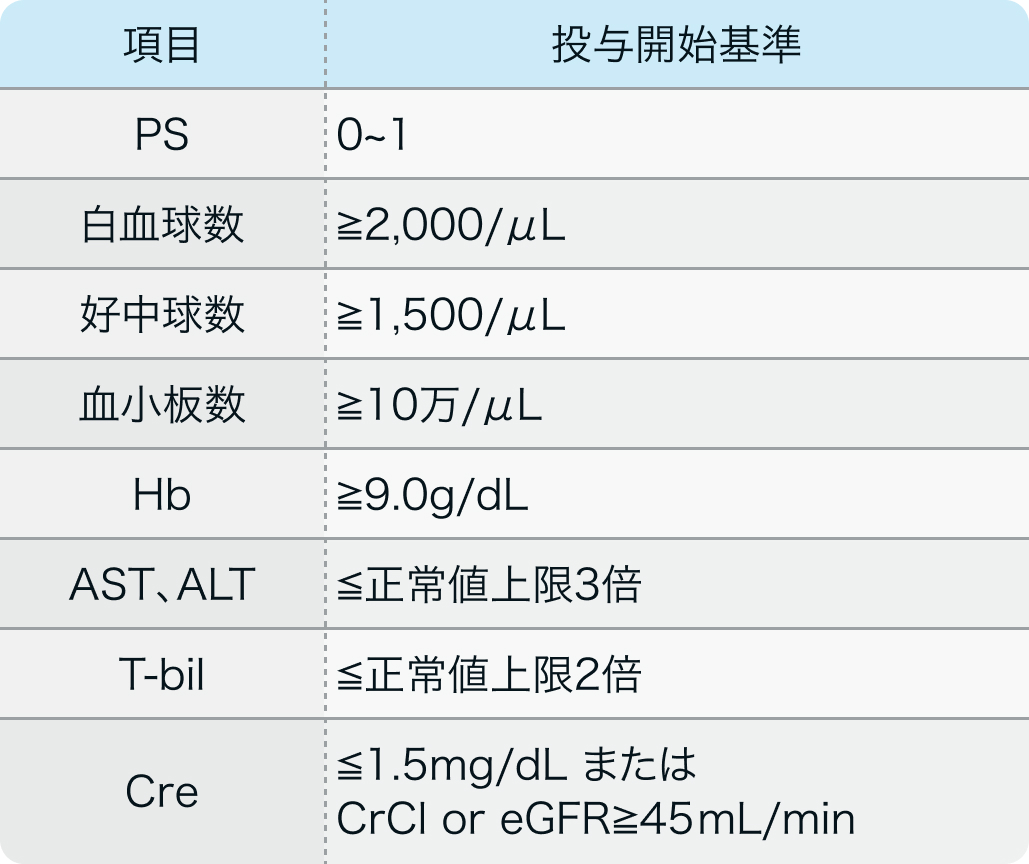
Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より作図
中止基準
NMSC-PD1試験³⁾のプロトコル例
以下の少なくとも1つが発生した患者でニボルマブの投与を中止
- ≧Grade3の間質性肺炎
- ≧Grade2の目の痛み、 かすみ目で、
治療してもGrade1に改善のない場合
- ≧Grade3の気管支痙攣、 下痢、 大腸炎、
神経毒性、 過敏反応、 注入反応、 ぶどう膜炎
- ≧Grade3の血小板減少症 (5日以上継続)
- 前回の治療サイクル開始から10週以上経過
- 研究者または医師が薬剤投与中止を判断
Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より引用
主な有害事象
KCTR-D014試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- TSH減少 12.9% (0%)
- 甲状腺機能亢進症 12.9% (3.2%)
- 甲状腺機能低下症 9.7% (0%)
- 発熱 9.7% (3.2%)
- 倦怠感 6.5% (0%)
- 貧血 6.5% (0%)
- 副腎機能不全 6.5% (0%)
- 間質性肺疾患 6.5% (3.2%)
- そう痒症 6.5% (0%)
厚生労働省 : 最適使用推進ガイドラインニボルマブ (遺伝子組換え) ~上皮系皮膚悪性腫瘍~.令和6年2月⁴⁾より引用
エキスパートによるワンポイント
根治切除不能な皮膚付属器癌の選択肢
皮膚付属器癌は希少がんであり、 転移する症例はさらに稀であるため、 薬物療法に関する知見が集積されていない。 そのため、 日本や米国においてガイドラインにて明確に推奨されるレジメンが存在しない。
2024年2月に 「根治切除不能な進行・再発の上皮系皮膚悪性腫瘍」 にNivolumabが適応となった⁵⁾。 それ以外に保険適応となっているレジメンはない。 同ライン薬剤はない。
ニボルマブの使用方法と副作用管理
通常、 成人にはNivolumabとして、 1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。 副作用が見られた場合は適宜医師の判断にて中止する。
ただし、 甲状腺機能低下症などに対しては、 同量で投与継続しながら甲状腺ホルモンを内服で補充することも可能である。 また、 軽度の検査値異常では、 同量で投与を継続することが多い。
NMSC-PD1試験³⁾では奏効率19.4%
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍患者31例を対象に、 Nivolumab 480mgを4週間間隔で点滴静注した。 奏効率は全体では19.4%であった。
一方、 31例のうち皮膚付属器癌は5例であり、 皮膚付属器癌に対する奏効率は0%であった。 皮膚付属器癌に対するNivolumabの効果は確立していないことに注意が必要である。
副作用は免疫関連有害事象として、 入院治療を要するものや、 不可逆的な障害を引き起こすものがあり、 血液検査などでのモニタリングが必要である。
その他の治療選択肢
国立がん研究センター中央病院にて、 2005年から2022年の間にアポクリン汗腺癌と診断された32例の患者を対象に実施された単一施設後ろ向きコホート研究におけるレジメンを参考に掲載する (年齢中央値 65.5歳)⁶⁾。
初回治療時に肺転移を有していた患者1例に対して、 FGFR阻害剤が使用され、 PFSは5ヵ月であった。
再発後に全身化学療法を受けた8例の患者のうち、 7人が化学療法を受け、 5人はFECOM (5-FU、 エピルビシン、 カルボプラチン、 ビンクリスチン、 マイトマイシンCの併用療法) を第一選択とした。 ORRは20%であり、 CRが20%、 PR 0%であった。 またPFS中央値は9ヵ月(範囲1~21ヵ月) であった。
その他の患者は、 パクリタキセルとカルボプラチンの併用療法、 またはペプロマイシン硫酸塩とマイトマイシンCの併用療法を受けた。 この2例の最良反応はSDであり、 それぞれPFSは6ヵ月であった。
全患者で第二選択の化学療法としてドセタキセルが投与されたが、 ORRは0%に留まり、 PFS中央値は9ヵ月 (範囲3~15か月) であった。
監修 : 国立がん研究センター中央病院皮膚腫瘍科 山崎直也先生
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年7月改訂第21版) [最終閲覧 : 2024/12/10]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年8月作成) [最終閲覧 : 2024/12/10]
- Anti-PD-1 antibody therapy for epithelial skin malignancies: An investigator-initiated, open-label, single-arm, multicenter, phase II clinical trial (NMSC-PD1 Study). Medicine (Baltimore) . 2020 Oct 30;99(44):e22913. PMID: 33126349
- 厚生労働省 : 最適使用推進ガイドラインニボルマブ (遺伝子組換え) ~上皮系皮膚悪性腫瘍~.令和6年2月
- オプジーボ®点滴静注、 根治切除不能な進行・再発の上皮系皮膚悪性腫瘍に対する効能又は効果の追加に係る国内製造販売承認事項一部変更承認を取得. 小野薬品工業株式会社 (2024年2月9日 発表) [最終閲覧 : 2024/12/10]
- Prognostic factors in cutaneous apocrine carcinoma: a single-institution retrospective study of 32 patients. Int J Clin Oncol (IF: 3.4; Q3) . 2023 Dec;28(12):1690-1696. PMID: 37801154
最終更新日 : 2024年12月10日
執筆医師 : 和田昇悟先生
監修薬剤師:国立がん研究センター中央病院 腫瘍内科 宇田川 涼子先生
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
Nivolumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*小野薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
電子添文¹⁾の用法および用量
2週間間隔

4週間間隔

1回240mgを2週間間隔または1回480mgを4週間間隔で点滴静注¹⁾
オプジーボ®電子添文 (2024年7月改訂第21版)¹⁾より作図、 引用
KCTR-D014²⁾は4週間間隔のレジメンで実施
各プロトコル
投与開始基準
NMSC-PD1試験³⁾のプロトコル例

Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より作図
中止基準
NMSC-PD1試験³⁾のプロトコル例
以下の少なくとも1つが発生した患者でニボルマブの投与を中止
- ≧Grade3の間質性肺炎
- ≧Grade2の目の痛み、 かすみ目で、
治療してもGrade1に改善のない場合
- ≧Grade3の気管支痙攣、 下痢、 大腸炎、
神経毒性、 過敏反応、 注入反応、 ぶどう膜炎
- ≧Grade3の血小板減少症 (5日以上継続)
- 前回の治療サイクル開始から10週以上経過
- 研究者または医師が薬剤投与中止を判断
Medicine (Baltimore) . 2020 Oct 30;99(44):e22913³⁾より引用
主な有害事象
KCTR-D014試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- TSH減少 12.9% (0%)
- 甲状腺機能亢進症 12.9% (3.2%)
- 甲状腺機能低下症 9.7% (0%)
- 発熱 9.7% (3.2%)
- 倦怠感 6.5% (0%)
- 貧血 6.5% (0%)
- 副腎機能不全 6.5% (0%)
- 間質性肺疾患 6.5% (3.2%)
- そう痒症 6.5% (0%)
厚生労働省 : 最適使用推進ガイドラインニボルマブ (遺伝子組換え) ~上皮系皮膚悪性腫瘍~.令和6年2月⁴⁾より引用
エキスパートによるワンポイント
根治切除不能な皮膚付属器癌の選択肢
皮膚付属器癌は希少がんであり、 転移する症例はさらに稀であるため、 薬物療法に関する知見が集積されていない。 そのため、 日本や米国においてガイドラインにて明確に推奨されるレジメンが存在しない。
2024年2月に 「根治切除不能な進行・再発の上皮系皮膚悪性腫瘍」 にNivolumabが適応となった⁵⁾。 それ以外に保険適応となっているレジメンはない。 同ライン薬剤はない。
ニボルマブの使用方法と副作用管理
通常、 成人にはNivolumabとして、 1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。 副作用が見られた場合は適宜医師の判断にて中止する。
ただし、 甲状腺機能低下症などに対しては、 同量で投与継続しながら甲状腺ホルモンを内服で補充することも可能である。 また、 軽度の検査値異常では、 同量で投与を継続することが多い。
NMSC-PD1試験³⁾では奏効率19.4%
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍患者31例を対象に、 Nivolumab 480mgを4週間間隔で点滴静注した。 奏効率は全体では19.4%であった。
一方、 31例のうち皮膚付属器癌は5例であり、 皮膚付属器癌に対する奏効率は0%であった。 皮膚付属器癌に対するNivolumabの効果は確立していないことに注意が必要である。
副作用は免疫関連有害事象として、 入院治療を要するものや、 不可逆的な障害を引き起こすものがあり、 血液検査などでのモニタリングが必要である。
その他の治療選択肢
国立がん研究センター中央病院にて、 2005年から2022年の間にアポクリン汗腺癌と診断された32例の患者を対象に実施された単一施設後ろ向きコホート研究におけるレジメンを参考に掲載する (年齢中央値 65.5歳)⁶⁾。
初回治療時に肺転移を有していた患者1例に対して、 FGFR阻害剤が使用され、 PFSは5ヵ月であった。
再発後に全身化学療法を受けた8例の患者のうち、 7人が化学療法を受け、 5人はFECOM (5-FU、 エピルビシン、 カルボプラチン、 ビンクリスチン、 マイトマイシンCの併用療法) を第一選択とした。 ORRは20%であり、 CRが20%、 PR 0%であった。 またPFS中央値は9ヵ月(範囲1~21ヵ月) であった。
その他の患者は、 パクリタキセルとカルボプラチンの併用療法、 またはペプロマイシン硫酸塩とマイトマイシンCの併用療法を受けた。 この2例の最良反応はSDであり、 それぞれPFSは6ヵ月であった。
全患者で第二選択の化学療法としてドセタキセルが投与されたが、 ORRは0%に留まり、 PFS中央値は9ヵ月 (範囲3~15か月) であった。
監修 : 国立がん研究センター中央病院皮膚腫瘍科 山崎直也先生
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2024年7月改訂第21版) [最終閲覧 : 2024/12/10]
- 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2024年8月作成) [最終閲覧 : 2024/12/10]
- Anti-PD-1 antibody therapy for epithelial skin malignancies: An investigator-initiated, open-label, single-arm, multicenter, phase II clinical trial (NMSC-PD1 Study). Medicine (Baltimore) . 2020 Oct 30;99(44):e22913. PMID: 33126349
- 厚生労働省 : 最適使用推進ガイドラインニボルマブ (遺伝子組換え) ~上皮系皮膚悪性腫瘍~.令和6年2月
- オプジーボ®点滴静注、 根治切除不能な進行・再発の上皮系皮膚悪性腫瘍に対する効能又は効果の追加に係る国内製造販売承認事項一部変更承認を取得. 小野薬品工業株式会社 (2024年2月9日 発表) [最終閲覧 : 2024/12/10]
- Prognostic factors in cutaneous apocrine carcinoma: a single-institution retrospective study of 32 patients. Int J Clin Oncol (IF: 3.4; Q3) . 2023 Dec;28(12):1690-1696. PMID: 37801154
最終更新日 : 2024年12月10日
執筆医師 : 和田昇悟先生
監修薬剤師:国立がん研究センター中央病院 腫瘍内科 宇田川 涼子先生
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。