本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 最小度催吐性
*リジェネロン・ジャパン株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾およびR2810-ONC-1676試験³⁾
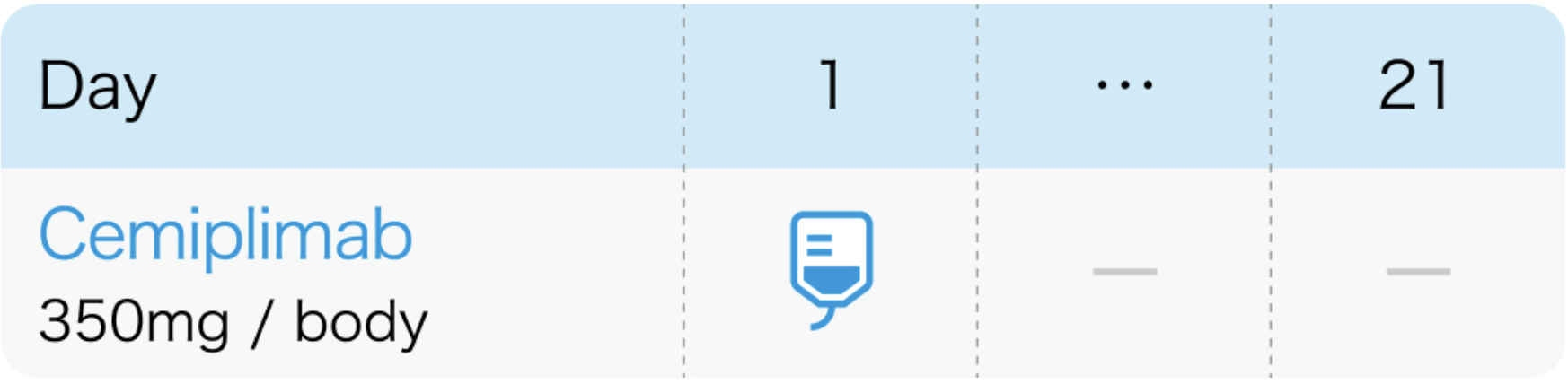
1回350mgを3週間間隔30分間で点滴静注
リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾、 N Engl J Med. 2022 Feb 10;386(6):544-555³⁾より作図
前投薬・投与スケジュール例
前投薬は不要である
-セミプリマブ350mg+生食100ml 30分点滴
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
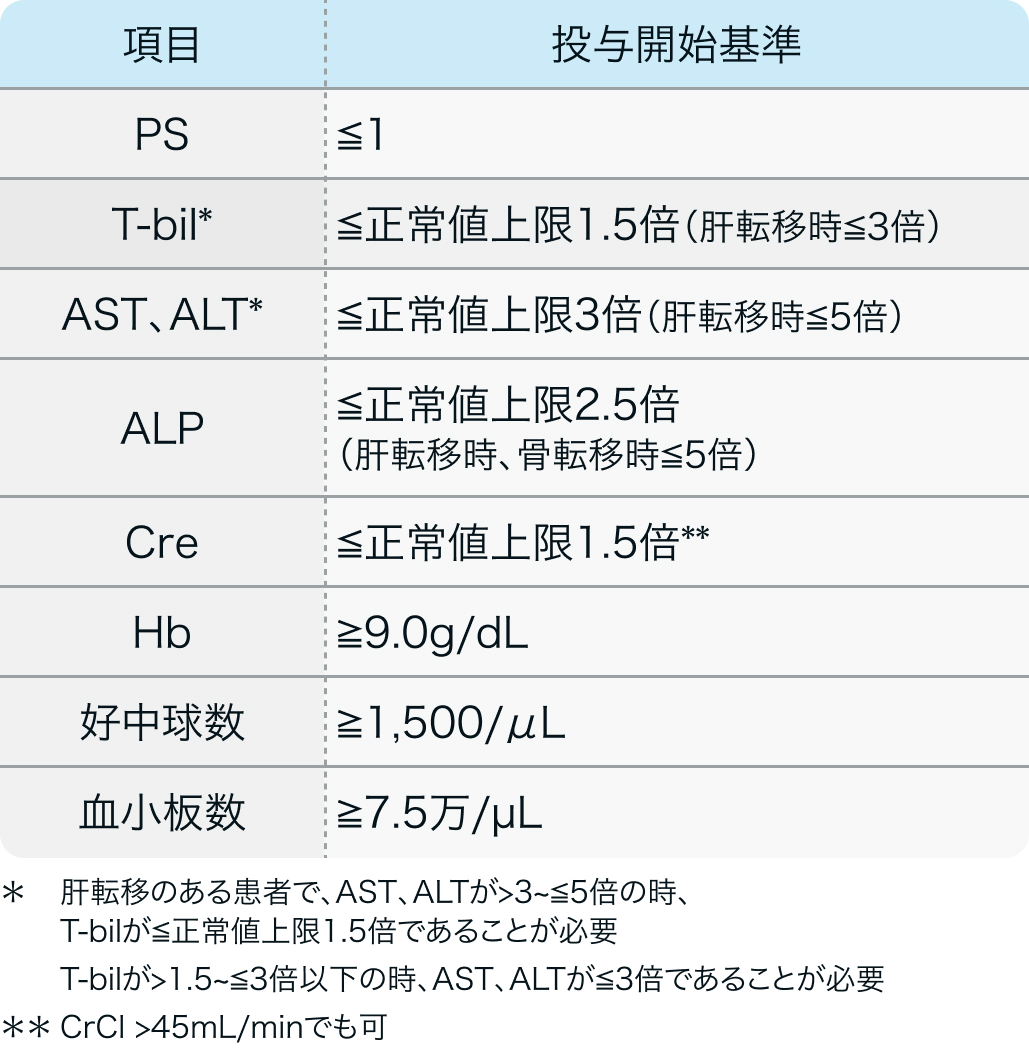
投与開始基準
R2810-ONC-1676試験³⁾のプロトコル
化学療法歴のある進行又は再発の子宮頸癌患者 (18歳以上)で以下に該当する患者
N Engl J Med. 2022 Feb 10;386(6):544-555³⁾より作図
電子添文の効能又は効果
がん化学療法後に増悪した進行又は再発の子宮頸癌。 1次治療、術後補助療法における有効性、安全性は確立していない。 リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾より引用
減量・休薬・中止基準
電子添文¹⁾の基準

リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾より作図
KeyData|臨床試験結果
EMPOWER Cervical-1試験³⁾
対象: プラチナ製剤を用いた化学療法歴のある再発・転移性の子宮頸癌患者608例
方法: セミプリマブ (350mg 3週間ごと) 群 vs 単剤化学療法群
【有効性】 セミプリマブ群
- ORR 16.4%
- mPFS 2.8ヵ月
- mOS 12.0ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~5)
- 貧血 25.0% (12.0%)
- 好中球数減少 2.0% (1.0%)
- 悪心 18.3% (0.3%)
- 倦怠感 16.7% (1.3%)
- 嘔吐16.0% (0.7%)
- 食欲減退 15.0% (0.3%)
- 便秘 15.0% (0%)
- 発熱 11.7% (0.3%)
- 下痢 10.7% (1.0%)
N Engl J Med. 2022 Feb 10;386(6):544-555³⁾より引用
エキスパートによるワンポイント
初の免疫チェックポイント阻害剤
子宮頸癌では、 初めて承認された免疫チェックポイント阻害剤です。 現在、 転移・再発後の初回治療として、 Pembrolizumab (プラチナ製剤と併用) が承認されています⁴⁾。
2次治療として全生存期間を有意に延長
転移・再発後の二次治療として、 全生存期間を有意に延長しました (12.0ヵ月 vs 8.5ヵ月、 HR 0.685、 p=0.00011)³⁾。
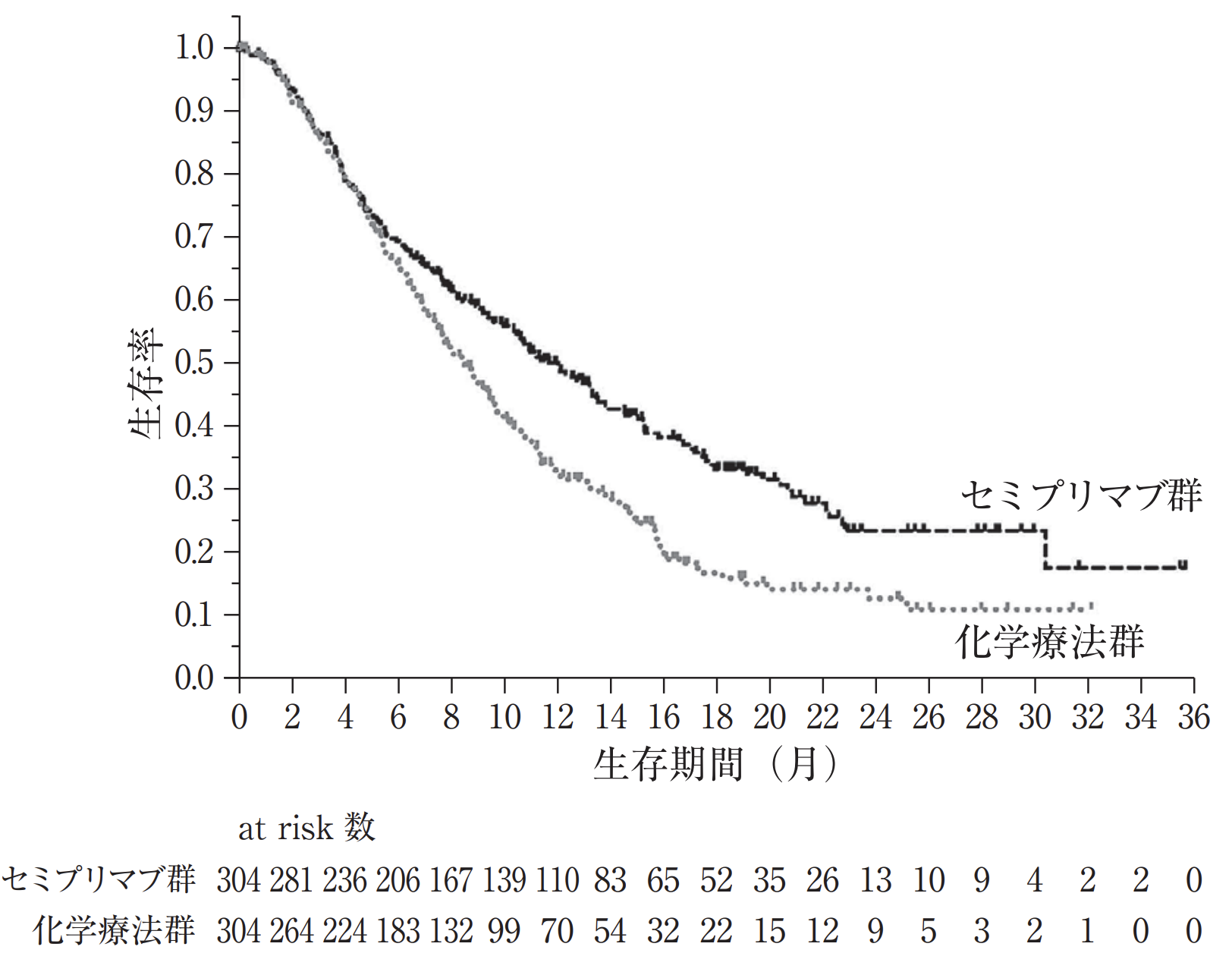
リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾よりN Engl J Med. 2022 Feb 10;386(6):544-555³⁾におけるデータ結果を引用
可能であればPD-L1の測定を
本剤の適応症例としては、 転移・再発後初回治療として、 Pembrolizumabを使用していない患者さんが適応になると思います。
サブグループ解析ではありますが、 PD-L1の発現が、 1%未満の患者さんにはあまり効果が期待できないため、 可能であれば、 PD-L1を測定しておくことをお勧めします*。
*電子添文(添付文書)にはPD-L1に関する記載はなし¹⁾
監修 : 勝俣 範之先生日本医科大学 武蔵小杉病院 腫瘍内科教授
出典
- リジェネロン・ジャパン株式会社. リブタヨ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/9/30]
- リジェネロン・ジャパン株式会社. リブタヨ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/9/30]
- Survival with Cemiplimab in Recurrent Cervical Cancer. N Engl J Med. 2022 Feb 10;386(6):544-555. PMID: 35139273
- キイトルーダ®電子添文 (2024年8月改訂 第19版) [最終閲覧 : 2024/9/30]
最終更新日 : 2024年9月30日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
Cemiplimab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 最小度催吐性
*リジェネロン・ジャパン株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾およびR2810-ONC-1676試験³⁾

1回350mgを3週間間隔30分間で点滴静注
リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾、 N Engl J Med. 2022 Feb 10;386(6):544-555³⁾より作図
前投薬・投与スケジュール例
前投薬は不要である
-セミプリマブ350mg+生食100ml 30分点滴
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
R2810-ONC-1676試験³⁾のプロトコル
化学療法歴のある進行又は再発の子宮頸癌患者 (18歳以上)で以下に該当する患者

N Engl J Med. 2022 Feb 10;386(6):544-555³⁾より作図
電子添文の効能又は効果
がん化学療法後に増悪した進行又は再発の子宮頸癌。 1次治療、術後補助療法における有効性、安全性は確立していない。 リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾より引用
減量・休薬・中止基準
電子添文¹⁾の基準

リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾より作図
KeyData|臨床試験結果
EMPOWER Cervical-1試験³⁾
対象: プラチナ製剤を用いた化学療法歴のある再発・転移性の子宮頸癌患者608例
方法: セミプリマブ (350mg 3週間ごと) 群 vs 単剤化学療法群
【有効性】 セミプリマブ群
- ORR 16.4%
- mPFS 2.8ヵ月
- mOS 12.0ヵ月
【安全性】主な有害事象 (カッコ内 Grade3~5)
- 貧血 25.0% (12.0%)
- 好中球数減少 2.0% (1.0%)
- 悪心 18.3% (0.3%)
- 倦怠感 16.7% (1.3%)
- 嘔吐16.0% (0.7%)
- 食欲減退 15.0% (0.3%)
- 便秘 15.0% (0%)
- 発熱 11.7% (0.3%)
- 下痢 10.7% (1.0%)
N Engl J Med. 2022 Feb 10;386(6):544-555³⁾より引用
エキスパートによるワンポイント
初の免疫チェックポイント阻害剤
子宮頸癌では、 初めて承認された免疫チェックポイント阻害剤です。 現在、 転移・再発後の初回治療として、 Pembrolizumab (プラチナ製剤と併用) が承認されています⁴⁾。
2次治療として全生存期間を有意に延長
転移・再発後の二次治療として、 全生存期間を有意に延長しました (12.0ヵ月 vs 8.5ヵ月、 HR 0.685、 p=0.00011)³⁾。

リブタヨ®電子添文 (2024年6月改訂第4版)¹⁾よりN Engl J Med. 2022 Feb 10;386(6):544-555³⁾におけるデータ結果を引用
可能であればPD-L1の測定を
本剤の適応症例としては、 転移・再発後初回治療として、 Pembrolizumabを使用していない患者さんが適応になると思います。
サブグループ解析ではありますが、 PD-L1の発現が、 1%未満の患者さんにはあまり効果が期待できないため、 可能であれば、 PD-L1を測定しておくことをお勧めします*。
*電子添文(添付文書)にはPD-L1に関する記載はなし¹⁾
監修 : 勝俣 範之先生日本医科大学 武蔵小杉病院 腫瘍内科教授
出典
- リジェネロン・ジャパン株式会社. リブタヨ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/9/30]
- リジェネロン・ジャパン株式会社. リブタヨ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/9/30]
- Survival with Cemiplimab in Recurrent Cervical Cancer. N Engl J Med. 2022 Feb 10;386(6):544-555. PMID: 35139273
- キイトルーダ®電子添文 (2024年8月改訂 第19版) [最終閲覧 : 2024/9/30]
最終更新日 : 2024年9月30日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。