本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗HER2抗体 トラスツズマブ デルクステカン
*第一三共株式会社の外部サイトへ遷移します¹⁾
投与スケジュール
【1コース】3週間
【催吐性】 中等度~高度催吐性*
【FN発症】低リスク

1回5.4mg/kgを90分かけ3週間間隔で点滴静注。 初回の忍容性良好なら2回目以降の投与時間は30分間まで短縮可能。
エンハーツ®︎ 添付文書 2024年4月改訂 第10版より引用
*NCCN GL³⁾では高度、 2023年10月改訂の国内ガイドライン⁴⁾では中等度催吐性として扱われている。 制吐薬は、 NK1拮抗薬や5HT3拮抗薬、 デキサメタゾン、 その併用を投与することがある。
KeyData|臨床試験結果
第Ⅱ相試験 (DESTINY-Lung02)⁵⁾
HER2遺伝子変異陽性の既治療NSCLC152例を対象にT-DXd単剤療法 5.4 vs 6.4mg/kgの有効性と安全性を検証
【有効性】5.4mg/kg群の結果
- ORR 49.0%
- mPFS 9.9ヵ月
- mOS 19.5ヵ月
【安全性】5.4mg/kg群の結果
≧Grade 3 38.6% (間質性肺炎12.9%)
- 悪心 67.3% (Grade3~4 4.0%)
- 好中球数減少 42.6% (18.8%)
- 疲労 44.6% (7.9%)
- 食欲減退 39.6% (2.0%)
- 貧血 36.6%(10.9%)
- 便秘 36.6% (1.0%)
- 嘔吐 31.7% (3.0%)
- 白血球数減少 28.7% (5.0%)
- 血小板数減少 27.7% (5.9%)
- 下痢 22.8% (1.0%)
- 脱毛症 21.8% (0%)
- AST上昇 21.8% (3.0%)
- 筋骨格痛 16.8% (1.0%)
- 口内炎 15.8% (0%)
👨⚕️監修医師コメント:ドライバー陽性の薬剤ではあるが、 本薬剤のAEは細胞障害性薬剤由来のもの。 ILDの頻度 (約10%) や好発時期 (中央値5ヵ月) に注意しつつ、 慎重な観察が必要。
各プロトコル
減量・休薬・中止基準
電子添付文書¹⁾、 適正使用ガイド 2024年4月改訂²⁾をもとに作成 (NCI-CTCAE ver.5.0)
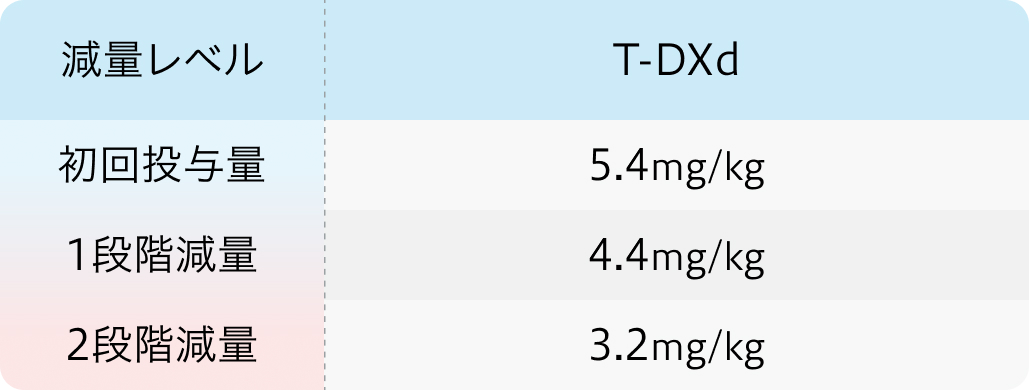
3.2mg/kgで忍容性が得られない場合、 中止
DESTINY-Lung02プロトコル
実際の副作用マネジメント
エンハーツ®︎ 適正使用ガイド²⁾を参照
特徴と注意点
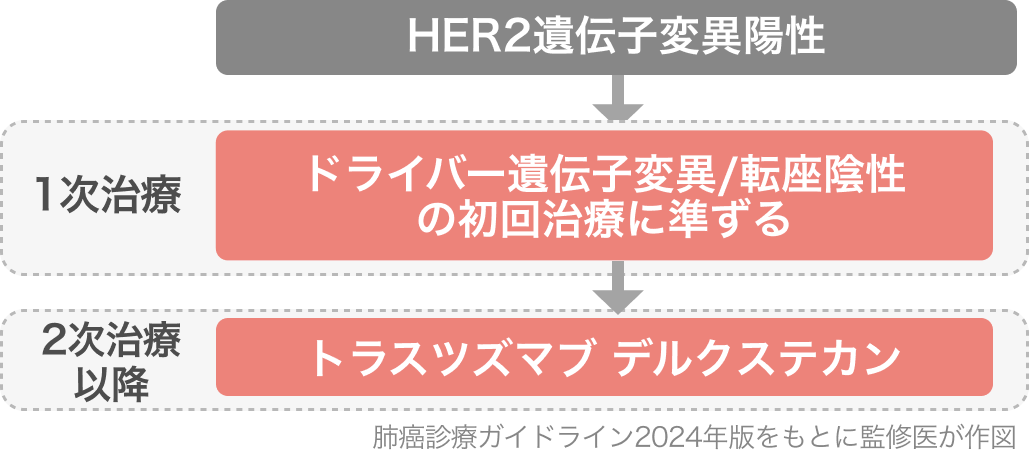
肺癌診療ガイドライン2024の推奨
2023年8月のエンハーツ®︎適応追加と、 臨床試験 (DESTINY-Lung01⁶⁾、02⁵⁾) をもって、肺癌診療ガイドライン2024においてもHER2遺伝子変異陽性NSCLCに対し、 二次治療以降でT-DXd単剤療法を行うよう強く推奨されている [推奨の強さ:1、 エビデンスの強さ:C]⁷⁾。
その他の注意点
一般名が類似しているトラスツズマブ及びトラスツズマブ エムタンシンとの取り違えが起こらないように処方、 調剤時には十分注意する。 また、 カンプトテシン誘導体を含むが、 グルクロン酸抱合体の検出はなく、 また、 ヒト肝ミクロソームを用いた検討からもUGT依存的な代謝は認められていないため、 UGT1A1の遺伝子多型が有効性・安全性に影響する可能性は低いと考えられている。
出典
1) 第一三共株式会社 エンハーツ®︎ 添付文書 2024年4月改訂 第10版) [最終閲覧日 2024/10/27]
2) 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2024年4月改訂 [最終閲覧日 2024/10/27]
3) NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Antiemesis Version 1.2024 — December 13, 2023 [最終閲覧日 2024/10/27]
4) 日本癌治療学会. 制吐薬適正使用ガイドライン 2023年10月改訂 第3版. 金原出版 2023
7) 日本肺癌学会. 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
最終更新日 : 2024年10月27日
監修医師 : HOKUTO編集部監修医師
T-DXd (Trastuzumab deruxtecan)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗HER2抗体 トラスツズマブ デルクステカン
*第一三共株式会社の外部サイトへ遷移します¹⁾
投与スケジュール
【1コース】3週間
【催吐性】 中等度~高度催吐性*
【FN発症】低リスク

1回5.4mg/kgを90分かけ3週間間隔で点滴静注。 初回の忍容性良好なら2回目以降の投与時間は30分間まで短縮可能。
エンハーツ®︎ 添付文書 2024年4月改訂 第10版より引用
*NCCN GL³⁾では高度、 2023年10月改訂の国内ガイドライン⁴⁾では中等度催吐性として扱われている。 制吐薬は、 NK1拮抗薬や5HT3拮抗薬、 デキサメタゾン、 その併用を投与することがある。
KeyData|臨床試験結果
第Ⅱ相試験 (DESTINY-Lung02)⁵⁾
HER2遺伝子変異陽性の既治療NSCLC152例を対象にT-DXd単剤療法 5.4 vs 6.4mg/kgの有効性と安全性を検証
【有効性】5.4mg/kg群の結果
- ORR 49.0%
- mPFS 9.9ヵ月
- mOS 19.5ヵ月
【安全性】5.4mg/kg群の結果
≧Grade 3 38.6% (間質性肺炎12.9%)
- 悪心 67.3% (Grade3~4 4.0%)
- 好中球数減少 42.6% (18.8%)
- 疲労 44.6% (7.9%)
- 食欲減退 39.6% (2.0%)
- 貧血 36.6%(10.9%)
- 便秘 36.6% (1.0%)
- 嘔吐 31.7% (3.0%)
- 白血球数減少 28.7% (5.0%)
- 血小板数減少 27.7% (5.9%)
- 下痢 22.8% (1.0%)
- 脱毛症 21.8% (0%)
- AST上昇 21.8% (3.0%)
- 筋骨格痛 16.8% (1.0%)
- 口内炎 15.8% (0%)
👨⚕️監修医師コメント:ドライバー陽性の薬剤ではあるが、 本薬剤のAEは細胞障害性薬剤由来のもの。 ILDの頻度 (約10%) や好発時期 (中央値5ヵ月) に注意しつつ、 慎重な観察が必要。
各プロトコル
減量・休薬・中止基準
電子添付文書¹⁾、 適正使用ガイド 2024年4月改訂²⁾をもとに作成 (NCI-CTCAE ver.5.0)

3.2mg/kgで忍容性が得られない場合、 中止
DESTINY-Lung02プロトコル
実際の副作用マネジメント
エンハーツ®︎ 適正使用ガイド²⁾を参照
特徴と注意点
肺癌診療ガイドライン2024の推奨
2023年8月のエンハーツ®︎適応追加と、 臨床試験 (DESTINY-Lung01⁶⁾、02⁵⁾) をもって、肺癌診療ガイドライン2024においてもHER2遺伝子変異陽性NSCLCに対し、 二次治療以降でT-DXd単剤療法を行うよう強く推奨されている [推奨の強さ:1、 エビデンスの強さ:C]⁷⁾。

その他の注意点
一般名が類似しているトラスツズマブ及びトラスツズマブ エムタンシンとの取り違えが起こらないように処方、 調剤時には十分注意する。 また、 カンプトテシン誘導体を含むが、 グルクロン酸抱合体の検出はなく、 また、 ヒト肝ミクロソームを用いた検討からもUGT依存的な代謝は認められていないため、 UGT1A1の遺伝子多型が有効性・安全性に影響する可能性は低いと考えられている。
出典
1) 第一三共株式会社 エンハーツ®︎ 添付文書 2024年4月改訂 第10版) [最終閲覧日 2024/10/27]
2) 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2024年4月改訂 [最終閲覧日 2024/10/27]
3) NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Antiemesis Version 1.2024 — December 13, 2023 [最終閲覧日 2024/10/27]
4) 日本癌治療学会. 制吐薬適正使用ガイドライン 2023年10月改訂 第3版. 金原出版 2023
7) 日本肺癌学会. 肺癌診療ガイドライン-悪性胸膜中皮腫・ 胸腺腫瘍含む-2024年版
最終更新日 : 2024年10月27日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。