本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
※EDP療法は副腎癌に対して保険適用外であるので注意
薬剤情報
エトポシド® (薬剤情報)
ドキソルビシン® (薬剤情報)
シスプラチン® (薬剤情報)
副腎皮質ホルモン合成阻害薬 ミトタン
*ヤクルト本社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】 高度
【FN発症】未報告
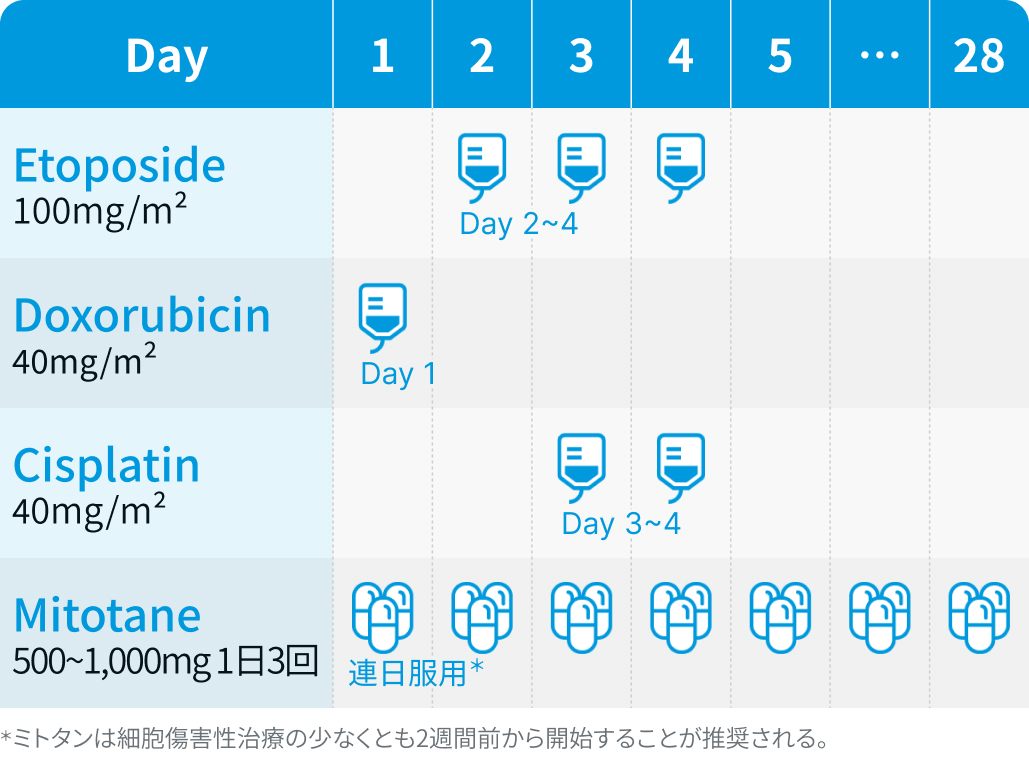
EDP : 4週を1サイクルとし、 エトポシド100 mg/m²を2~4日目に連日点滴静注、 ドキソルビシン40 mg/m²を1日目に点滴静注、 シスプラチン40 mg/m²を3・4日目に点滴静注 (最大6サイクル)
ミトタン : 1回500~1,000mgを1日3回経口投与から開始し、 有効量に達するまで漸増
FIRM-ACT試験²⁾では、 ミトタンは細胞傷害性治療の少なくとも2週間前から開始し、 血中濃度14–20μg/mLを目標に管理することが推奨された (本邦では保険診療での測定は不可)。 また、 全例にグルココルチコイド補充療法が実施された。
Key Data|臨床試験結果
📊 FIRM-ACT試験
N Engl J Med. 2012;366:2189-97.
進行性副腎皮質癌患者304例を対象とした無作為化比較試験。 EDP-mitotane (EDP-M) 群とストレプトゾシン-mitotane (S-M) 群に無作為に割り付け、 主要評価項目として全生存期間が設定された。
【有効性】 EDP-M群 (vs S-M群)
- OS中央値 : 14.8ヵ月 (vs 12.0ヵ月、 p=0.07)
- PFS中央値 : 5.0ヵ月 (vs 2.1ヵ月)
- 奏効率 : 23.2% (vs 9.2%)
【安全性】重篤な有害事象
- 副腎不全 3.4%
- 骨髄毒性 11.5%
- 心血管または血栓塞栓イベント 6.8%
- 疲労または全身の健康状態悪化 5.4%
- 消化管障害 4.1%
- 肝機能障害 0%
- 腎機能障害 0.7%
- 感染症 6.8%
- 神経毒性 3.4%
- 呼吸器障害 6.1%
- その他 10.1%
各プロトコル
適格基準
FIRM-ACT試験²⁾の主な適格基準
- 18歳以上
- ECOG PS 0-2
- 好中球数 ≥1,500/mm³
- 血小板数 ≥10万/mm³
- 腎機能 : SCre<2mg/dLまたはCrCl>50 mL/min
- 肝機能 : 血清ビリルビン<2xULN、 かつAST/ALT<3xULN (ミトタン投与中の患者では<5xULNまで許容)
腎障害患者に対する用量調整
ETP³⁾ :
- CrCl 10–50mL/min : 75%用量に減量
- CrCl<10mL/min : 50%用量に減量
カナダ・ブリティッシュコロンビア州の州立がん専門医療機関 : BC Cancerが公開しているBC Cancer Cancer Drug Manualによる参考情報
DXR³⁾ :
- 調整不要
カナダ・ブリティッシュコロンビア州の州立がん専門医療機関 : BC Cancerが公開しているBC Cancer Cancer Drug Manualによる参考情報
CDDP⁴⁾ :
- 重篤な腎障害例への投与は禁忌
- CrCl 46~60mL/minでは75%、 31~45mL/minでは50%に減量し、 CrCl≦30mL/minでは投与を推奨しない
- 別の報告 : CrCl 30~49mL/minでは75%、 10~29mL/minでは投与が必要な場合に75%、 CrCl<10mL/minでは投与が必要な場合に50%に減量
グルココルチコイド補充療法
FIRM-ACT試験²⁾では、 全例にグルココルチコイド補充療法が行われ、 臨床所見に基づいて用量調整が実施された。
- ヒドロコルチゾン 50mg/日 (20-20-10mgに分割) またはコルチゾン酢酸エステル75mg/日
- 血圧、 血清カリウム、 血漿レニン活性に応じてフルドロコルチゾンの追加を考慮
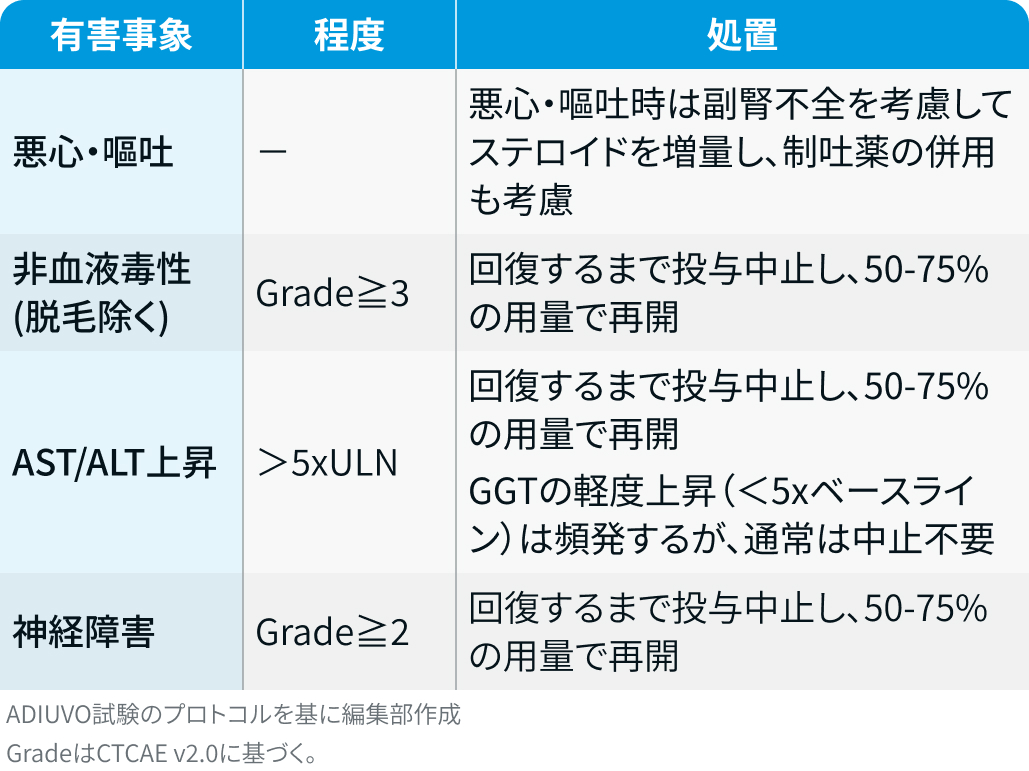
有害事象発現時の減量・休薬・中止基準
FIRM-ACT試験²⁾では、 以下の基準に基づいて対応が行われた。
EDP療法 :
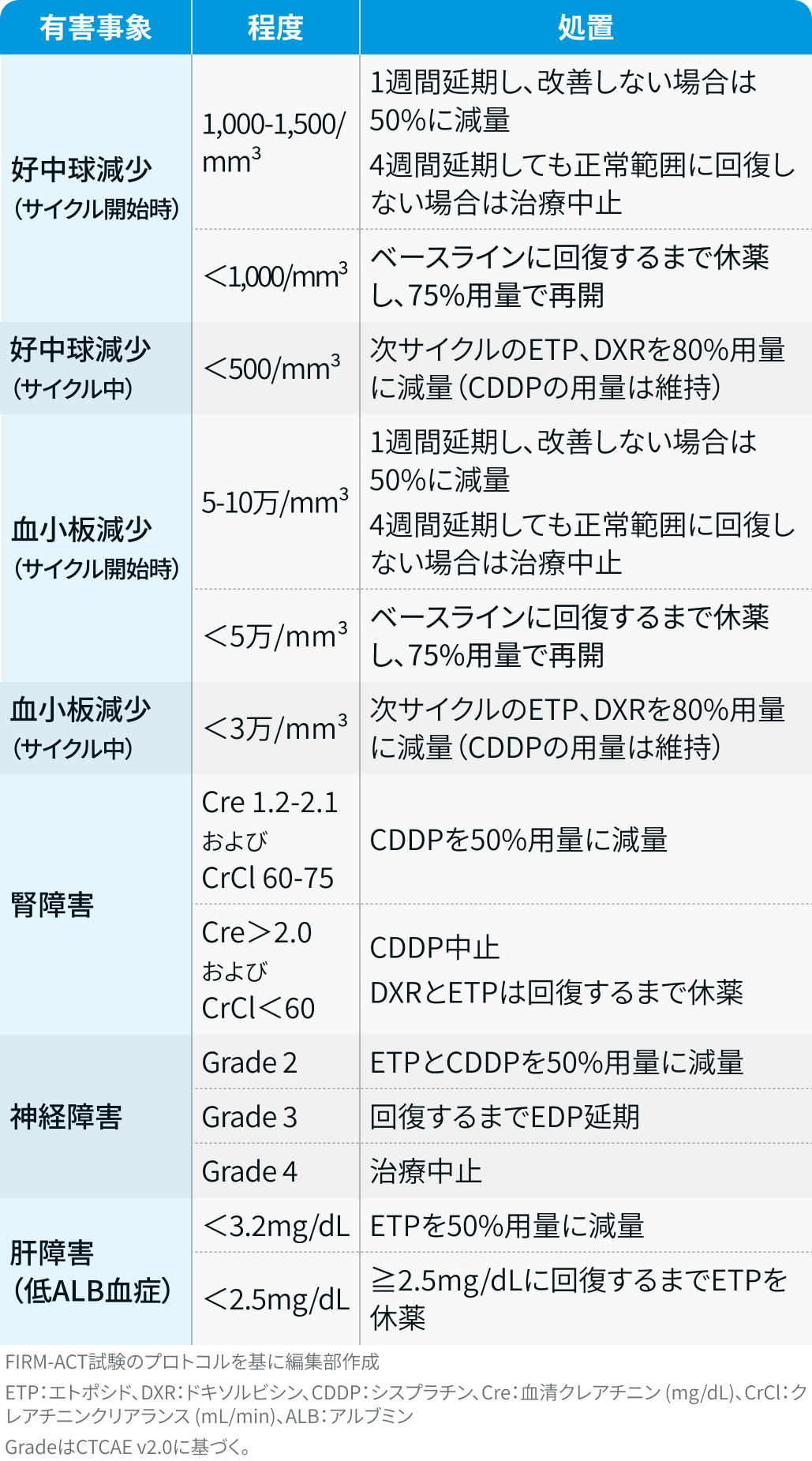
ミトタン : ミトタン目標血中濃度14–20μg/mLに基づいて用量調整が行われた。
レジメンの特徴と注意点
本レジメンの位置付け
EDP-M療法は、 未治療の根治的切除不能な進行性副腎皮質癌 (ステージIII-IV) に対して適用される 。 ただし、 日本ではEDP療法は副腎癌に対して保険適用外である。
専門医の視点
国立がん研究センター東病院 腫瘍内科 近藤千紘先生
エトポシド+ドキソルビシン+シスプラチン+ミトタンの4剤併用療法である。 FIRM-ACT試験の結果、 進行再発の副腎皮質癌においてストレプトゾシン+ミトタン療法と比較したPFSとRRが優れており、 「内分泌非活性副腎腫瘍ガイドライン2022年版」⁵⁾にももっとも優れたレジメンとして記載がある。 一方、 ミトタン以外は副腎がんに対する保険適応はない。
薬剤師からのワンポイントアドバイス
国立がん研究センター東病院 薬剤部 楠原佳那子先生
ヒドロコルチゾンの併用について⁶⁾
コルチゾール過剰が持続している患者を除き、 ミトタン治療中のすべての患者には、 グルココルチコイドの併用が推奨されています。 ミトタン投与初日からヒドロコルチゾン20mg/日を併用する方法に加え、 ミトタン開始2~3週後や副腎機能不全の発症後に投与を開始することも可能です。
CYP3A4誘導作用に注意⁷⁾
ミトタンは強力なCYP3A4誘導薬であり、 アムロジピンなどのジヒドロピリジン系Ca拮抗薬の降圧効果が減弱する可能性があります。 また、 フェンタニルやオキシコドンなど一部のオピオイドも代謝が促進されるため、 モルヒネやヒドロモルフォンへの変更が必要となる場合があります。 EDP-M療法においては、 ドキソルビシンやエトポシドの血中濃度が低下する可能性がありますが、 FIRM-ACT試験では血中濃度の測定は実施されていません。
ミトタンの作用機序
ジクロロジフェニルトリクロロエタン (DDT) の異性体であり、 脂溶性が高く、 副腎皮質の束状層および網状層に選択的に作用して壊死や萎縮を引き起こす。
一方、 球状層は保たれることが多く、 鉱質コルチコイドの欠乏に至ることは稀である。
ミトタン投与中の注意事項
- ショック時や重篤な外傷時は一時的に投与中止
- スピロノラクトン、 ペントバルビタール、 ドラビリン、 エンシトレルビルフマル酸、 レナカバビルとの併用は禁忌
- 長期大量投与により脳機能障害を来すことがあり、 定期的な行動・神経学的評価が必要
出典
- オペプリム®添付文書 (2024年01月改訂(第4版)[最終閲覧: 2025/6/24]
- N Engl J Med. 2012 Jun 7;366(23):2189-97.
- BC Cancer. Cancer Drug Manual. [最終閲覧: 2025/6/24]
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
- 日本泌尿器科学会、日本内分泌外科学会編集 : 内分泌非活性副腎腫瘍ガイドライン2022年版. メディカルレビュー社.
- Eur J Endocrinol. 2018;179(4):G1-G46.
- Clin Endocrinol (Oxf). 2011;75(5):585-91.
最終更新日 : 2025年6月24日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
EDP-M
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
※EDP療法は副腎癌に対して保険適用外であるので注意
薬剤情報
エトポシド® (薬剤情報)
ドキソルビシン® (薬剤情報)
シスプラチン® (薬剤情報)
副腎皮質ホルモン合成阻害薬 ミトタン
*ヤクルト本社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】 高度
【FN発症】未報告

EDP : 4週を1サイクルとし、 エトポシド100 mg/m²を2~4日目に連日点滴静注、 ドキソルビシン40 mg/m²を1日目に点滴静注、 シスプラチン40 mg/m²を3・4日目に点滴静注 (最大6サイクル)
ミトタン : 1回500~1,000mgを1日3回経口投与から開始し、 有効量に達するまで漸増
FIRM-ACT試験²⁾では、 ミトタンは細胞傷害性治療の少なくとも2週間前から開始し、 血中濃度14–20μg/mLを目標に管理することが推奨された (本邦では保険診療での測定は不可)。 また、 全例にグルココルチコイド補充療法が実施された。
Key Data|臨床試験結果
📊 FIRM-ACT試験
N Engl J Med. 2012;366:2189-97.
進行性副腎皮質癌患者304例を対象とした無作為化比較試験。 EDP-mitotane (EDP-M) 群とストレプトゾシン-mitotane (S-M) 群に無作為に割り付け、 主要評価項目として全生存期間が設定された。
【有効性】 EDP-M群 (vs S-M群)
- OS中央値 : 14.8ヵ月 (vs 12.0ヵ月、 p=0.07)
- PFS中央値 : 5.0ヵ月 (vs 2.1ヵ月)
- 奏効率 : 23.2% (vs 9.2%)
【安全性】重篤な有害事象
- 副腎不全 3.4%
- 骨髄毒性 11.5%
- 心血管または血栓塞栓イベント 6.8%
- 疲労または全身の健康状態悪化 5.4%
- 消化管障害 4.1%
- 肝機能障害 0%
- 腎機能障害 0.7%
- 感染症 6.8%
- 神経毒性 3.4%
- 呼吸器障害 6.1%
- その他 10.1%
各プロトコル
適格基準
FIRM-ACT試験²⁾の主な適格基準
- 18歳以上
- ECOG PS 0-2
- 好中球数 ≥1,500/mm³
- 血小板数 ≥10万/mm³
- 腎機能 : SCre<2mg/dLまたはCrCl>50 mL/min
- 肝機能 : 血清ビリルビン<2xULN、 かつAST/ALT<3xULN (ミトタン投与中の患者では<5xULNまで許容)
腎障害患者に対する用量調整
ETP³⁾ :
- CrCl 10–50mL/min : 75%用量に減量
- CrCl<10mL/min : 50%用量に減量
カナダ・ブリティッシュコロンビア州の州立がん専門医療機関 : BC Cancerが公開しているBC Cancer Cancer Drug Manualによる参考情報
DXR³⁾ :
- 調整不要
カナダ・ブリティッシュコロンビア州の州立がん専門医療機関 : BC Cancerが公開しているBC Cancer Cancer Drug Manualによる参考情報
CDDP⁴⁾ :
- 重篤な腎障害例への投与は禁忌
- CrCl 46~60mL/minでは75%、 31~45mL/minでは50%に減量し、 CrCl≦30mL/minでは投与を推奨しない
- 別の報告 : CrCl 30~49mL/minでは75%、 10~29mL/minでは投与が必要な場合に75%、 CrCl<10mL/minでは投与が必要な場合に50%に減量
グルココルチコイド補充療法
FIRM-ACT試験²⁾では、 全例にグルココルチコイド補充療法が行われ、 臨床所見に基づいて用量調整が実施された。
- ヒドロコルチゾン 50mg/日 (20-20-10mgに分割) またはコルチゾン酢酸エステル75mg/日
- 血圧、 血清カリウム、 血漿レニン活性に応じてフルドロコルチゾンの追加を考慮
有害事象発現時の減量・休薬・中止基準
FIRM-ACT試験²⁾では、 以下の基準に基づいて対応が行われた。
EDP療法 :

ミトタン : ミトタン目標血中濃度14–20μg/mLに基づいて用量調整が行われた。

レジメンの特徴と注意点
本レジメンの位置付け
EDP-M療法は、 未治療の根治的切除不能な進行性副腎皮質癌 (ステージIII-IV) に対して適用される 。 ただし、 日本ではEDP療法は副腎癌に対して保険適用外である。
専門医の視点
国立がん研究センター東病院 腫瘍内科 近藤千紘先生
エトポシド+ドキソルビシン+シスプラチン+ミトタンの4剤併用療法である。 FIRM-ACT試験の結果、 進行再発の副腎皮質癌においてストレプトゾシン+ミトタン療法と比較したPFSとRRが優れており、 「内分泌非活性副腎腫瘍ガイドライン2022年版」⁵⁾にももっとも優れたレジメンとして記載がある。 一方、 ミトタン以外は副腎がんに対する保険適応はない。
薬剤師からのワンポイントアドバイス
国立がん研究センター東病院 薬剤部 楠原佳那子先生
ヒドロコルチゾンの併用について⁶⁾
コルチゾール過剰が持続している患者を除き、 ミトタン治療中のすべての患者には、 グルココルチコイドの併用が推奨されています。 ミトタン投与初日からヒドロコルチゾン20mg/日を併用する方法に加え、 ミトタン開始2~3週後や副腎機能不全の発症後に投与を開始することも可能です。
CYP3A4誘導作用に注意⁷⁾
ミトタンは強力なCYP3A4誘導薬であり、 アムロジピンなどのジヒドロピリジン系Ca拮抗薬の降圧効果が減弱する可能性があります。 また、 フェンタニルやオキシコドンなど一部のオピオイドも代謝が促進されるため、 モルヒネやヒドロモルフォンへの変更が必要となる場合があります。 EDP-M療法においては、 ドキソルビシンやエトポシドの血中濃度が低下する可能性がありますが、 FIRM-ACT試験では血中濃度の測定は実施されていません。
ミトタンの作用機序
ジクロロジフェニルトリクロロエタン (DDT) の異性体であり、 脂溶性が高く、 副腎皮質の束状層および網状層に選択的に作用して壊死や萎縮を引き起こす。
一方、 球状層は保たれることが多く、 鉱質コルチコイドの欠乏に至ることは稀である。
ミトタン投与中の注意事項
- ショック時や重篤な外傷時は一時的に投与中止
- スピロノラクトン、 ペントバルビタール、 ドラビリン、 エンシトレルビルフマル酸、 レナカバビルとの併用は禁忌
- 長期大量投与により脳機能障害を来すことがあり、 定期的な行動・神経学的評価が必要
出典
- オペプリム®添付文書 (2024年01月改訂(第4版)[最終閲覧: 2025/6/24]
- N Engl J Med. 2012 Jun 7;366(23):2189-97.
- BC Cancer. Cancer Drug Manual. [最終閲覧: 2025/6/24]
- 日本腎臓学会、 日本癌治療学会、 日本臨床腫瘍学会、 日本腎臓病薬物療法学会編 : がん薬物療法時の腎障害診療ガイドライン2022. ライフサイエンス出版.
- 日本泌尿器科学会、日本内分泌外科学会編集 : 内分泌非活性副腎腫瘍ガイドライン2022年版. メディカルレビュー社.
- Eur J Endocrinol. 2018;179(4):G1-G46.
- Clin Endocrinol (Oxf). 2011;75(5):585-91.
最終更新日 : 2025年6月24日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。