本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソール® (添付文書)
用法用量
N Engl J Med. 2008 Apr 17;358(16):1663-71.¹⁾より抜粋
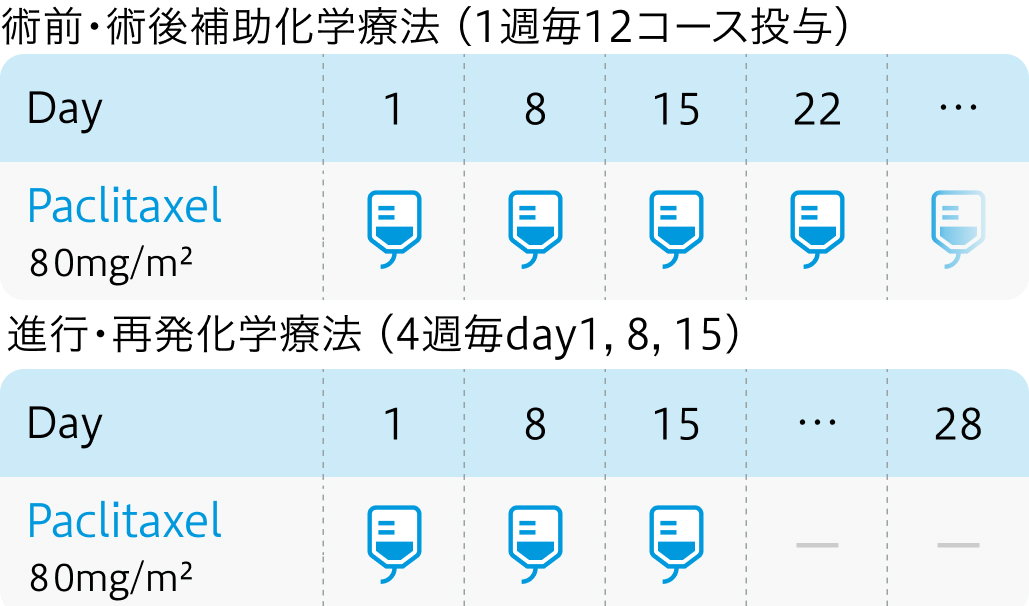
添付文書では 「1日1回100mg/㎡ (体表面積) を1時間かけて点滴静注し、 週1回投与を6週連続し、 少なくとも2週間休薬」と記載あり
前投薬
- 過敏症予防を目的としてデキサメタゾン、 抗ヒスタミン薬 (ジフェンヒドラミン 50mg内服、 またはd-クロルフェニラミン 5mg静注) 、 H2受容体拮抗薬を投与する。
- 前投薬のデキサメタゾンは初回投与時は6.6mgとし、 次回以降は3.3mgに減量してもよい。
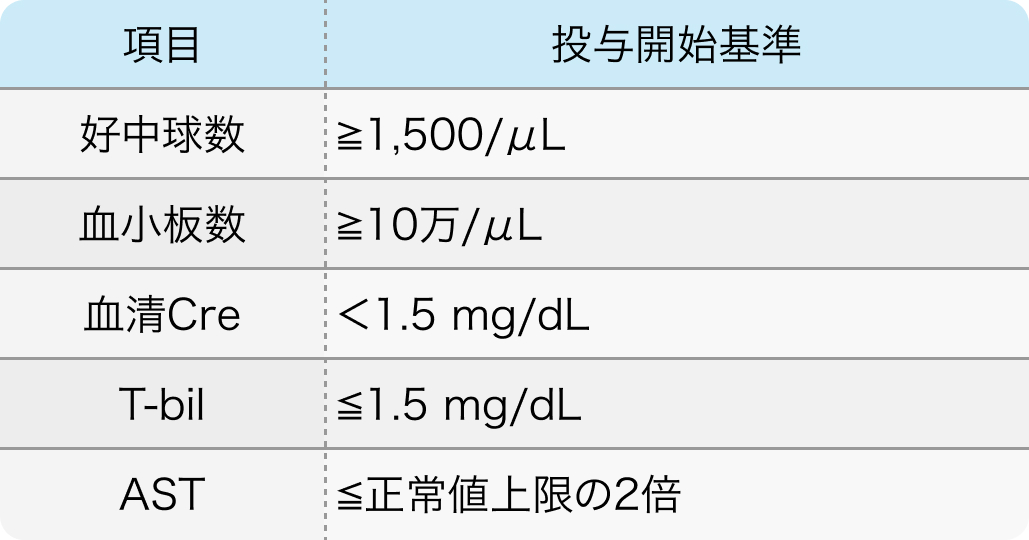
投与開始基準
N Engl J Med. 2008 Apr 17;358(16):1663-71.¹⁾より抜粋
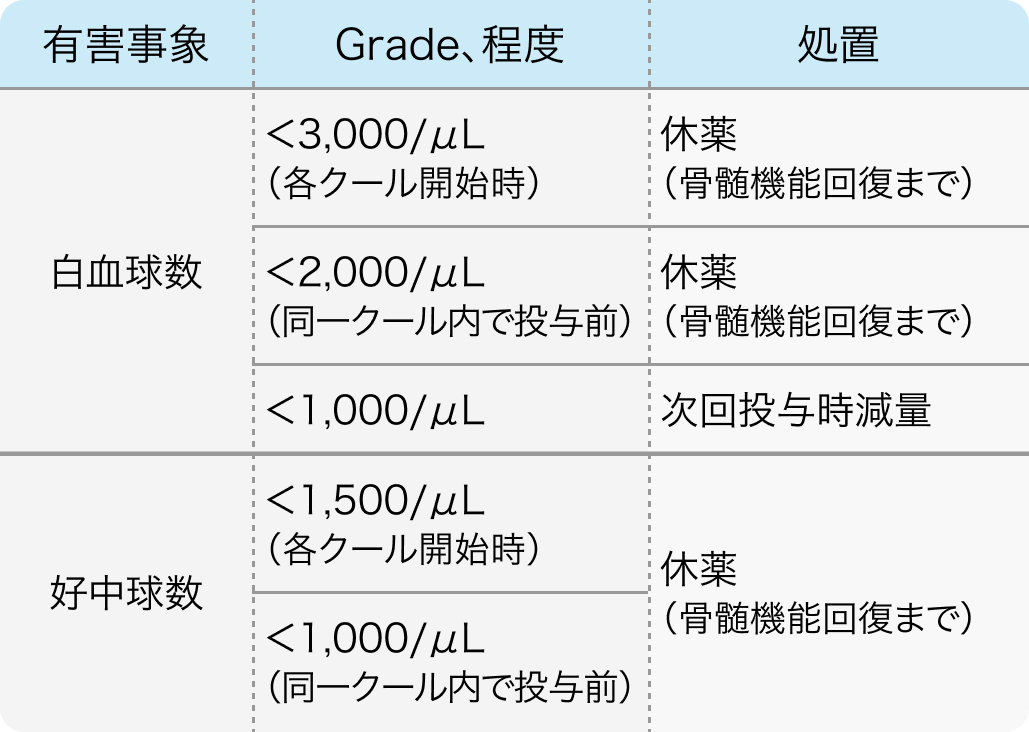
減量・休薬基準
主な有害事象
N Engl J Med. 2008 Apr 17;358(16):1663-71.¹⁾
試験の有害事象データを一部引用
主な有害事象
- 好中球減少 2%
- 発熱性好中球減少症 1%
- 倦怠感 3%
- 神経障害 (Grade3、 4 ) 8%
特徴と注意点
- 術前・術後補助化学療法では1週毎12コース投与し、 進行・再発化学療法では4週毎day1, 8, 15で投与する。
臨床では汎用される用法であるが添付文書の用法とは異なる
- 3週毎に1回投与するtri-weekly Paclitaxelレジメンと比較して、 weeklyレジメンの方が有効性が高く、かつ毒性が少ないとされる²⁾。
- パクリタキセル製剤にはアルコールが含まれ、 weeklyレジメンはおおよそビール200mLに相当するため、 投与前にアルコール過敏の有無について確認する。
- パクリタキセル製剤および溶解補助剤のポリオキシエチレンヒマシ油による過敏症予防のために、 ステロイドおよび抗アレルギー薬の前投薬を行う。
関連する臨床試験①|CALGB protocol 9840試験
転移性乳癌患者において、 パクリタキセルの週1回投与の効果を、 パクリタキセルの3週毎投与を対照に検証した第Ⅲ相無作為化比較試験CALGB protocol 9840の結果より、 奏効率と無増悪期間 (TTP) に対する有益性が示された。
奏効率
全患者
- 1W群:42%
(95%CI 37-47%)
- 3W群:29%
(95%CI 25-34%)
オッズ比 1.75 (95%CI 1.28-2.37)、 p=0.0004
HER2陰性患者 (1Wと3Wの比較)
- HER2 (-) 1W+トラスツズマブ群、 HER2 (-) 1W-トラスツズマブ群:42%
(95%CI 34-51%)
- HER2 (-) 3W+トラスツズマブ群、 HER2 (-) 3W-トラスツズマブ群:24%
(95%CI 16-34%)
オッズ比 2.28 (95%CI 1.27-4.08)、 p=0.0053
HER2陰性患者 (トラスツズマブ有無による比較)
- HER2 (-) 3W+トラスツズマブ群、 HER2 (-) 1W+トラスツズマブ群:38%
(95%CI 29-48%)
- HER2 (-) 3W-トラスツズマブ群、 HER2 (-) 1W-トラスツズマブ群:32%
(95%CI 23-41%)
オッズ比 1.35 (95%CI 0.78-2.34)、 p=0.28
HER2陽性患者 (1Wと3Wの比較)
- HER2 (+) 1W+トラスツズマブ群:55%
(95%CI 45-65%)
- HER2 (+) 3W+トラスツズマブ群:58%
(95%CI 46-69%)
オッズ比 0.89 (95%CI 0.49-1.63)、 p=0.71
TTP中央値
全患者
- 1W群:9ヵ月
- 3W群:5ヵ月
HR 1.43、 p<0.0001
HER2陰性患者 (トラスツズマブ有無による比較)
- HER2 (-) 1W+トラスツズマブ群、 HER2 (-) 3W+トラスツズマブ群:7ヵ月
- HER2 (-) 1W-トラスツズマブ群、 HER2 (-) 3W-トラスツズマブ群:6ヵ月
p=0.28
OS中央値
全患者
- 1W群:2.02年
- 3W群:1.36年
HR 1.28 (95%CI 1.06-1.54)、 p=0.0092
HER2陰性患者 (トラスツズマブ有無による比較)
- HER2 (-) 1W+トラスツズマブ群、 HER2 (-) 3W+トラスツズマブ群:1.8年
- HER2 (-) 1W-トラスツズマブ群、 HER2 (-) 3W-トラスツズマブ群:1.8年
p=0.65
関連する臨床試験②|第Ⅲ相試験
腋窩リンパ節転移陽性もしくは陰性の高リスク乳癌患者において、 ドキソルビシン (DXR) とシクロホスファミド (CPA) 後のタキサン系抗癌薬 (パクリタキセル:PTX、 ドセタキセル:DTX) を1週毎、 3週毎に投与を行う効果を検証した第Ⅲ相無作為化比較試験の結果より、 PTXの1週毎投与の無病生存期間 (DFS) および全生存期間 (OS) に対する有効性が示された。
DFS率 (5年時、 10年時)
- P3群:76.9%、 65.5%
- P1群:81.5%、 70.7%
- D3群:81.2%、 71.9%
- D1群:77.6%、67.1%
DFSのハザード比 (5年時)
P3群 vs P1群
HR 1.27 (95%CI 1.03-1.57)、 p=0.006
P3群 vs D3群
HR 1.23 (95%CI 1.00-1.52)、 p=0.02
P3群 vs D1群
HR 1.09 (95%CI 0.89-1.34)、 p=0.29
DFSのハザード比 (10年時)
P3群 vs P1群
HR 0.84 (95%CI 0.73-0.96)
P3群 vs D3群
HR 0.79 (95%CI 0.68-0.90)
P3群 vs D1群
HR 0.96 (95%CI 0.84-1.10)
OS率 (5年時、 10年時)
- P3群:86.5%、 75.3%
- P1群:89.7%、 77.7%
- D3群:87.3%、 78.5%
- D1群:86.2%、 75.9%
OSのハザード比 (5年時)
P3群 vs P1群
HR 1.32 (95%CI 1.02-1.72)、 p=0.01
P3群 vs D3群
HR 1.13 (95%CI 0.88-1.46)、 p=0.25
P3群 vs D1群
HR 1.02 (95%CI 0.80-1.32)、 p=0.80
OSのハザード比 (10年時)
P1群 vs P3群
HR 0.87 (95%CI 0.75-1.02)
D3群 vs P3群
HR 0.86 (95%CI 0.73-1.00)
D1群 vs P3群
HR 1.02 (95%CI 0.88-1.18)
ホルモン受容体、 HER2との関連
- HER2陰性例では、P1群のP3群に対するDFS(p=0.009)とOS(p=0.03)の有意な改善を認めた。
- 上記の傾向はホルモン受容体陽性/陰性にかかわらず認められた。
参考文献
- Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med. 2008 Apr 17;358(16):1663-71. PMID: 18420499
- Randomized phase III trial of weekly compared with every-3-weeks paclitaxel for metastatic breast cancer, with trastuzumab for all HER-2 overexpressors and random assignment to trastuzumab or not in HER-2 nonoverexpressors: final results of Cancer and Leukemia Group B protocol 9840. J Clin Oncol. 2008 Apr 1;26(10):1642-9. PMID: 18375893
最終更新日:2023年10月31日
監修医師:HOKUTO編集部監修医師
執筆:NTT東日本関東病院 薬剤部 兼平 暖先生
weekly Paclitaxel
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソール® (添付文書)
用法用量
N Engl J Med. 2008 Apr 17;358(16):1663-71.¹⁾より抜粋

添付文書では 「1日1回100mg/㎡ (体表面積) を1時間かけて点滴静注し、 週1回投与を6週連続し、 少なくとも2週間休薬」と記載あり
前投薬
- 過敏症予防を目的としてデキサメタゾン、 抗ヒスタミン薬 (ジフェンヒドラミン 50mg内服、 またはd-クロルフェニラミン 5mg静注) 、 H2受容体拮抗薬を投与する。
- 前投薬のデキサメタゾンは初回投与時は6.6mgとし、 次回以降は3.3mgに減量してもよい。
投与開始基準
N Engl J Med. 2008 Apr 17;358(16):1663-71.¹⁾より抜粋

減量・休薬基準

主な有害事象
N Engl J Med. 2008 Apr 17;358(16):1663-71.¹⁾
試験の有害事象データを一部引用
主な有害事象
- 好中球減少 2%
- 発熱性好中球減少症 1%
- 倦怠感 3%
- 神経障害 (Grade3、 4 ) 8%
特徴と注意点
- 術前・術後補助化学療法では1週毎12コース投与し、 進行・再発化学療法では4週毎day1, 8, 15で投与する。
臨床では汎用される用法であるが添付文書の用法とは異なる
- 3週毎に1回投与するtri-weekly Paclitaxelレジメンと比較して、 weeklyレジメンの方が有効性が高く、かつ毒性が少ないとされる²⁾。
- パクリタキセル製剤にはアルコールが含まれ、 weeklyレジメンはおおよそビール200mLに相当するため、 投与前にアルコール過敏の有無について確認する。
- パクリタキセル製剤および溶解補助剤のポリオキシエチレンヒマシ油による過敏症予防のために、 ステロイドおよび抗アレルギー薬の前投薬を行う。
関連する臨床試験①|CALGB protocol 9840試験
転移性乳癌患者において、 パクリタキセルの週1回投与の効果を、 パクリタキセルの3週毎投与を対照に検証した第Ⅲ相無作為化比較試験CALGB protocol 9840の結果より、 奏効率と無増悪期間 (TTP) に対する有益性が示された。
奏効率
全患者
- 1W群:42%
(95%CI 37-47%)
- 3W群:29%
(95%CI 25-34%)
オッズ比 1.75 (95%CI 1.28-2.37)、 p=0.0004
HER2陰性患者 (1Wと3Wの比較)
- HER2 (-) 1W+トラスツズマブ群、 HER2 (-) 1W-トラスツズマブ群:42%
(95%CI 34-51%)
- HER2 (-) 3W+トラスツズマブ群、 HER2 (-) 3W-トラスツズマブ群:24%
(95%CI 16-34%)
オッズ比 2.28 (95%CI 1.27-4.08)、 p=0.0053
HER2陰性患者 (トラスツズマブ有無による比較)
- HER2 (-) 3W+トラスツズマブ群、 HER2 (-) 1W+トラスツズマブ群:38%
(95%CI 29-48%)
- HER2 (-) 3W-トラスツズマブ群、 HER2 (-) 1W-トラスツズマブ群:32%
(95%CI 23-41%)
オッズ比 1.35 (95%CI 0.78-2.34)、 p=0.28
HER2陽性患者 (1Wと3Wの比較)
- HER2 (+) 1W+トラスツズマブ群:55%
(95%CI 45-65%)
- HER2 (+) 3W+トラスツズマブ群:58%
(95%CI 46-69%)
オッズ比 0.89 (95%CI 0.49-1.63)、 p=0.71
TTP中央値
全患者
- 1W群:9ヵ月
- 3W群:5ヵ月
HR 1.43、 p<0.0001
HER2陰性患者 (トラスツズマブ有無による比較)
- HER2 (-) 1W+トラスツズマブ群、 HER2 (-) 3W+トラスツズマブ群:7ヵ月
- HER2 (-) 1W-トラスツズマブ群、 HER2 (-) 3W-トラスツズマブ群:6ヵ月
p=0.28
OS中央値
全患者
- 1W群:2.02年
- 3W群:1.36年
HR 1.28 (95%CI 1.06-1.54)、 p=0.0092
HER2陰性患者 (トラスツズマブ有無による比較)
- HER2 (-) 1W+トラスツズマブ群、 HER2 (-) 3W+トラスツズマブ群:1.8年
- HER2 (-) 1W-トラスツズマブ群、 HER2 (-) 3W-トラスツズマブ群:1.8年
p=0.65
関連する臨床試験②|第Ⅲ相試験
腋窩リンパ節転移陽性もしくは陰性の高リスク乳癌患者において、 ドキソルビシン (DXR) とシクロホスファミド (CPA) 後のタキサン系抗癌薬 (パクリタキセル:PTX、 ドセタキセル:DTX) を1週毎、 3週毎に投与を行う効果を検証した第Ⅲ相無作為化比較試験の結果より、 PTXの1週毎投与の無病生存期間 (DFS) および全生存期間 (OS) に対する有効性が示された。
DFS率 (5年時、 10年時)
- P3群:76.9%、 65.5%
- P1群:81.5%、 70.7%
- D3群:81.2%、 71.9%
- D1群:77.6%、67.1%
DFSのハザード比 (5年時)
P3群 vs P1群
HR 1.27 (95%CI 1.03-1.57)、 p=0.006
P3群 vs D3群
HR 1.23 (95%CI 1.00-1.52)、 p=0.02
P3群 vs D1群
HR 1.09 (95%CI 0.89-1.34)、 p=0.29
DFSのハザード比 (10年時)
P3群 vs P1群
HR 0.84 (95%CI 0.73-0.96)
P3群 vs D3群
HR 0.79 (95%CI 0.68-0.90)
P3群 vs D1群
HR 0.96 (95%CI 0.84-1.10)
OS率 (5年時、 10年時)
- P3群:86.5%、 75.3%
- P1群:89.7%、 77.7%
- D3群:87.3%、 78.5%
- D1群:86.2%、 75.9%
OSのハザード比 (5年時)
P3群 vs P1群
HR 1.32 (95%CI 1.02-1.72)、 p=0.01
P3群 vs D3群
HR 1.13 (95%CI 0.88-1.46)、 p=0.25
P3群 vs D1群
HR 1.02 (95%CI 0.80-1.32)、 p=0.80
OSのハザード比 (10年時)
P1群 vs P3群
HR 0.87 (95%CI 0.75-1.02)
D3群 vs P3群
HR 0.86 (95%CI 0.73-1.00)
D1群 vs P3群
HR 1.02 (95%CI 0.88-1.18)
ホルモン受容体、 HER2との関連
- HER2陰性例では、P1群のP3群に対するDFS(p=0.009)とOS(p=0.03)の有意な改善を認めた。
- 上記の傾向はホルモン受容体陽性/陰性にかかわらず認められた。
参考文献
- Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med. 2008 Apr 17;358(16):1663-71. PMID: 18420499
- Randomized phase III trial of weekly compared with every-3-weeks paclitaxel for metastatic breast cancer, with trastuzumab for all HER-2 overexpressors and random assignment to trastuzumab or not in HER-2 nonoverexpressors: final results of Cancer and Leukemia Group B protocol 9840. J Clin Oncol. 2008 Apr 1;26(10):1642-9. PMID: 18375893
最終更新日:2023年10月31日
監修医師:HOKUTO編集部監修医師
執筆:NTT東日本関東病院 薬剤部 兼平 暖先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。