概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*エーザイ株式会社の外部サイトへ遷移します
用法用量

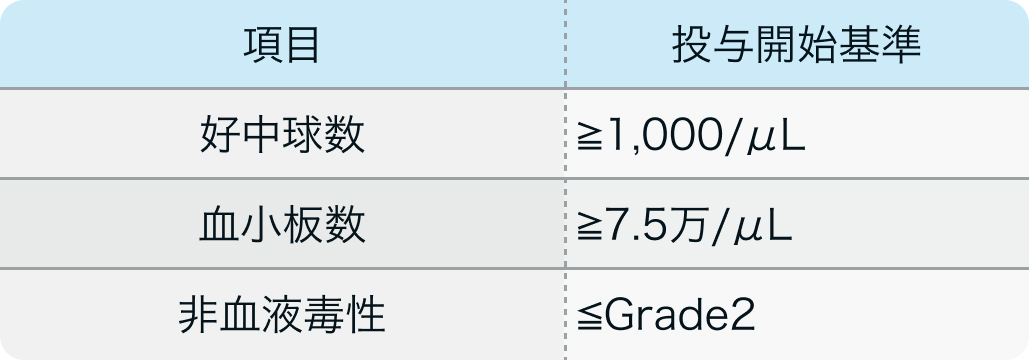
投与開始基準
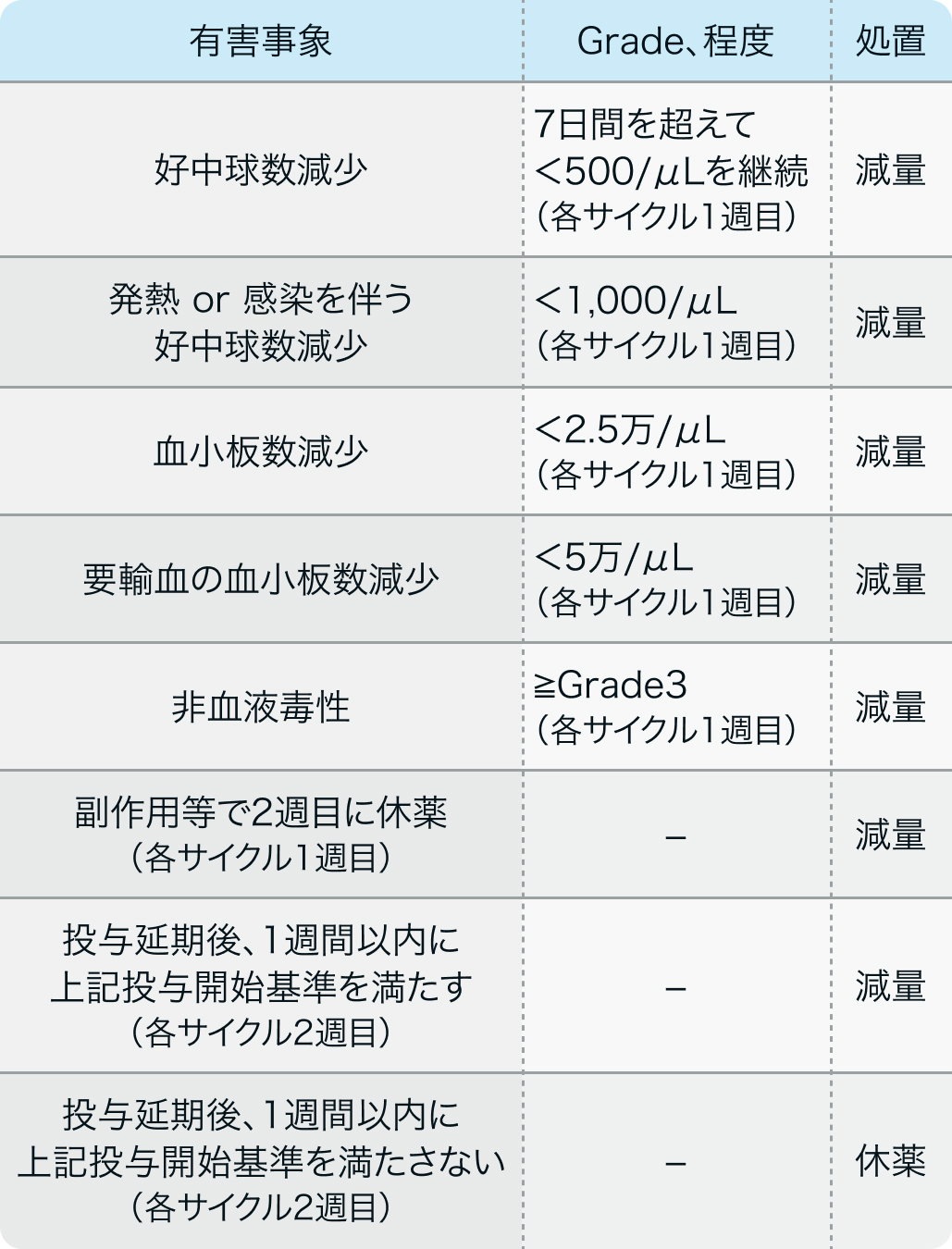
減量基準
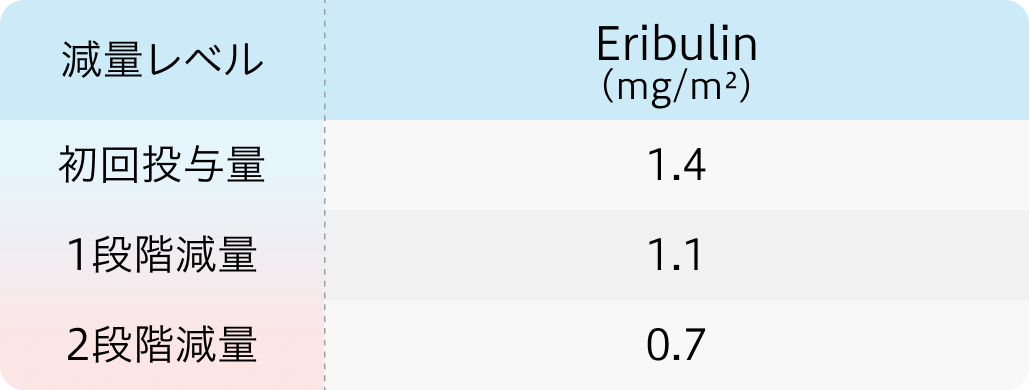
初回基準量と減量レベル
主な有害事象
EMBRACE試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 好中球減少症 51.7% (45.1%)
- 白血球数減少 23.1% (13.9%)
- 貧血 18.7% (2.0%)
- 倦怠感 53.7% (8.7%)
- 悪心 34.6% (1.2%)
- 便秘 24.7% (0.6%)
- 体重減少 21.3% (0.6%)
- 発熱 20.9% (0.2%)
- 下痢 18.3% (0%)
- 嘔吐 18.1% (1.0%)
- 粘膜炎 8.5% (1.4%)
注意すべき有害事象
- 脱毛症 44.5% (0%)
- 末梢性神経障害 34.6% (8.2%)
- 手足症候群 1.4% (0.4%)
特徴と注意点
- アンスラサイクリン系、 タキサン系薬剤既治療例の転移再発乳癌が対象。
- エリブリン投与群にて、 主治医選択治療群に比べ2.7ヵ月の全生存期間の延長が認められた (HR:0.81、 p=0.014) 。
- 投与時間は短く、 2~5分かけて静脈内投与する。
- 白血球減少、 好中球減少が特徴的な副作用。
- 発熱性好中球減少症が発現した場合、 次コースからは減量する。
- 末梢神経障害も発現することがある。
関連する臨床試験|EMBRACE試験¹⁾
前治療歴のある、 局所進行性または転移性乳癌患者において、 エリブリンメシル酸塩 (以下、 エリブリン) の効果を、 担当医による選択薬 (TPC:treatment of physician's choice) を対照に検証した第Ⅲ相ランダム化比較試験EMBRACEの結果より、 全生存期間 (OS) に対する有効性が示された。
OS中央値
- エリブリン群:13.1ヵ月
(95%CI 11.8-14.3ヵ月)
- TPC群:10.6ヵ月
(95%CI 9.3-12.5ヵ月)
HR 0.81 (95%CI 0.66-0.99)、 p=0.041
OS率 (1年時)
- エリブリン群:53.9%
- TPC群:43.7%
PFS中央値
- エリブリン群:3.7ヵ月
(95%CI 3.3-3.9ヵ月)
- TPC群:2.2ヵ月
(95%CI 2.1-3.4ヵ月)
HR 0.87 (95%CI 0.71-1.05)、 p=0.137
ORR
- エリブリン群:12%
- TPC群:5%
p=0.002
奏効期間 (中央値)
- エリブリン群:4.2ヵ月
(95%CI 3.8-5.0ヵ月)
- TPC群:6.7ヵ月
(95%CI 6.7-7.0ヵ月)
p=0.159
参考文献
最終更新日:2023年11月30日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
Eribulin
エリブリン (ハラヴェン®)
2024年03月06日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*エーザイ株式会社の外部サイトへ遷移します
用法用量

投与開始基準

減量基準

初回基準量と減量レベル

主な有害事象
EMBRACE試験¹⁾
有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 好中球減少症 51.7% (45.1%)
- 白血球数減少 23.1% (13.9%)
- 貧血 18.7% (2.0%)
- 倦怠感 53.7% (8.7%)
- 悪心 34.6% (1.2%)
- 便秘 24.7% (0.6%)
- 体重減少 21.3% (0.6%)
- 発熱 20.9% (0.2%)
- 下痢 18.3% (0%)
- 嘔吐 18.1% (1.0%)
- 粘膜炎 8.5% (1.4%)
注意すべき有害事象
- 脱毛症 44.5% (0%)
- 末梢性神経障害 34.6% (8.2%)
- 手足症候群 1.4% (0.4%)
特徴と注意点
- アンスラサイクリン系、 タキサン系薬剤既治療例の転移再発乳癌が対象。
- エリブリン投与群にて、 主治医選択治療群に比べ2.7ヵ月の全生存期間の延長が認められた (HR:0.81、 p=0.014) 。
- 投与時間は短く、 2~5分かけて静脈内投与する。
- 白血球減少、 好中球減少が特徴的な副作用。
- 発熱性好中球減少症が発現した場合、 次コースからは減量する。
- 末梢神経障害も発現することがある。
関連する臨床試験|EMBRACE試験¹⁾
前治療歴のある、 局所進行性または転移性乳癌患者において、 エリブリンメシル酸塩 (以下、 エリブリン) の効果を、 担当医による選択薬 (TPC:treatment of physician's choice) を対照に検証した第Ⅲ相ランダム化比較試験EMBRACEの結果より、 全生存期間 (OS) に対する有効性が示された。
OS中央値
- エリブリン群:13.1ヵ月
(95%CI 11.8-14.3ヵ月)
- TPC群:10.6ヵ月
(95%CI 9.3-12.5ヵ月)
HR 0.81 (95%CI 0.66-0.99)、 p=0.041
OS率 (1年時)
- エリブリン群:53.9%
- TPC群:43.7%
PFS中央値
- エリブリン群:3.7ヵ月
(95%CI 3.3-3.9ヵ月)
- TPC群:2.2ヵ月
(95%CI 2.1-3.4ヵ月)
HR 0.87 (95%CI 0.71-1.05)、 p=0.137
ORR
- エリブリン群:12%
- TPC群:5%
p=0.002
奏効期間 (中央値)
- エリブリン群:4.2ヵ月
(95%CI 3.8-5.0ヵ月)
- TPC群:6.7ヵ月
(95%CI 6.7-7.0ヵ月)
p=0.159
参考文献
最終更新日:2023年11月30日
監修医師:HOKUTO編集部監修医師
執筆:公益財団法人 がん研究会 がん研有明病院 薬剤部 平岡 知子先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(乳腺)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。