Bmab:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1 |
CPT-11:Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
l-LV:Levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
前投薬
| アプレピタント (or ホスアプレピタント、ホスネツピタント) +5-HT3拮抗薬+デキサメタゾン |
| 消化器症状の初期治療はH2拮抗薬投与を検討 |
その他
| 1コース14日間。 |
| CPT-11+L-OHP+l-LV+5-FUでFOLFOXIRIと呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬株式会社の外部サイトへ遷移します
用法用量
JACCRO CC-11試験⁷⁾のプロトコル
5-FUとIrinotecanを減量したmFOLFOXIRI (modified FOLFOXIRI) + 抗VEGF抗体 ベバシズマブ (Bevacizumab)の併用療法
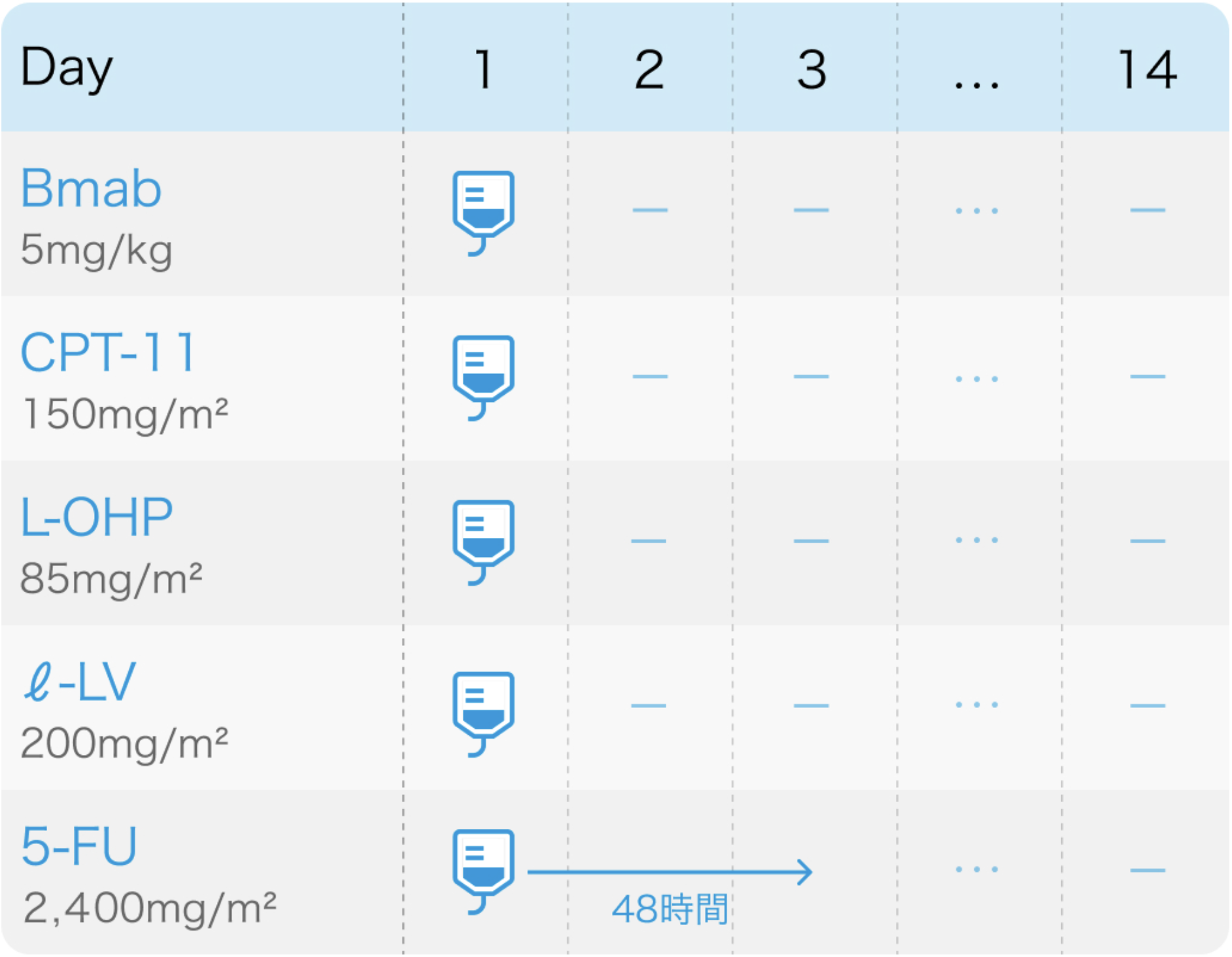
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
前投薬
アプレピタント (or ホスアプレピタント、ホスネツピタント) +5-HT3拮抗薬+デキサメタゾン
消化器症状の初期治療はH2拮抗薬投与を検討
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
JACCRO CC-11試験⁷⁾のプロトコル
治療開始前日または当日の検査値及び臨床症状が全ての基準を満たすことが必要
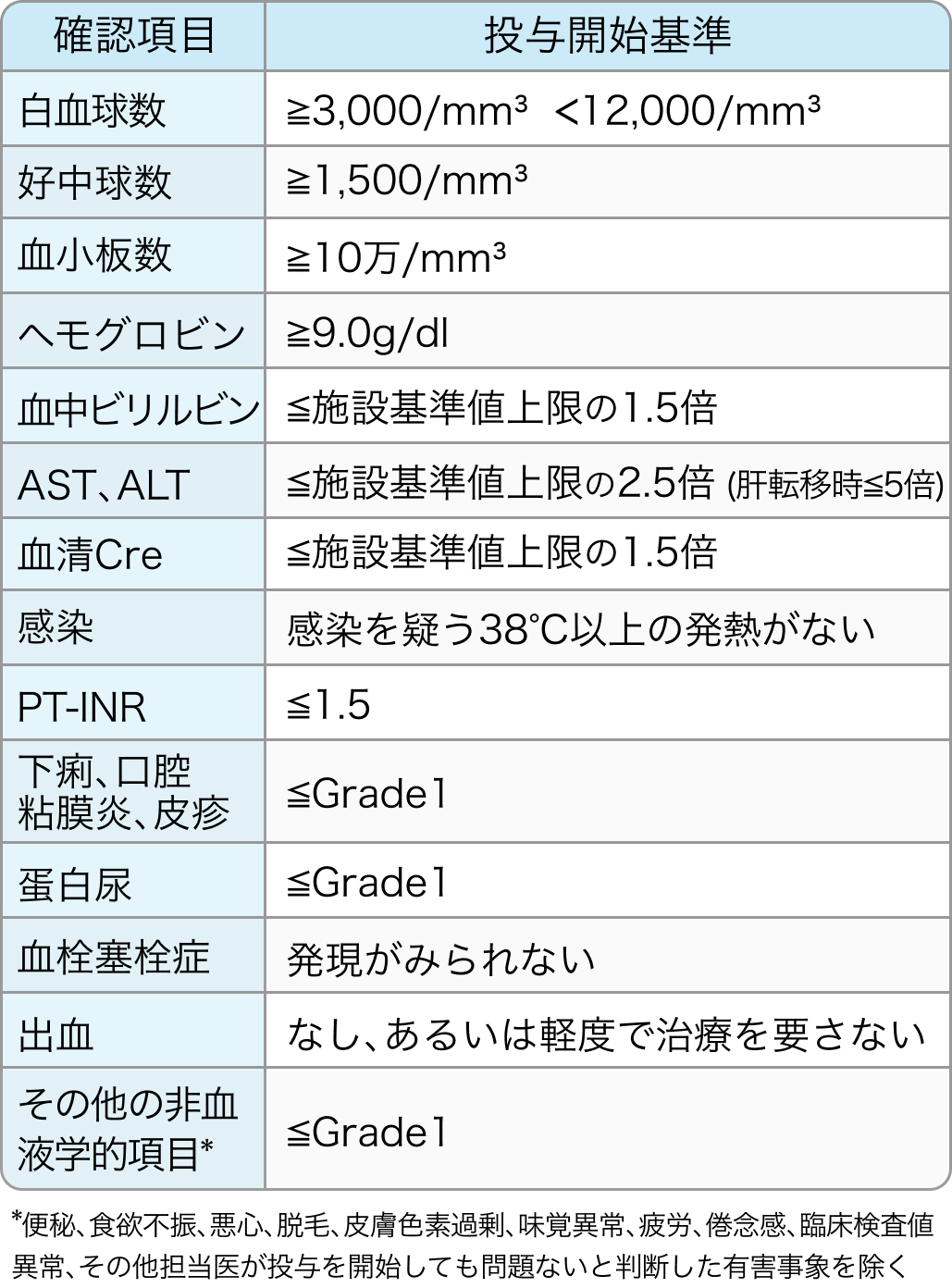
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
継続投与基準 (2~12コース)
JACCRO CC-11試験⁷⁾のプロトコル
2コース以降において、 コース開始前日または当日の検査値及び臨床症状が①mFOLFOXIRI療法継続投与基準、 ②Bmab継続投与基準を満たしていることを確認し、治療継続
①mFOLFOXIRI療法の継続投与基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
②Bmabの継続投与基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
その他の対応について
- ①を満たさないが ②を満たす場合 : mFOLFOXIRI+Bmab併用療法の投与延期 (Bmabのみの投与は行わない)
- ①は満たすが ②を満たさない場合 : mFOLFOXIRI療法の投与のみ (Bmabスキップ)
- ②に該当しない有害事象の発現で必要と判断した場合 : Bmabの投与をスキップ可能
- 投与予定日から28日を超えても①を満たさない場合 : プロトコール治療中止
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より引用
継続投与基準 (13コース以降)
JACCRO CC-11試験⁷⁾のプロトコル
13コース目以降において、 前日または当日の検査値及び臨床症状が、 ①5-FU+l-LV+Bmab併用療法継続基準ならびに②Bmab継続基準を満たしていることを確認し、 治療継続
①5-FU+l-LV併用療法継続基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820¹¹⁾より作図
②Bmab継続基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
その他の対応について
- ①を満たさないが②を満たす場合 : 5-FU+l-LV併用療法の投与延期 (Bmabのみの投与は行わない)。 その場合、 次回投与日は7日後前後 (前のコースの Day22前後) を推奨
- ①は満たすが②を満たさない場合 : 5-FU+l-LV併用療法の投与のみ (Bmabスキップ)
- ②に該当しない有害事象の発現で必要と判断した場合 : Bmabの投与をスキップ可
- 投与予定日から28日を超えても①を満たさない場合 : プロトコール治療中止
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より引用
減量基準
mFOLFOXIRI+Bmab併用療法の減量基準
JACCRO CC-11試験⁷⁾のプロトコル
mFOLFOXIRI+Bmab併用療法の減量基準に一つでも該当した場合、 「FOLFOXIRI療法の継続基準」を満たしていることを確認し、 1段階減量を実施。 なお、 減量後に再増量は行わない。 ベバシズマブの減量は行わない。

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
初回基準量と減量レベル

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
5-FU+l-LV+Bmab療法の減量基準
JACCRO CC-11試験⁷⁾のプロトコル
5-FU+l-LV+Bmab併用療法の減量基準に一つでも該当した場合、 「5-FU+l-LV+Bmab療法の継続基準」を満たしていることを確認し、 1段階減量を実施。 なお、 減量後に再増量は行わない。 ベバシズマブの減量は行わない。

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
主な有害事象
JACCRO CC-11試験⁷⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 75% (29%)
- 好中球数減少 84% (54%)
- 貧血 51% (6%)
- 血小板数減少 37% (2%)
- 悪心 74% (8%)
- 口腔粘膜炎 52% (3%)
- 下痢 73% (13%)
- 倦怠感 48% (3%)
- AST上昇 42% (0%)
- ALT上昇 49% (0%)
- 発熱性好中球減少症 5% (5%)
注意すべき有害事象 (カッコ内はGrade3~4)
- タンパク尿 49% (3%)
- 末梢性感覚ニューロパチー 91% (2%)
- 高血圧 78% (32%)
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より引用
上手に使うためのワンポイント
最初は週毎の血液検査実施を考慮
1-2コース中に好中球減少など、 血液毒性の初回出現が予想されるため。
導入化学療法の投与継続期間は8~12コース
TRIBE試験⁸⁾やQUATTRO試験⁹⁾ (原法)、 JACCRO CC-11試験⁷⁾では12コースに設定。 TRIBE2¹⁰⁾試験では8コースに設定。 また、 QUATTRO2試験 (原法) では原則8コースの設定だが、 最大12コースまで投与できるプロトコールである。
延命を目的とした場合には末梢性感覚ニューロパチー悪化を意識して8コースで終了を基本と考えたほうが良いかもしれない。
導入化学療法時に開始延期を繰り返す場合の対応
導入化学療法期間でもdoublet (2剤併用療法) へ切り替えることも選択肢の一つ。 使用理由や実際の腫瘍縮小効果にもよる。 毒性による治療延期を繰り返しDose intensityが低下するケースなどで検討。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
国内での臨床試験JACCRO CC-11
国内では70歳以下PS0-1もしくは71-75歳PS0のFitを対象としたJACCRO CC-11試験⁷⁾が行われた。 原法より有害事象は減少する一方で有効性は遜色ない結果であった。 高齢者の多い本邦では原法より使用頻度が高くなることが想定される。
遺伝子変異と治療適用
大腸癌治療ガイドライン2022年版では、RAS/RAF野生型の右側・RAS変異型・BRAF変異型において治療選択肢とされている。
複数試験の統合解析では、 BRAF変異型における有効性について、 doubletと比較してOSでは差がないもののORRとPFSでは優れる結果であるため、 病状により適用を検討する必要がある。
毒性頻度は70歳以上に多い傾向
JACCRO CC-11試験⁷⁾では、UGT1A1のステイタス毎で好中球減少・発熱性好中球減少・下痢の毒性に差を認めない結果だった。 一方で70歳未満と70歳以上の比較ではこれらの毒性頻度は70歳以上で多い傾向にあった。
高齢者の多いリアルワールドでは治療前にUGT1A1の結果が、 *6*28いずれかのホモ接合体、 もしくは両者の複合ヘテロ接合体かどうかの確認をして適用の検討し、 治療実施の際にも慎重な対応をする必要がある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|TRIBE試験⁸⁾
FOLFOXIRI+BmabとFOLFIRI+Bmabを比較した第Ⅲ相試験。 FOLFOXIRI+Bmabにおいて、 無増悪生存期間 (PFS) と奏効割合 (RR) を改善が確認された。
J Clin Oncol. 2007 May 1;25(13):1670-6.
関連する臨床試験②|TRIBE試験 up date¹¹⁾
TRIBE試験の長期フォローアップ解析結果にRAS/BRAF遺伝子変異別のサブ解析結果を加えた論文。
Lancet Oncol. 2015 Oct;16(13):1306-15.
関連する臨床試験③|TRIBE2試験¹⁰⁾
前治療歴のない切除不能な転移性大腸癌 (mCRC) 患者において、 殺細胞性抗癌剤の3剤併用レジメン (FOLFOXIRI+ベバシズマブ→病勢進行後に同レジメンを繰り返す) の効果を、 2剤併用レジメンの逐次投与 (FOLFOX+ベバシズマブ→病勢進行後にFOLFIRI+ベバシズマブ) を対照に検証した第Ⅲ相ランダム化比較試験TRIBE2の結果より、 3剤併用レジメンの有効性が示された。
PFS2中央値
- 実験群 : 19.2ヵ月
(95%CI 17.3-21.4ヵ月)
- 対照群 : 16.4ヵ月
(95%CI 15.1-17.5ヵ月)
HR 0.74 (95%CI 0.63-0.88)、 p=0.0005
PFS1中央値
- 実験群 : 12.0ヵ月
(95%CI 11.1-12.9ヵ月)
- 対照群 : 9.8ヵ月
(95%CI 9.0-10.5ヵ月)
HR 0.74 (95%CI 0.63-0.88)、 p=0.0002
2次治療PFS中央値
- 実験群 : 6.2ヵ月
(95%CI 5.6-6.6ヵ月)
- 対照群 : 5.6ヵ月
(95%CI 4.9-6.4ヵ月)
HR 0.87 (95%CI 0.73-1.04)、 p=0.11
ORR
- 実験群 : 62%
- 対照群 : 50%
オッズ比 1.61 (95%CI 1.19-2.18)、 p=0.0023
転移巣に対するR0切除
- 実験群 : 17%
- 対照群 : 12%
オッズ比 1.55 (95%CI 1.00-2.39)、 p=0.047
OS中央値
- 実験群 : 27.4ヵ月
(95%CI 23.7-30.0ヵ月)
- 対照群 : 22.5ヵ月
(95%CI 20.7-24.8ヵ月)
HR 0.82 (95%CI 0.68-0.98)、 p=0.032
関連する臨床試験④|JACCRO CC-11試験⁷⁾
RAS変異型の転移性大腸癌 (mCRC) 患者の1次治療における、 ベバシズマブ (Bmab) +modified FOLFOXIRI (mFOLFOXIRI) の併用療法の有効性と安全性を検証した単群コホートの第Ⅱ相試験JACCRO CC-11の結果より、Bmab+mFOLFOXIRI併用療法がRAS変異型のmCRCに対して有効であることが示された。
ORR
75.8%
(95%CI 65.1-86.5%)
原発占拠部位によるORR
左側原発 (82.2%) が右側原発 (58.8%) よりORRが高かった。
病勢コントロール率
96.8%
(95%CI 92.4-100%)
PFS中央値
12.1ヵ月
(95%CI 9.86-14.0ヵ月)
OS中央値
30.2ヵ月
(95%CI 25.8-34.7ヵ月)
ETS
73.8%の症例で認め、 中央値22週で得られた。
DpR中央値
49.2%
出典
- アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/6/15]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/5/10]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/04/15]
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/07/12]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/04/17]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/04/17]
- A phase II trial of 1st-line modified-FOLFOXIRI plus bevacizumab treatment for metastatic colorectal cancer harboring RAS mutation: JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820. PMID: 29721163
- Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol. 2007 May 1;25(13):1670-6. PMID: 17470860
- A Multicenter Clinical Phase II Study of FOLFOXIRI Plus Bevacizumab as First-line Therapy in Patients With Metastatic Colorectal Cancer: QUATTRO Study. Clin Colorectal Cancer. 2018 Jun;17(2):147-155. PMID: 29530335
- Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer (TRIBE2): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol. 2020 Apr;21(4):497-507. PMID: 32164906
- FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol. 2015 Oct;16(13):1306-15. PMID: 26338525
最終更新日 : 2024年7月12日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
mFOLFOXIRI + Bmab
Bmab:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 5mg/kg 点滴 | 1~ | Day1 |
CPT-11:Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
l-LV:Levofolinate(アイソボリン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg/m² 点滴 | 1~ | Day1 |
L-OHP:Oxaliplatin(エルプラット®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 85mg/m² 点滴 | 1~ | Day1 |
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 2400mg/m² 持続静注 | 1~ | Day1~3 |
前投薬
| アプレピタント (or ホスアプレピタント、ホスネツピタント) +5-HT3拮抗薬+デキサメタゾン |
| 消化器症状の初期治療はH2拮抗薬投与を検討 |
その他
| 1コース14日間。 |
| CPT-11+L-OHP+l-LV+5-FUでFOLFOXIRIと呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*中外製薬株式会社の外部サイトへ遷移します
用法用量
JACCRO CC-11試験⁷⁾のプロトコル
5-FUとIrinotecanを減量したmFOLFOXIRI (modified FOLFOXIRI) + 抗VEGF抗体 ベバシズマブ (Bevacizumab)の併用療法

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
前投薬
アプレピタント (or ホスアプレピタント、ホスネツピタント) +5-HT3拮抗薬+デキサメタゾン
消化器症状の初期治療はH2拮抗薬投与を検討
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
投与開始基準
JACCRO CC-11試験⁷⁾のプロトコル
治療開始前日または当日の検査値及び臨床症状が全ての基準を満たすことが必要

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
継続投与基準 (2~12コース)
JACCRO CC-11試験⁷⁾のプロトコル
2コース以降において、 コース開始前日または当日の検査値及び臨床症状が①mFOLFOXIRI療法継続投与基準、 ②Bmab継続投与基準を満たしていることを確認し、治療継続
①mFOLFOXIRI療法の継続投与基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
②Bmabの継続投与基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
その他の対応について
- ①を満たさないが ②を満たす場合 : mFOLFOXIRI+Bmab併用療法の投与延期 (Bmabのみの投与は行わない)
- ①は満たすが ②を満たさない場合 : mFOLFOXIRI療法の投与のみ (Bmabスキップ)
- ②に該当しない有害事象の発現で必要と判断した場合 : Bmabの投与をスキップ可能
- 投与予定日から28日を超えても①を満たさない場合 : プロトコール治療中止
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より引用
継続投与基準 (13コース以降)
JACCRO CC-11試験⁷⁾のプロトコル
13コース目以降において、 前日または当日の検査値及び臨床症状が、 ①5-FU+l-LV+Bmab併用療法継続基準ならびに②Bmab継続基準を満たしていることを確認し、 治療継続
①5-FU+l-LV併用療法継続基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820¹¹⁾より作図
②Bmab継続基準

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
その他の対応について
- ①を満たさないが②を満たす場合 : 5-FU+l-LV併用療法の投与延期 (Bmabのみの投与は行わない)。 その場合、 次回投与日は7日後前後 (前のコースの Day22前後) を推奨
- ①は満たすが②を満たさない場合 : 5-FU+l-LV併用療法の投与のみ (Bmabスキップ)
- ②に該当しない有害事象の発現で必要と判断した場合 : Bmabの投与をスキップ可
- 投与予定日から28日を超えても①を満たさない場合 : プロトコール治療中止
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より引用
減量基準
mFOLFOXIRI+Bmab併用療法の減量基準
JACCRO CC-11試験⁷⁾のプロトコル
mFOLFOXIRI+Bmab併用療法の減量基準に一つでも該当した場合、 「FOLFOXIRI療法の継続基準」を満たしていることを確認し、 1段階減量を実施。 なお、 減量後に再増量は行わない。 ベバシズマブの減量は行わない。

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
初回基準量と減量レベル

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
5-FU+l-LV+Bmab療法の減量基準
JACCRO CC-11試験⁷⁾のプロトコル
5-FU+l-LV+Bmab併用療法の減量基準に一つでも該当した場合、 「5-FU+l-LV+Bmab療法の継続基準」を満たしていることを確認し、 1段階減量を実施。 なお、 減量後に再増量は行わない。 ベバシズマブの減量は行わない。

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図

JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より作図
主な有害事象
JACCRO CC-11試験⁷⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 75% (29%)
- 好中球数減少 84% (54%)
- 貧血 51% (6%)
- 血小板数減少 37% (2%)
- 悪心 74% (8%)
- 口腔粘膜炎 52% (3%)
- 下痢 73% (13%)
- 倦怠感 48% (3%)
- AST上昇 42% (0%)
- ALT上昇 49% (0%)
- 発熱性好中球減少症 5% (5%)
注意すべき有害事象 (カッコ内はGrade3~4)
- タンパク尿 49% (3%)
- 末梢性感覚ニューロパチー 91% (2%)
- 高血圧 78% (32%)
JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820⁷⁾より引用
上手に使うためのワンポイント
最初は週毎の血液検査実施を考慮
1-2コース中に好中球減少など、 血液毒性の初回出現が予想されるため。
導入化学療法の投与継続期間は8~12コース
TRIBE試験⁸⁾やQUATTRO試験⁹⁾ (原法)、 JACCRO CC-11試験⁷⁾では12コースに設定。 TRIBE2¹⁰⁾試験では8コースに設定。 また、 QUATTRO2試験 (原法) では原則8コースの設定だが、 最大12コースまで投与できるプロトコールである。
延命を目的とした場合には末梢性感覚ニューロパチー悪化を意識して8コースで終了を基本と考えたほうが良いかもしれない。
導入化学療法時に開始延期を繰り返す場合の対応
導入化学療法期間でもdoublet (2剤併用療法) へ切り替えることも選択肢の一つ。 使用理由や実際の腫瘍縮小効果にもよる。 毒性による治療延期を繰り返しDose intensityが低下するケースなどで検討。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
特徴と注意点
国内での臨床試験JACCRO CC-11
国内では70歳以下PS0-1もしくは71-75歳PS0のFitを対象としたJACCRO CC-11試験⁷⁾が行われた。 原法より有害事象は減少する一方で有効性は遜色ない結果であった。 高齢者の多い本邦では原法より使用頻度が高くなることが想定される。
遺伝子変異と治療適用
大腸癌治療ガイドライン2022年版では、RAS/RAF野生型の右側・RAS変異型・BRAF変異型において治療選択肢とされている。
複数試験の統合解析では、 BRAF変異型における有効性について、 doubletと比較してOSでは差がないもののORRとPFSでは優れる結果であるため、 病状により適用を検討する必要がある。
毒性頻度は70歳以上に多い傾向
JACCRO CC-11試験⁷⁾では、UGT1A1のステイタス毎で好中球減少・発熱性好中球減少・下痢の毒性に差を認めない結果だった。 一方で70歳未満と70歳以上の比較ではこれらの毒性頻度は70歳以上で多い傾向にあった。
高齢者の多いリアルワールドでは治療前にUGT1A1の結果が、 *6*28いずれかのホモ接合体、 もしくは両者の複合ヘテロ接合体かどうかの確認をして適用の検討し、 治療実施の際にも慎重な対応をする必要がある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験①|TRIBE試験⁸⁾
FOLFOXIRI+BmabとFOLFIRI+Bmabを比較した第Ⅲ相試験。 FOLFOXIRI+Bmabにおいて、 無増悪生存期間 (PFS) と奏効割合 (RR) を改善が確認された。
J Clin Oncol. 2007 May 1;25(13):1670-6.
関連する臨床試験②|TRIBE試験 up date¹¹⁾
TRIBE試験の長期フォローアップ解析結果にRAS/BRAF遺伝子変異別のサブ解析結果を加えた論文。
Lancet Oncol. 2015 Oct;16(13):1306-15.
関連する臨床試験③|TRIBE2試験¹⁰⁾
前治療歴のない切除不能な転移性大腸癌 (mCRC) 患者において、 殺細胞性抗癌剤の3剤併用レジメン (FOLFOXIRI+ベバシズマブ→病勢進行後に同レジメンを繰り返す) の効果を、 2剤併用レジメンの逐次投与 (FOLFOX+ベバシズマブ→病勢進行後にFOLFIRI+ベバシズマブ) を対照に検証した第Ⅲ相ランダム化比較試験TRIBE2の結果より、 3剤併用レジメンの有効性が示された。
PFS2中央値
- 実験群 : 19.2ヵ月
(95%CI 17.3-21.4ヵ月)
- 対照群 : 16.4ヵ月
(95%CI 15.1-17.5ヵ月)
HR 0.74 (95%CI 0.63-0.88)、 p=0.0005
PFS1中央値
- 実験群 : 12.0ヵ月
(95%CI 11.1-12.9ヵ月)
- 対照群 : 9.8ヵ月
(95%CI 9.0-10.5ヵ月)
HR 0.74 (95%CI 0.63-0.88)、 p=0.0002
2次治療PFS中央値
- 実験群 : 6.2ヵ月
(95%CI 5.6-6.6ヵ月)
- 対照群 : 5.6ヵ月
(95%CI 4.9-6.4ヵ月)
HR 0.87 (95%CI 0.73-1.04)、 p=0.11
ORR
- 実験群 : 62%
- 対照群 : 50%
オッズ比 1.61 (95%CI 1.19-2.18)、 p=0.0023
転移巣に対するR0切除
- 実験群 : 17%
- 対照群 : 12%
オッズ比 1.55 (95%CI 1.00-2.39)、 p=0.047
OS中央値
- 実験群 : 27.4ヵ月
(95%CI 23.7-30.0ヵ月)
- 対照群 : 22.5ヵ月
(95%CI 20.7-24.8ヵ月)
HR 0.82 (95%CI 0.68-0.98)、 p=0.032
関連する臨床試験④|JACCRO CC-11試験⁷⁾
RAS変異型の転移性大腸癌 (mCRC) 患者の1次治療における、 ベバシズマブ (Bmab) +modified FOLFOXIRI (mFOLFOXIRI) の併用療法の有効性と安全性を検証した単群コホートの第Ⅱ相試験JACCRO CC-11の結果より、Bmab+mFOLFOXIRI併用療法がRAS変異型のmCRCに対して有効であることが示された。
ORR
75.8%
(95%CI 65.1-86.5%)
原発占拠部位によるORR
左側原発 (82.2%) が右側原発 (58.8%) よりORRが高かった。
病勢コントロール率
96.8%
(95%CI 92.4-100%)
PFS中央値
12.1ヵ月
(95%CI 9.86-14.0ヵ月)
OS中央値
30.2ヵ月
(95%CI 25.8-34.7ヵ月)
ETS
73.8%の症例で認め、 中央値22週で得られた。
DpR中央値
49.2%
出典
- アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/6/15]
- ヤクルト本社. エルプラット®電子添文 (2024年4月改訂 第4版) [最終閲覧 : 2024/5/10]
- ファイザー・ファーマ株式会社. アイソボリン®電子添文 (2023年3月改訂 第1版) [最終閲覧 : 2024/04/15]
- 協和キリン株式会社. 5-FU®電子添文 (2024年6月改訂 第4版) [最終閲覧 : 2024/07/12]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/04/17]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2023年11月改訂) [最終閲覧 : 2024/04/17]
- A phase II trial of 1st-line modified-FOLFOXIRI plus bevacizumab treatment for metastatic colorectal cancer harboring RAS mutation: JACCRO CC-11. Oncotarget. 2018 Apr 10;9(27):18811-18820. PMID: 29721163
- Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol. 2007 May 1;25(13):1670-6. PMID: 17470860
- A Multicenter Clinical Phase II Study of FOLFOXIRI Plus Bevacizumab as First-line Therapy in Patients With Metastatic Colorectal Cancer: QUATTRO Study. Clin Colorectal Cancer. 2018 Jun;17(2):147-155. PMID: 29530335
- Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer (TRIBE2): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol. 2020 Apr;21(4):497-507. PMID: 32164906
- FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol. 2015 Oct;16(13):1306-15. PMID: 26338525
最終更新日 : 2024年7月12日
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

