5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 700mg/m² 点滴 | 1~ | Day1~4 |
CDDP:Cisplatin(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
前投薬
| パロノセトロン0.75mg day1 点滴、 デキサメタゾン 9.9mg day1、6.6mg day2-4 点滴、 アプレピタント 125mg day1、 80mg day2-3、 オランザピン 5mg day1-4 経口 (糖尿病がない場合のみ) |
その他
| 1コース28日間。 |
| 5-FU+CDDPをFP療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本化薬の外部サイトへ遷移します
用法用量
JCOG9708試験⁴⁾のプロトコル

Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾より作図
電子添文の用法および用量
シスプラチン : B法を標準的用法・用量とし、 患者の状態によりA法を選択する。 A法 : 15~20mg/m²を1日1回、 5日間連続投与し、 少なくとも2週間休薬する。 これを1クールとし、 投与を繰り返す。 B法 : 50~70mg/m²を1日1回投与し、 少なくとも3週間休薬する。 これを1クールとし、 投与を繰り返す。
ランダ®電子添文 (2021年4月改訂 第1版)²⁾ より引用
フルオロウラシル : 1日1000mg/m²までを、 4~5日間連日で持続点滴する。 投与を繰り返す場合には少なくとも3週間以上の間隔をあけて投与する。
5-FU®電子添文 (2024年3月改訂 第3版)¹⁾より引用
前投薬
HECレジメンとして扱う。
- パロノセトロン0.75mg day1 点滴
- デキサメタゾン 9.9mg day1、 6.6mg day2-4 点滴
- アプレピタント 125mg day1、 80mg day2-3
ホスアプレピタント150mg day1 点滴、 ホスネツピタント 235㎎ day1 点滴でも可
- オランザピン 5mg day1-4 経口 (糖尿病がない場合のみ)
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
投与開始基準
JCOG9708試験⁴⁾のプロトコル
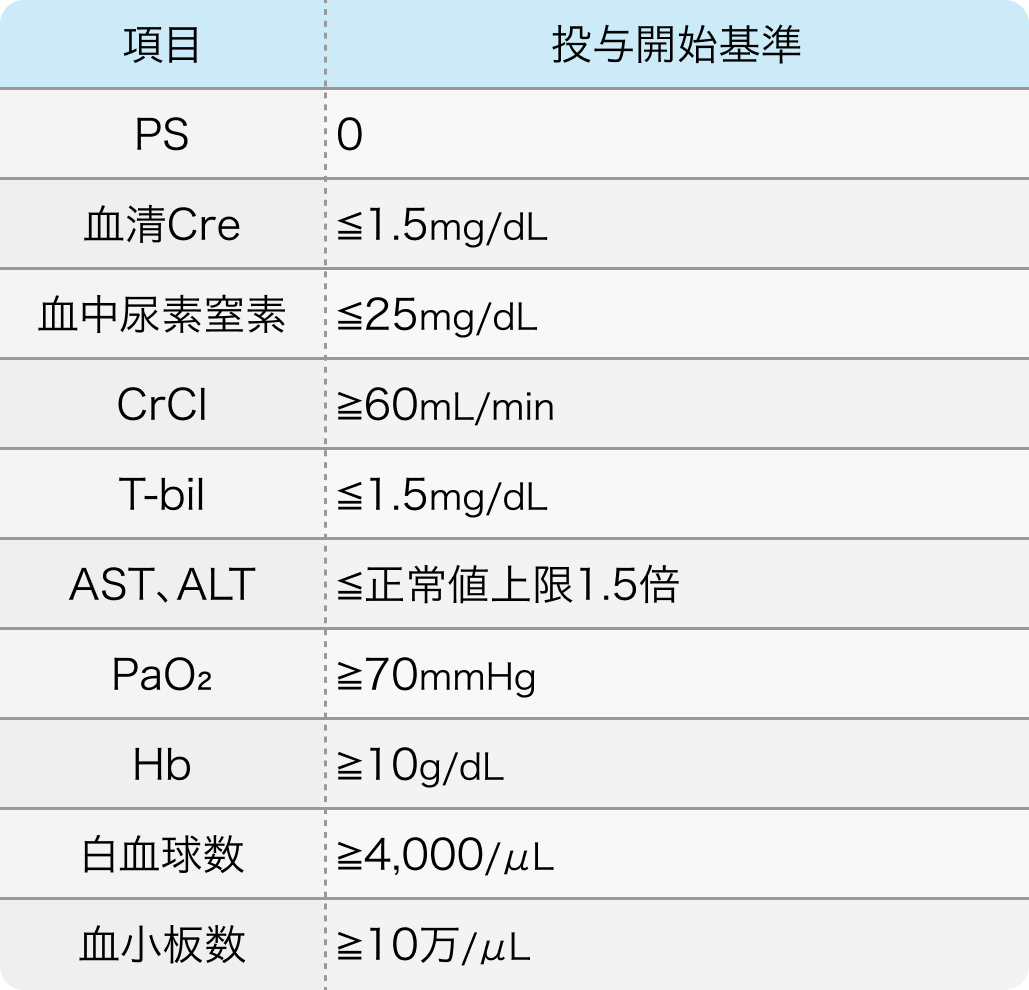
Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾より作図
主な有害事象
JCOG9708試験⁴⁾
主な有害事象(カッコ内はGrade3~4)
- 白血球減少 95.8% (8.3%)
- 好中球数減少 73.6% (2.8%)
- Hb減少 34.7% (0%)
- 血小板減少 23.6% (1.4%)
- T-bil上昇 30.6% (0%)
- AST増加 34.7% (1.4%)
- ALT増加 41.7% (1.4%)
- 悪心/嘔吐 56.9% (0%)
- 口内炎 27.8% (0%)
- 下痢 19.4% (0%)
- 発熱 6.9% (0%)
- 便秘 8.3% (0%)
注意すべき有害事象
- 脱毛症 15.3% (0%)
Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾より引用
上手に使うためのワンポイント
他のレジメンとの使い分け
FP+RT (60Gy) 療法の対象は①手術を希望しないcT1bN0M0 cStageIの表在食道癌症例、 ②原発巣の気管や大動脈といった他臓器浸潤を認めるT4、 もしくはUICC第5版での遠隔リンパ節転移 (M1LYM) に該当する鎖骨上リンパ節転移もしくは腹腔動脈周囲リンパ節隔転移を認める局所進行例が対象となる。
cStageII/IIIはFP+RT50.4Gyとなり、 FPのdoseや照射量が異なる。 シスプラチン不耐例はFOLFOX+RT療法もしくはRT単独療法が選択肢となる。
腎機能について
シスプラチンの腎機能による投与量についてはCrClを参考に決定する。 Cockcroft-Gault式を用いて計算し、 CrCl≧60mL/minでは100%投与量、 50-60mL/minでは1段階減量、 40-50mL/minでは2段階減量とする。 Cockcroft-Gault式では高齢者や女性で推定値が実測値より低値となりやすいため、 血中クレアチニン値のわりにCrClが低い症例については畜尿により実測値を用いてCrClを測定する。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- 初回効果判定はFP2コースもしくはRT終了してから4-6週を目途に内視鏡およびCTで効果判定を行う。 これ以上早期に行っても食道炎が強いため評価困難の場合が多く効果判定の時期には注意が必要である。 また内視鏡検査では初回判定は必ず生検を行い、 組織学的に陰性であることを確認する。 CRは内視鏡上食道炎が瘢痕化してから判定する。
- cT1bN0M0 cStageIであれば2コースのFPおよび放射線治療で治療は終了となりフォローアップとなるが、 T4/M1リンパ節症例であれば初回効果判定で著明に縮小、 もしくはCRが見込まれる場合にFPを2コース追加する。 追加FPの投与量はFU800mg/m² Day1-5、 シスプラチン 80mg/m² Day1と放射線併用時と投与量および投与期間が異なるため注意が必要である。
- フォローアップは追加FP後CRであれば治療開始してから最初の2年は3ヵ月毎を目安にCTと内視鏡でフォローを行う。 以降は半年ずつ5年目経過するまでフォローアップを行う。
- 遺残がある場合や再発した場合はサルベージ手術やサルベージESDを検討する。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験
JCOG9708試験⁴⁾
ステージIの食道扁平上皮癌 (ESCC) 患者における5-フルオロウラシル (5-FU) とシスプラチンによる化学放射線療法の有効性と毒性を評価するための第II相試験。 主要評価項目は完全奏効率 (CR) とされた。
Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年3月改訂 第3版) [最終閲覧 : 2024/04/15]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/04/02]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/04/02]
- A phase II trial of chemoradiotherapy for stage I esophageal squamous cell carcinoma: Japan Clinical Oncology Group Study (JCOG9708). Jpn J Clin Oncol. 2009 Oct;39(10):638-43. PMID: 19549720
最終更新日 : 2024年7月17日
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
FP + RT(60Gy)
5-FU:Fluorouracil(5-FU®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 700mg/m² 点滴 | 1~ | Day1~4 |
CDDP:Cisplatin(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 70mg/m² 点滴 | 1~ | Day1 |
前投薬
| パロノセトロン0.75mg day1 点滴、 デキサメタゾン 9.9mg day1、6.6mg day2-4 点滴、 アプレピタント 125mg day1、 80mg day2-3、 オランザピン 5mg day1-4 経口 (糖尿病がない場合のみ) |
その他
| 1コース28日間。 |
| 5-FU+CDDPをFP療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本化薬の外部サイトへ遷移します
用法用量
JCOG9708試験⁴⁾のプロトコル

Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾より作図
電子添文の用法および用量
シスプラチン : B法を標準的用法・用量とし、 患者の状態によりA法を選択する。 A法 : 15~20mg/m²を1日1回、 5日間連続投与し、 少なくとも2週間休薬する。 これを1クールとし、 投与を繰り返す。 B法 : 50~70mg/m²を1日1回投与し、 少なくとも3週間休薬する。 これを1クールとし、 投与を繰り返す。
ランダ®電子添文 (2021年4月改訂 第1版)²⁾ より引用
フルオロウラシル : 1日1000mg/m²までを、 4~5日間連日で持続点滴する。 投与を繰り返す場合には少なくとも3週間以上の間隔をあけて投与する。
5-FU®電子添文 (2024年3月改訂 第3版)¹⁾より引用
前投薬
HECレジメンとして扱う。
- パロノセトロン0.75mg day1 点滴
- デキサメタゾン 9.9mg day1、 6.6mg day2-4 点滴
- アプレピタント 125mg day1、 80mg day2-3
ホスアプレピタント150mg day1 点滴、 ホスネツピタント 235㎎ day1 点滴でも可
- オランザピン 5mg day1-4 経口 (糖尿病がない場合のみ)
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
投与開始基準
JCOG9708試験⁴⁾のプロトコル

Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾より作図
主な有害事象
JCOG9708試験⁴⁾
主な有害事象(カッコ内はGrade3~4)
- 白血球減少 95.8% (8.3%)
- 好中球数減少 73.6% (2.8%)
- Hb減少 34.7% (0%)
- 血小板減少 23.6% (1.4%)
- T-bil上昇 30.6% (0%)
- AST増加 34.7% (1.4%)
- ALT増加 41.7% (1.4%)
- 悪心/嘔吐 56.9% (0%)
- 口内炎 27.8% (0%)
- 下痢 19.4% (0%)
- 発熱 6.9% (0%)
- 便秘 8.3% (0%)
注意すべき有害事象
- 脱毛症 15.3% (0%)
Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾より引用
上手に使うためのワンポイント
他のレジメンとの使い分け
FP+RT (60Gy) 療法の対象は①手術を希望しないcT1bN0M0 cStageIの表在食道癌症例、 ②原発巣の気管や大動脈といった他臓器浸潤を認めるT4、 もしくはUICC第5版での遠隔リンパ節転移 (M1LYM) に該当する鎖骨上リンパ節転移もしくは腹腔動脈周囲リンパ節隔転移を認める局所進行例が対象となる。
cStageII/IIIはFP+RT50.4Gyとなり、 FPのdoseや照射量が異なる。 シスプラチン不耐例はFOLFOX+RT療法もしくはRT単独療法が選択肢となる。
腎機能について
シスプラチンの腎機能による投与量についてはCrClを参考に決定する。 Cockcroft-Gault式を用いて計算し、 CrCl≧60mL/minでは100%投与量、 50-60mL/minでは1段階減量、 40-50mL/minでは2段階減量とする。 Cockcroft-Gault式では高齢者や女性で推定値が実測値より低値となりやすいため、 血中クレアチニン値のわりにCrClが低い症例については畜尿により実測値を用いてCrClを測定する。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- 初回効果判定はFP2コースもしくはRT終了してから4-6週を目途に内視鏡およびCTで効果判定を行う。 これ以上早期に行っても食道炎が強いため評価困難の場合が多く効果判定の時期には注意が必要である。 また内視鏡検査では初回判定は必ず生検を行い、 組織学的に陰性であることを確認する。 CRは内視鏡上食道炎が瘢痕化してから判定する。
- cT1bN0M0 cStageIであれば2コースのFPおよび放射線治療で治療は終了となりフォローアップとなるが、 T4/M1リンパ節症例であれば初回効果判定で著明に縮小、 もしくはCRが見込まれる場合にFPを2コース追加する。 追加FPの投与量はFU800mg/m² Day1-5、 シスプラチン 80mg/m² Day1と放射線併用時と投与量および投与期間が異なるため注意が必要である。
- フォローアップは追加FP後CRであれば治療開始してから最初の2年は3ヵ月毎を目安にCTと内視鏡でフォローを行う。 以降は半年ずつ5年目経過するまでフォローアップを行う。
- 遺残がある場合や再発した場合はサルベージ手術やサルベージESDを検討する。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験
JCOG9708試験⁴⁾
ステージIの食道扁平上皮癌 (ESCC) 患者における5-フルオロウラシル (5-FU) とシスプラチンによる化学放射線療法の有効性と毒性を評価するための第II相試験。 主要評価項目は完全奏効率 (CR) とされた。
Jpn J Clin Oncol. 2009 Oct;39(10):638-43.⁴⁾
出典
- 協和キリン株式会社. 5-FU®電子添文 (2024年3月改訂 第3版) [最終閲覧 : 2024/04/15]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/04/02]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/04/02]
- A phase II trial of chemoradiotherapy for stage I esophageal squamous cell carcinoma: Japan Clinical Oncology Group Study (JCOG9708). Jpn J Clin Oncol. 2009 Oct;39(10):638-43. PMID: 19549720
最終更新日 : 2024年7月17日
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
