本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ヒト型抗ヒトPD-1モノクローナル抗体 ペムブロリズマブ
*「MSD株式会社」の外部サイトへ遷移します。
投与スケジュール
【1コース】21日 or 42日
【催吐性】 最小度催吐性
【FN発症】低リスク
1コース21日間 (3週間ごと投与の場合)
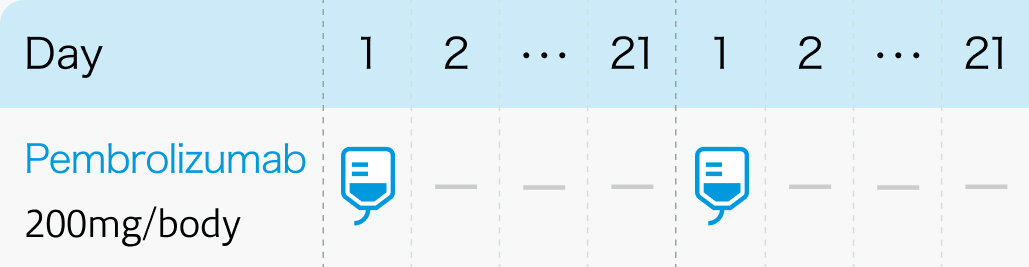
1コース42日間 (6週間ごと投与の場合)
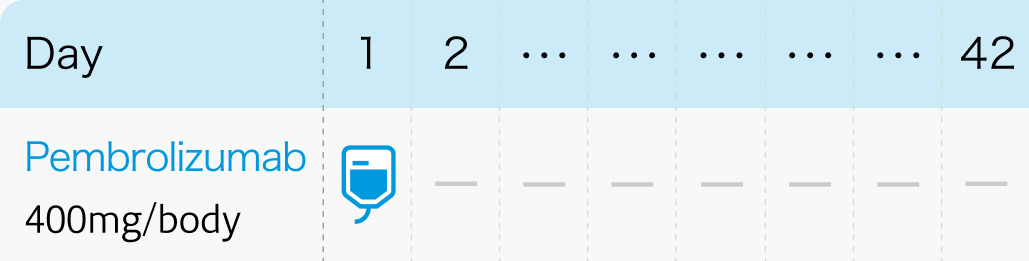
キイトルーダ®添付文書¹⁾より引用
KeyData|臨床試験結果
📊 KEYNOTE-024試験³⁾⁴⁾
化学療法未治療のEGFR遺伝子変異/ALK融合遺伝子陰性かつPD-L1高発現 (TPS≧50%) の進行・再発のNSCLC患者305例 (国内40例)を対象に、 ペムブロリズマブ200mg3週ごと投与の有効性と安全性を化学療法群と比較した国際共同ランダム化非盲検第Ⅲ相試験
【有効性】ペムブロリズマブ群 (TPS≧50%)
- mPFS : 10.3ヵ月 [主要評価項目]
- mOS :未到達
- ORR : 44.8%
【安全性】主な有害事象
- 下痢 (16.2%、≧Grade3 3.9%)
- 疲労 (14.3%、≧Grade3 1.9%)
- 甲状腺機能低下症 (10.4%、≧Grade3 N.D)
- 肺臓炎 (8.4%、≧Grade3 3.2%)
- 甲状腺機能亢進症 (7.1%、≧Grade3 N.D)
休薬・中止基準の設定された有害事象
- 間質性肺疾患 - 大腸炎/下痢
- 肝機能障害 - 腎機能障害
- 内分泌障害 - Infusion reaction
日本人で発現割合が外国人より10%以上高かった有害事象
- 口内炎 (日本人 : 19.0%)
- 倦怠感 (日本人 : 14.3%)
- 発熱 (日本人 : 33.3%)
- 発疹 (日本人 : 14.3%)
📊 KEYNOTE-042試験⁵⁾
化学療法未治療のEGFR遺伝子変異/ALK融合遺伝子陰性かつPD-L1高発現 (TPS≧1%) の進行・再発のNSCLC患者1274例 (国内93例) を対象にペムブロリズマブ投与の有効性と安全性を化学療法群と比較した国際共同ランダム化非盲検第Ⅲ相試験
【有効性】ペムブロリズマブ群 (TPS≧50%)
- mOS : 20.0ヵ月 [主要評価項目]
≧1%:16.7ヵ月 ≧20%:17.7ヵ月
- mPFS : 7.1ヵ月
≧1%:5.4ヵ月 ≧20%:6.2ヵ月
- ORR : 39%
≧1%:27% ≧33%
特徴と注意点
本剤の適応
- NSCLC、PD-L1発現≧1%
- 一次治療および二次治療以降
投与開始前の注意点
- PD-L1 IHC 22C3 pharmDx 「ダコ」 ® で、 PD-L1陽性(TPS≧1%)が確認された患者に投与。
- EGFR遺伝子変異やALK融合遺伝子がないことを確認する必要がある。
- コンパニオン診断薬の詳細は「肺癌患者におけるPD-L1検査の手引き³⁾」へ
- PSが0-1が治験時の患者登録基準である。
- 自己免疫疾患、 間質性肺疾患等の既往はirAEのリスクとなるため投与前に評価
副作用と対策 >>もっと見る
- 本剤のT細胞活性化作用により、 過度の免疫反応に起因すると考えられる様々な疾患や病態 (irAE) が現れることがある。
- 内分泌機能検査 (TSH、 FT4、 ACTHなど) などの定期的なモニタリングが必要。
- その他尿検査や画像評価などの定期的なモニタリングも必要。
- 有害事象が疑われた場合には、 各専門医へのコンサルトも検討。
- 免疫チェックポイント阻害薬は投与を終了数か月後に副作用が認めることもあるため、 投与終了後のモニタリング時も要注意。
- 薬剤性肺障害が疑われた場合には、 フローチャートに従って速やかに対応。
出典
1) キイトルーダ®点滴静注100mg 電子添文 (2025年7月改訂 第25版)
2) キイトルーダ®点滴静注100mg 適正使用ガイド (2025年5月作成)
最終更新日 : 2025年10月12日
HOKUTO編集部医師監修
Pembrolizumab
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ヒト型抗ヒトPD-1モノクローナル抗体 ペムブロリズマブ
*「MSD株式会社」の外部サイトへ遷移します。
投与スケジュール
【1コース】21日 or 42日
【催吐性】 最小度催吐性
【FN発症】低リスク
1コース21日間 (3週間ごと投与の場合)

1コース42日間 (6週間ごと投与の場合)

キイトルーダ®添付文書¹⁾より引用
KeyData|臨床試験結果
📊 KEYNOTE-024試験³⁾⁴⁾
化学療法未治療のEGFR遺伝子変異/ALK融合遺伝子陰性かつPD-L1高発現 (TPS≧50%) の進行・再発のNSCLC患者305例 (国内40例)を対象に、 ペムブロリズマブ200mg3週ごと投与の有効性と安全性を化学療法群と比較した国際共同ランダム化非盲検第Ⅲ相試験
【有効性】ペムブロリズマブ群 (TPS≧50%)
- mPFS : 10.3ヵ月 [主要評価項目]
- mOS :未到達
- ORR : 44.8%
【安全性】主な有害事象
- 下痢 (16.2%、≧Grade3 3.9%)
- 疲労 (14.3%、≧Grade3 1.9%)
- 甲状腺機能低下症 (10.4%、≧Grade3 N.D)
- 肺臓炎 (8.4%、≧Grade3 3.2%)
- 甲状腺機能亢進症 (7.1%、≧Grade3 N.D)
休薬・中止基準の設定された有害事象
- 間質性肺疾患 - 大腸炎/下痢
- 肝機能障害 - 腎機能障害
- 内分泌障害 - Infusion reaction
日本人で発現割合が外国人より10%以上高かった有害事象
- 口内炎 (日本人 : 19.0%)
- 倦怠感 (日本人 : 14.3%)
- 発熱 (日本人 : 33.3%)
- 発疹 (日本人 : 14.3%)
📊 KEYNOTE-042試験⁵⁾
化学療法未治療のEGFR遺伝子変異/ALK融合遺伝子陰性かつPD-L1高発現 (TPS≧1%) の進行・再発のNSCLC患者1274例 (国内93例) を対象にペムブロリズマブ投与の有効性と安全性を化学療法群と比較した国際共同ランダム化非盲検第Ⅲ相試験
【有効性】ペムブロリズマブ群 (TPS≧50%)
- mOS : 20.0ヵ月 [主要評価項目]
≧1%:16.7ヵ月 ≧20%:17.7ヵ月
- mPFS : 7.1ヵ月
≧1%:5.4ヵ月 ≧20%:6.2ヵ月
- ORR : 39%
≧1%:27% ≧33%
特徴と注意点
本剤の適応
- NSCLC、PD-L1発現≧1%
- 一次治療および二次治療以降
投与開始前の注意点
- PD-L1 IHC 22C3 pharmDx 「ダコ」 ® で、 PD-L1陽性(TPS≧1%)が確認された患者に投与。
- EGFR遺伝子変異やALK融合遺伝子がないことを確認する必要がある。
- コンパニオン診断薬の詳細は「肺癌患者におけるPD-L1検査の手引き³⁾」へ
- PSが0-1が治験時の患者登録基準である。
- 自己免疫疾患、 間質性肺疾患等の既往はirAEのリスクとなるため投与前に評価
副作用と対策 >>もっと見る
- 本剤のT細胞活性化作用により、 過度の免疫反応に起因すると考えられる様々な疾患や病態 (irAE) が現れることがある。
- 内分泌機能検査 (TSH、 FT4、 ACTHなど) などの定期的なモニタリングが必要。
- その他尿検査や画像評価などの定期的なモニタリングも必要。
- 有害事象が疑われた場合には、 各専門医へのコンサルトも検討。
- 免疫チェックポイント阻害薬は投与を終了数か月後に副作用が認めることもあるため、 投与終了後のモニタリング時も要注意。
- 薬剤性肺障害が疑われた場合には、 フローチャートに従って速やかに対応。
出典
1) キイトルーダ®点滴静注100mg 電子添文 (2025年7月改訂 第25版)
2) キイトルーダ®点滴静注100mg 適正使用ガイド (2025年5月作成)
最終更新日 : 2025年10月12日
HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。