本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
抗PD−L1抗体 デュルバルマブ
抗CTLA-4抗体 トレメリムマブ
*アストラゼネカ株式会社の外部サイトへ遷移します¹⁾
投与スケジュール
適正使用ガイド¹⁾、POSEIDON試験²⁾より引用

イミフィンジ®︎ 1回1500mgを3週間間隔で4回、 60分間以上かけ点滴静注。 その後、 1回1500mgを4週間間隔で60分間以上かけ点滴静注。
※体重30kg以下の場合の1回投与量は20mg/kg (体重)¹⁾
イジュド®︎ 1回75mgを3週間間隔で4回、 60分間以上かけ点滴静注。 その後、 7週間の間隔を空けて、 75mgを1回60分間以上かけ点滴静注¹⁾。
※規格により適応が異なる (イジュド点滴静注25mgのみ 切除不能な進行・再発の非小細胞肺癌)¹⁾
白金製剤併用化学療法について
CBDCA/nab-PTX

パクリタキセル (アルブミン懸濁型) (第1、 8、 15日目に100mg/m²) +カルボプラチン (第1日目にAUC5又は6)
CDDP(CBDCA)/GEM【扁平上皮癌のみ】
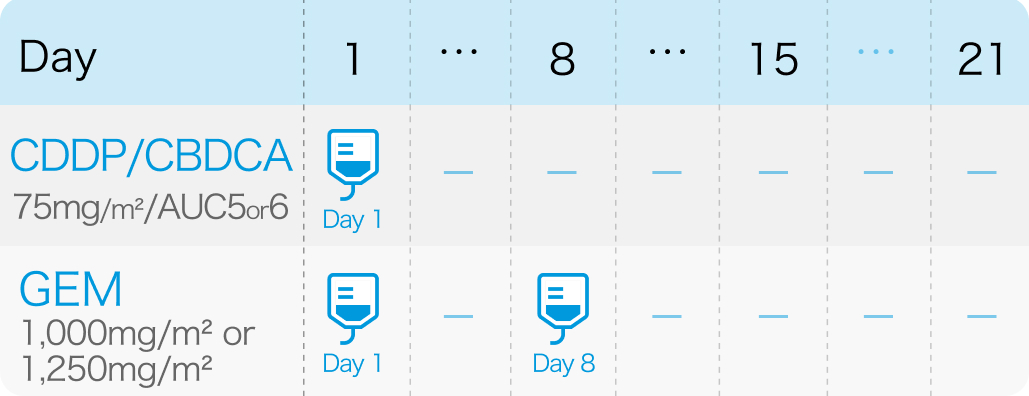
ゲムシタビン (第1、 8日目に1000mg/m²又は1250mg/m²を投与) +シスプラチン (第1日目に75mg/m²) もしくはカルボプラチン (第1日目にAUC5又は6)
CDDP(CBDCA)/PEM【非扁平上皮癌のみ】

ペメトレキセド (第1日目に500mg/m²) +シスプラチン (第1日目に75mg/m²) もしくはカルボプラチン (第1日目にAUC5又は6) また、 ペメトレキセド+白金製剤投与後に病勢が進行していない患者は、 ペメトレキセド (500mg/m²) 維持療法 (4週間間隔投与) に移行
KeyData|臨床試験結果
📊POSEIDON試験²⁾³⁾の概要
IV期 NSCLCの一次治療として1,013名の患者を対象に、 イミフィンジと白金製剤を含む化学療法との併用療法 [D+CT群]、 またはイミフィンジ、 イジュド、 白金製剤を含む化学療法の併用療法 [T+D+CT群]と、 化学療法の単独療法 [CT群]を比較した第Ⅲ相無作為化非盲検多施設共同国際試験
全てのPD-L1発現レベルの非扁平上皮癌または扁平上皮癌の患者が組み入れられた。 なお、 EGFR遺伝子変異陽性またはALK遺伝子変異陽性の患者は除外された。
T+D+CT群 vs CT群 [副次評価項目]
PFSおよびOSはCT群と比較して有意に改善
- PFS中央値:6.2ヵ月 vs 4.8ヵ月
HR 0.72; 95% CI 0.60-0.86; P=0.0003
- OS中央値 :14.0ヵ月 vs 11.7ヵ月
HR 0.77; 95% CI 0.65-0.92; P=0.0030
- 24ヵ月OS率:32.9% vs 22.1%
- 60ヵ月OS率:15.7% vs 6.8%³⁾
治療関連有害事象
Grade3以上の治療関連有害事象
- T+D+CT群:51.8%
- CT群:44.4%
治療関連有害事象のための治療中止
- T+D+CT群:15.5%
- CT群:9.9%
各プロトコル
治療開始基準
適正使用ガイド¹⁾、POSEIDON試験²⁾³⁾より引用
IV期 NSCLCで、 全てのPD-L1発現レベルの非扁平上皮癌または扁平上皮癌の患者が組み入れられた (IHC検査法: SP263)。 なお、 EGFR遺伝子変異陽性またはALK遺伝子変異陽性の患者は除外された。 その他の開始基準例は以下の通りである。

休薬・減量・中止基準
イミフィンジ®︎、イジュド®︎

イミフィンジ®︎イジュド®︎適正使用ガイド¹⁾より引用
参考文献
1) アストラゼネカ株式会社 「イミフィンジ®︎ イジュド®︎適正使用ガイド」 2023年11月掲載 [最終閲覧 2023/8/19]
*アストラゼネカ株式会社の外部サイトへ遷移します
最終更新日:2024年9月20日
監修・作図:HOKUTO編集部専門医
Durvalumab/Tremelimumab + Chemotherapy
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
抗PD−L1抗体 デュルバルマブ
抗CTLA-4抗体 トレメリムマブ
*アストラゼネカ株式会社の外部サイトへ遷移します¹⁾
投与スケジュール
適正使用ガイド¹⁾、POSEIDON試験²⁾より引用

イミフィンジ®︎ 1回1500mgを3週間間隔で4回、 60分間以上かけ点滴静注。 その後、 1回1500mgを4週間間隔で60分間以上かけ点滴静注。
※体重30kg以下の場合の1回投与量は20mg/kg (体重)¹⁾
イジュド®︎ 1回75mgを3週間間隔で4回、 60分間以上かけ点滴静注。 その後、 7週間の間隔を空けて、 75mgを1回60分間以上かけ点滴静注¹⁾。
※規格により適応が異なる (イジュド点滴静注25mgのみ 切除不能な進行・再発の非小細胞肺癌)¹⁾
白金製剤併用化学療法について
CBDCA/nab-PTX

パクリタキセル (アルブミン懸濁型) (第1、 8、 15日目に100mg/m²) +カルボプラチン (第1日目にAUC5又は6)
CDDP(CBDCA)/GEM【扁平上皮癌のみ】

ゲムシタビン (第1、 8日目に1000mg/m²又は1250mg/m²を投与) +シスプラチン (第1日目に75mg/m²) もしくはカルボプラチン (第1日目にAUC5又は6)
CDDP(CBDCA)/PEM【非扁平上皮癌のみ】

ペメトレキセド (第1日目に500mg/m²) +シスプラチン (第1日目に75mg/m²) もしくはカルボプラチン (第1日目にAUC5又は6) また、 ペメトレキセド+白金製剤投与後に病勢が進行していない患者は、 ペメトレキセド (500mg/m²) 維持療法 (4週間間隔投与) に移行
KeyData|臨床試験結果
📊POSEIDON試験²⁾³⁾の概要
IV期 NSCLCの一次治療として1,013名の患者を対象に、 イミフィンジと白金製剤を含む化学療法との併用療法 [D+CT群]、 またはイミフィンジ、 イジュド、 白金製剤を含む化学療法の併用療法 [T+D+CT群]と、 化学療法の単独療法 [CT群]を比較した第Ⅲ相無作為化非盲検多施設共同国際試験
全てのPD-L1発現レベルの非扁平上皮癌または扁平上皮癌の患者が組み入れられた。 なお、 EGFR遺伝子変異陽性またはALK遺伝子変異陽性の患者は除外された。
T+D+CT群 vs CT群 [副次評価項目]
PFSおよびOSはCT群と比較して有意に改善
- PFS中央値:6.2ヵ月 vs 4.8ヵ月
HR 0.72; 95% CI 0.60-0.86; P=0.0003
- OS中央値 :14.0ヵ月 vs 11.7ヵ月
HR 0.77; 95% CI 0.65-0.92; P=0.0030
- 24ヵ月OS率:32.9% vs 22.1%
- 60ヵ月OS率:15.7% vs 6.8%³⁾
治療関連有害事象
Grade3以上の治療関連有害事象
- T+D+CT群:51.8%
- CT群:44.4%
治療関連有害事象のための治療中止
- T+D+CT群:15.5%
- CT群:9.9%
各プロトコル
治療開始基準
適正使用ガイド¹⁾、POSEIDON試験²⁾³⁾より引用
IV期 NSCLCで、 全てのPD-L1発現レベルの非扁平上皮癌または扁平上皮癌の患者が組み入れられた (IHC検査法: SP263)。 なお、 EGFR遺伝子変異陽性またはALK遺伝子変異陽性の患者は除外された。 その他の開始基準例は以下の通りである。

休薬・減量・中止基準
イミフィンジ®︎、イジュド®︎

イミフィンジ®︎イジュド®︎適正使用ガイド¹⁾より引用
参考文献
1) アストラゼネカ株式会社 「イミフィンジ®︎ イジュド®︎適正使用ガイド」 2023年11月掲載 [最終閲覧 2023/8/19]
*アストラゼネカ株式会社の外部サイトへ遷移します
最終更新日:2024年9月20日
監修・作図:HOKUTO編集部専門医
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。