本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヒト型抗ヒトPD-L1モノクローナル抗体 アベルマブ
*メルクバイオファーマ株式会社の外部サイトへ遷移します
用法用量
JAVELIN Bladder 100³⁾/電子添文¹⁾ 用法用量
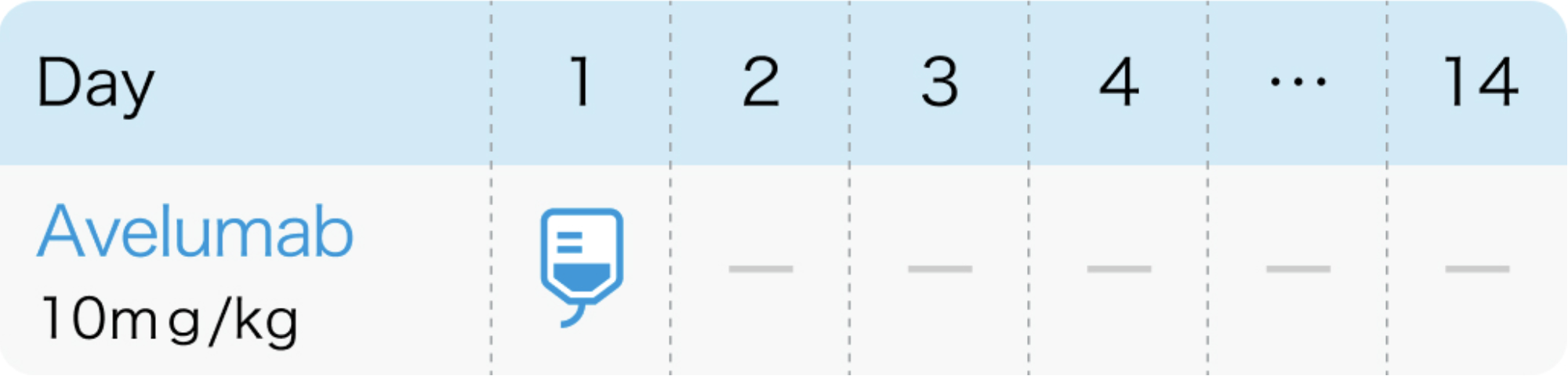
通常、 成人には、1回10mg/kg (体重) を2週間間隔で1時間以上かけて点滴静注する。
N Engl J Med. 2020 Sep 24;383(13):1218-1230.³⁾、 バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾より作図
特徴と注意点
根治切除不能な尿路上皮癌における化学療法後の維持療法の選択肢
プラチナ併用化学療法4-6サイクル後にSD以上であった症例の維持療法として行うこと
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
インフュージョンリアクション予防
アセトアミノフェンとH1拮抗薬の前投薬を必要である。 前サイクル時にあらかじめ処方し、 持参してもらう必要がある。
infusion reactionを軽減させるため、 投与前に抗ヒスタミン剤、 解熱鎮痛剤等の投与を行うこと バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾引用
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
JAVELIN Bladder 100試験³⁾
N Engl J Med. 2020 ;383(13):1218-30.
プラチナ製剤ベースの1次治療で病勢進行を認めなかった切除不能な局所進行または転移性の尿路上皮癌患者において、 抗PD-L1抗体アベルマブの効果を、 BSC群を対照に検証した第Ⅲ相比較試験
有効性|アベルマブ群全集団及びPD-L1陽性
- ORR :9.7% (PD-L1陽性 13.8%)
- mOS : 23.8ヵ月 (PD-L1陽性 未到達)
- mPFS : 5.5ヵ月 (PD-L1陽性 5.7ヵ月)
安全性|主な有害事象 (カッコ内はGrade3~4)
- 貧血 11.3% (3.8%)
- 倦怠感 17.7% (1.7%)
- 下痢 16.6% (0.6%)
- 無力症 16.3% (0%)
- 便秘 16.3% (0.6%)
- 嘔気 15.7% (0.3%)
- 発熱 14.8% (0.3%)
- 食欲減退 13.7% (0.3%)
- 嘔吐 12.5% (1.2%)
- 尿路感染 17.2% (4.4%)
各プロトコル
投与開始基準
JAVELIN Bladder 100試験³⁾のプロトコル
局所進行性または転移性の膀胱癌の組織学的または細胞学的診断ある18歳以上 (日本では20歳以上) の患者で以下を満たすもの
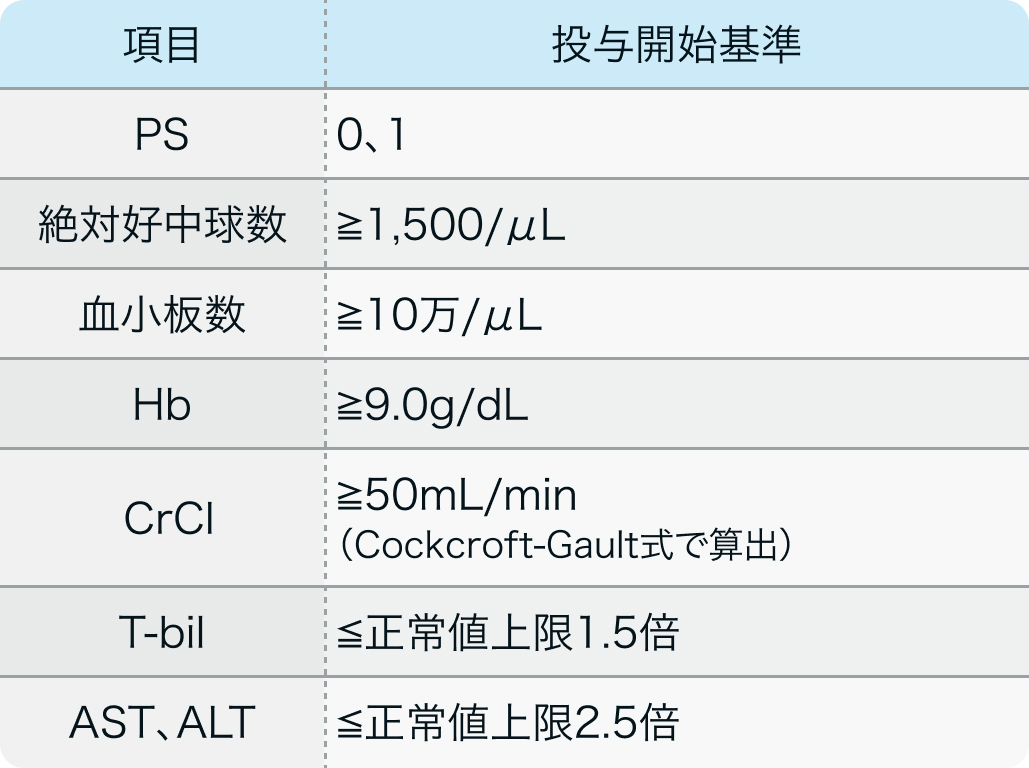
N Engl J Med. 2020 Sep 24;383(13):1218-1230.³⁾より作図
減量・休薬・中止基準
アベルマブ適正使用ガイド²⁾の基準
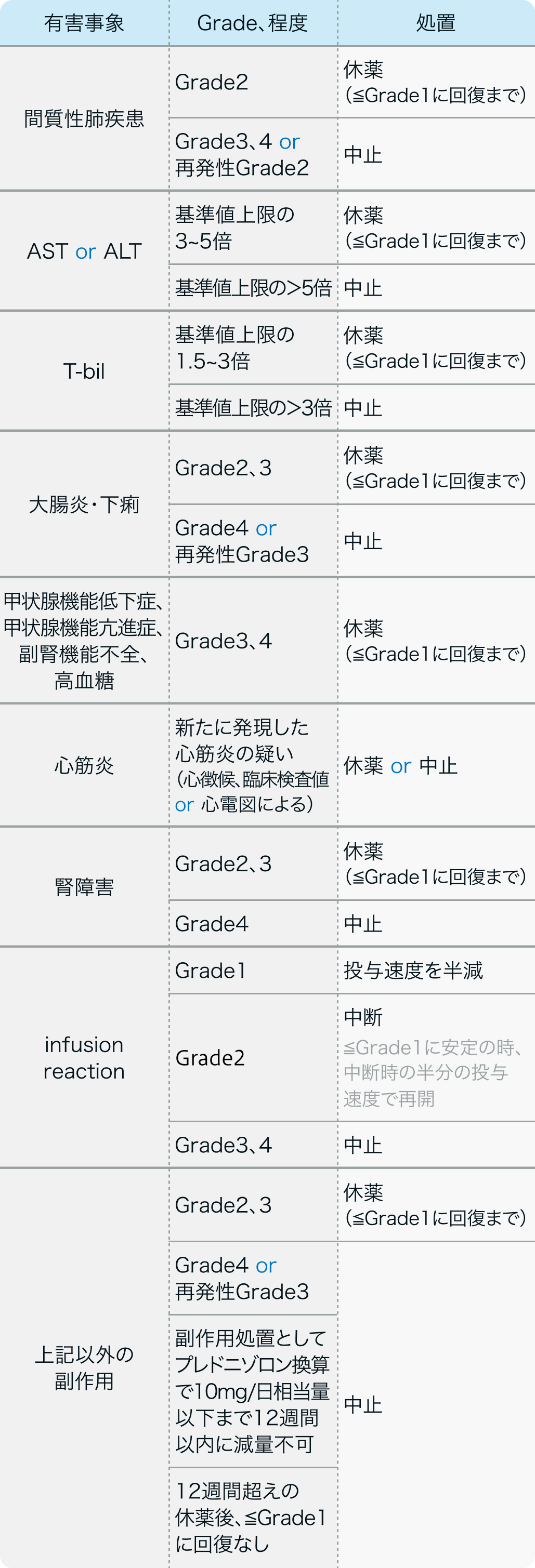
バベンチオ®適正使用ガイド (2023年7月作成)より作図
出典
- メルクバイオファーマ株式会社. バベンチオ®電子添文 (2023年7月改訂 第8版) [最終閲覧 : 2024/11/26]
- メルクバイオファーマ株式会社. バベンチオ®適正使用ガイド (2023年7月作成) [最終閲覧 : 2024/11/26]
- Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med. 2020 Sep 24;383(13):1218-1230. PMID: 32945632
最終更新日 : 2024年11月26日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Avelumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヒト型抗ヒトPD-L1モノクローナル抗体 アベルマブ
*メルクバイオファーマ株式会社の外部サイトへ遷移します
用法用量
JAVELIN Bladder 100³⁾/電子添文¹⁾ 用法用量

通常、 成人には、1回10mg/kg (体重) を2週間間隔で1時間以上かけて点滴静注する。
N Engl J Med. 2020 Sep 24;383(13):1218-1230.³⁾、 バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾より作図
特徴と注意点
根治切除不能な尿路上皮癌における化学療法後の維持療法の選択肢
プラチナ併用化学療法4-6サイクル後にSD以上であった症例の維持療法として行うこと
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
インフュージョンリアクション予防
アセトアミノフェンとH1拮抗薬の前投薬を必要である。 前サイクル時にあらかじめ処方し、 持参してもらう必要がある。
infusion reactionを軽減させるため、 投与前に抗ヒスタミン剤、 解熱鎮痛剤等の投与を行うこと バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾引用
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
JAVELIN Bladder 100試験³⁾
N Engl J Med. 2020 ;383(13):1218-30.
プラチナ製剤ベースの1次治療で病勢進行を認めなかった切除不能な局所進行または転移性の尿路上皮癌患者において、 抗PD-L1抗体アベルマブの効果を、 BSC群を対照に検証した第Ⅲ相比較試験
有効性|アベルマブ群全集団及びPD-L1陽性
- ORR :9.7% (PD-L1陽性 13.8%)
- mOS : 23.8ヵ月 (PD-L1陽性 未到達)
- mPFS : 5.5ヵ月 (PD-L1陽性 5.7ヵ月)
安全性|主な有害事象 (カッコ内はGrade3~4)
- 貧血 11.3% (3.8%)
- 倦怠感 17.7% (1.7%)
- 下痢 16.6% (0.6%)
- 無力症 16.3% (0%)
- 便秘 16.3% (0.6%)
- 嘔気 15.7% (0.3%)
- 発熱 14.8% (0.3%)
- 食欲減退 13.7% (0.3%)
- 嘔吐 12.5% (1.2%)
- 尿路感染 17.2% (4.4%)
各プロトコル
投与開始基準
JAVELIN Bladder 100試験³⁾のプロトコル
局所進行性または転移性の膀胱癌の組織学的または細胞学的診断ある18歳以上 (日本では20歳以上) の患者で以下を満たすもの

N Engl J Med. 2020 Sep 24;383(13):1218-1230.³⁾より作図
減量・休薬・中止基準
アベルマブ適正使用ガイド²⁾の基準

バベンチオ®適正使用ガイド (2023年7月作成)より作図
出典
- メルクバイオファーマ株式会社. バベンチオ®電子添文 (2023年7月改訂 第8版) [最終閲覧 : 2024/11/26]
- メルクバイオファーマ株式会社. バベンチオ®適正使用ガイド (2023年7月作成) [最終閲覧 : 2024/11/26]
- Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med. 2020 Sep 24;383(13):1218-1230. PMID: 32945632
最終更新日 : 2024年11月26日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。