nab-PTX:アルブミン懸濁型パクリタキセル(アブラキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 125mg/m² 点滴 | 1~ | Day1,8,15 |
GEM:ゲムシタビン(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1000mg/m² | 1~ | Day1,8,15 |
その他
| 1コース28日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
*大鵬薬品の外部サイトへ遷移します
投与スケジュール
1コース4週間
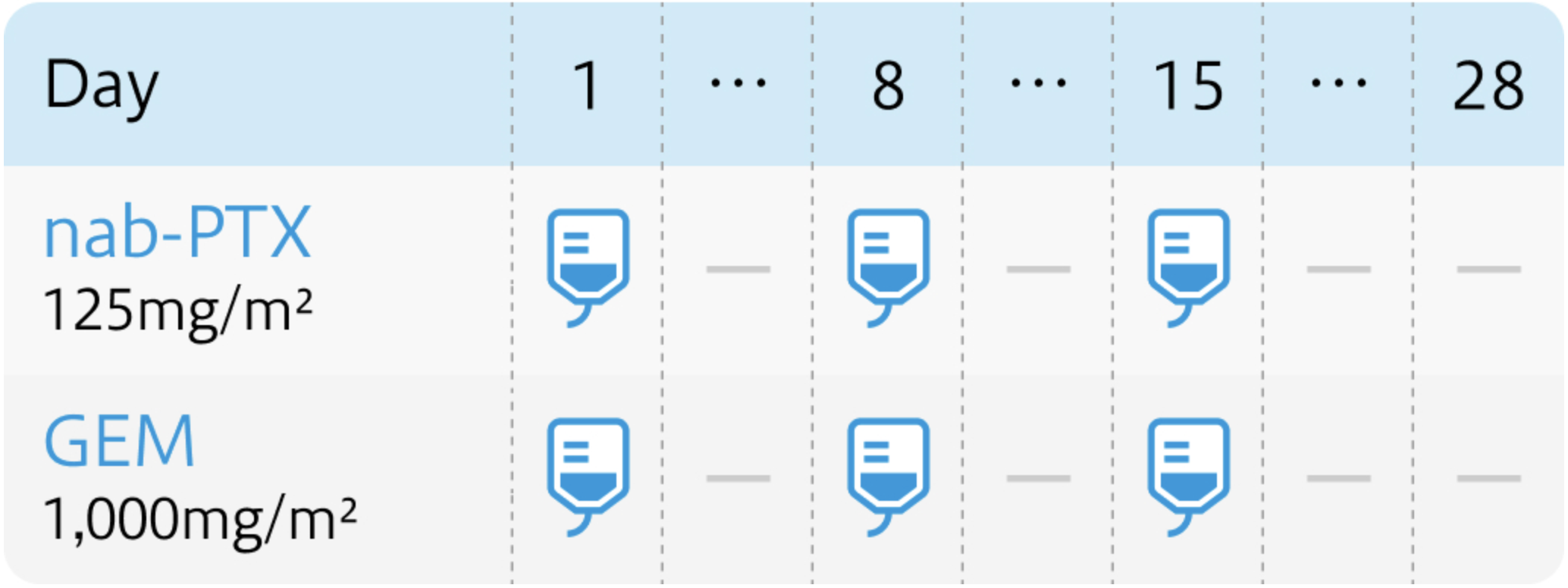
ジェムザール®、 アブラキサン®電子添文より作図
各プロトコル
適格基準
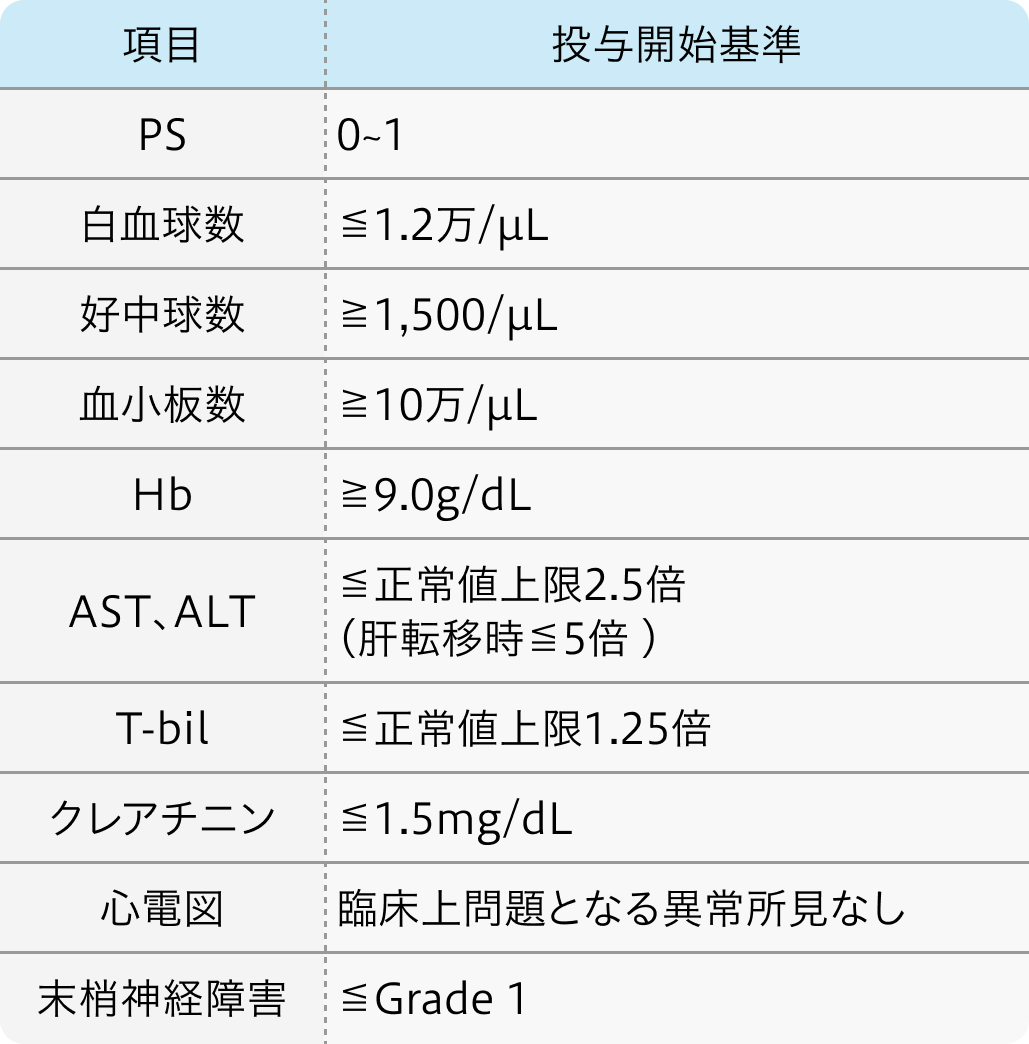
VTCAE4.0 アブラキサン®適正使用ガイドより作図
継続基準
各コースの開始前日又は当日に確認

アブラキサン®適正使用ガイドより作図
Day8、 Day15に確認
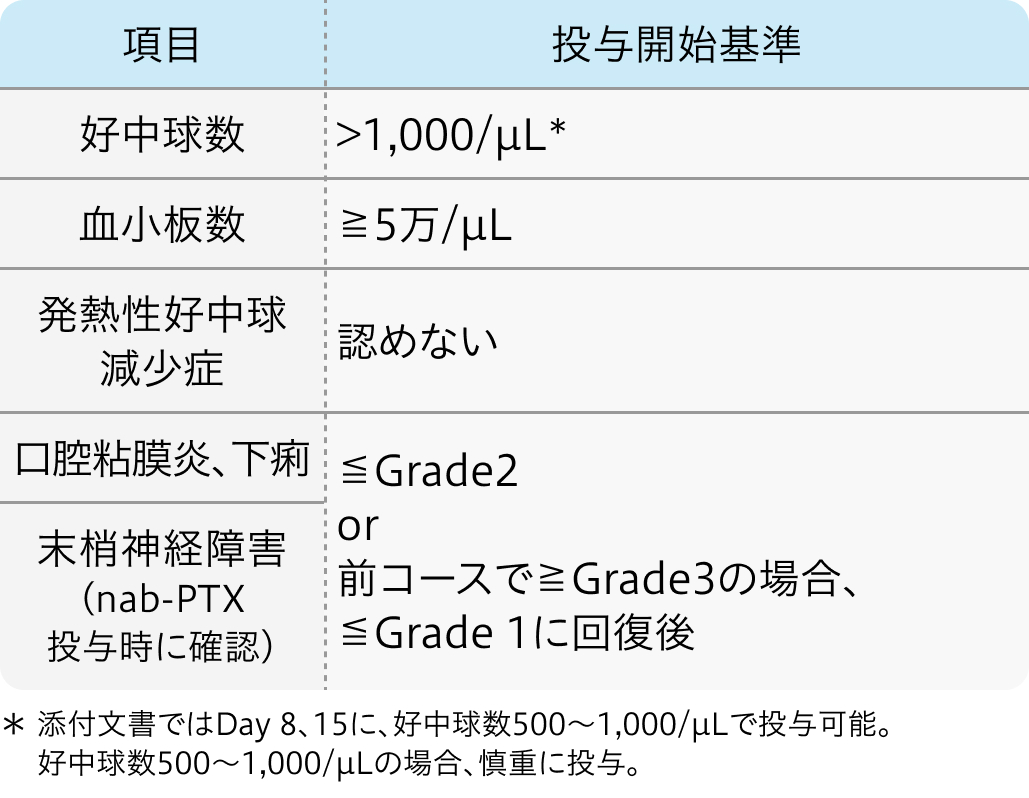
アブラキサン®適正使用ガイドより作図
減量・休薬基準

アブラキサン®適正使用ガイドより作図
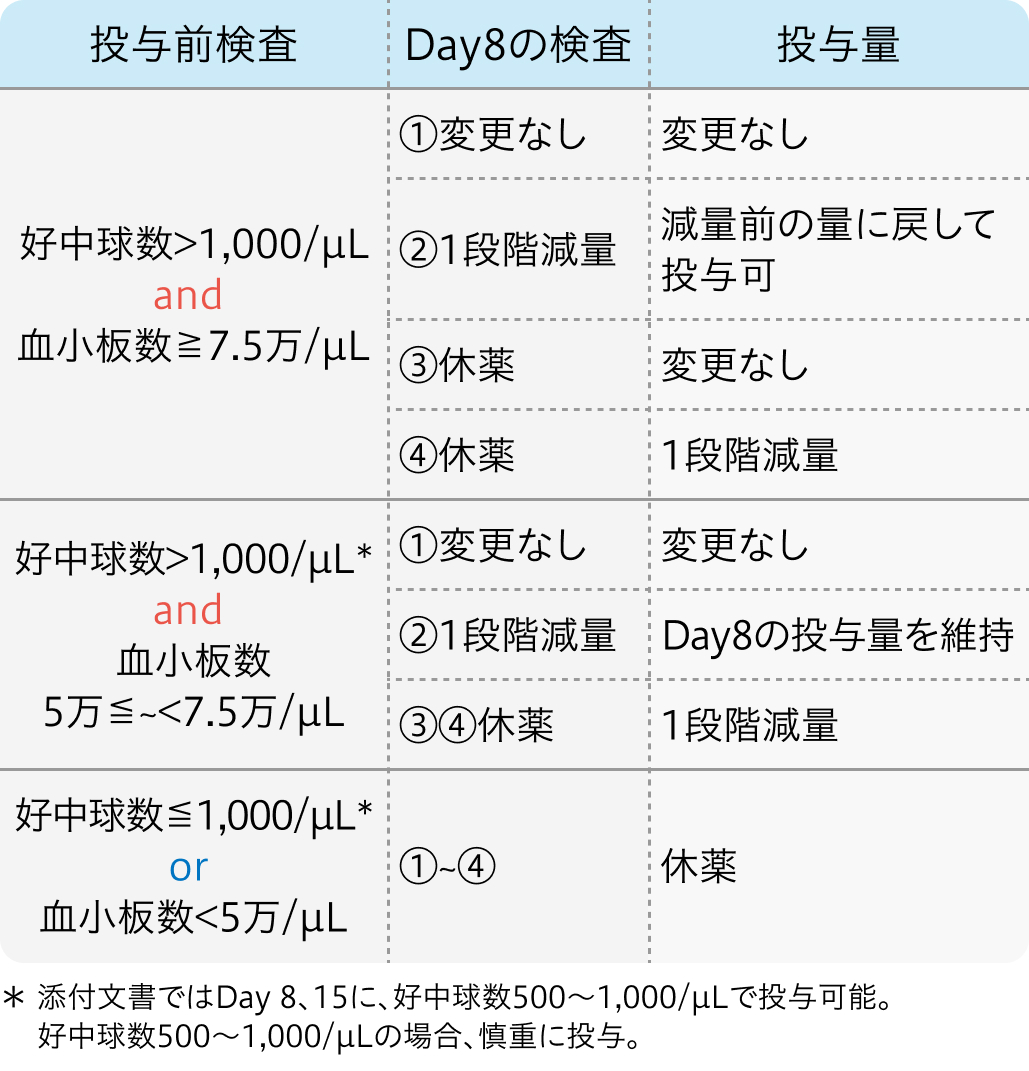
コース内投与量調整基準Day8
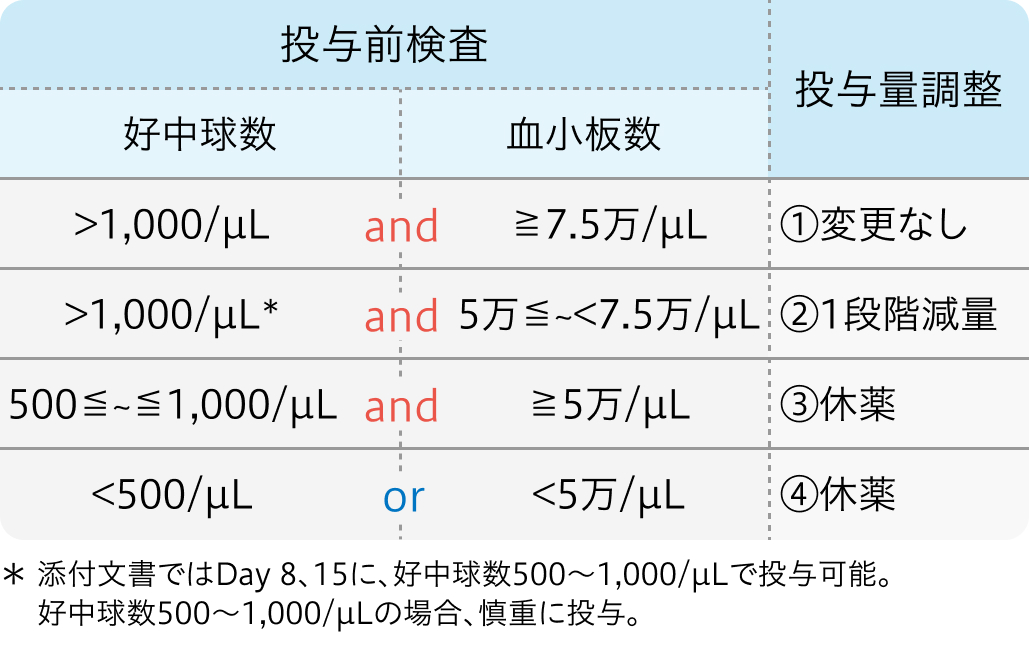
アブラキサン®適正使用ガイドより作図
コース内投与量調整基準Day15
アブラキサン®適正使用ガイドより作図
初回基準量と減量レベル
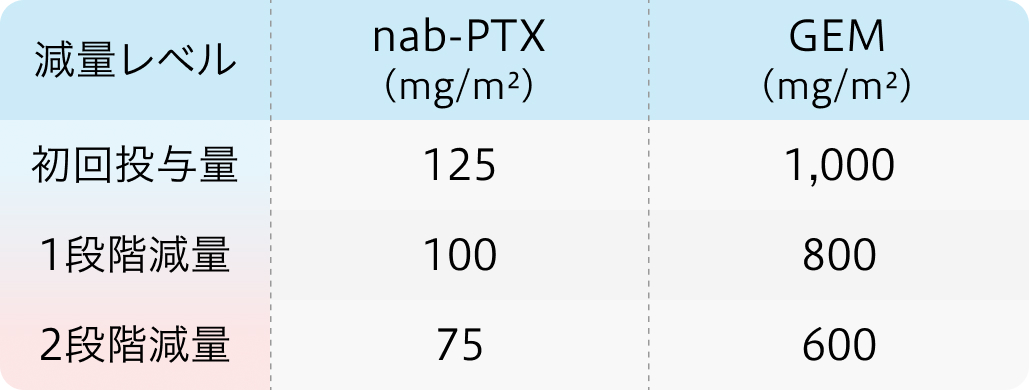
アブラキサン®適正使用ガイドより作図
主な有害事象
CA046試験 : MPACT試験¹⁾²⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 46.1% (12.6%)
- 好中球減少 45.8% (36.1%)
- 血小板減少 35.4% (14.0%)
- 白血球減少 18.1% (12.4%)
- 疲労 53.7% (16.6%)
- 悪心 49.2% (4.0%)
- 下痢 37.1% (5.7%)
- 嘔吐 31.6% (4.5%)
- 発熱 29.0% (1.9%)
- 食欲減退 27.3% (3.1%)
- 便秘 11.9% (0.7%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 50.1% (1.4%)
- 末梢性感覚ニューロパチー 48.9% (15.7%)
N Engl J Med. 2013 Oct 31;369(18):1691-703⁵⁾より引用
特徴と注意点
有害事象について
投与初期は血液毒性、 非血液毒性ともに軽微であることが多いが、 治療継続に伴い、 脱毛、 末梢感覚性/運動性ニューロパチー、 疲労、 倦怠感、 末梢浮腫、 爪変形などが現れることがある。これらの有害事象は主にナブパクリタキセルに伴うものであり、 重篤性に合わせて、 ナブパクリタキセルの減量、 休薬を検討する。
ガイドラインでの扱い
膵癌診療ガイドライン2022年版において、 遠隔転移を有する膵癌に対してFOLFIRINOX療法と並んで推奨されているレジメンである。 本レジメンは、 76歳以上の高齢者やPS2の患者への適用も可能であるが、 年齢やPS以外にも併存症などを加味して、 適用を判断する。
排泄方法
ナブパクリタキセルは胆汁排泄性であるため、 胆道閉塞、 ビリルビン高値例では投与を避ける。
関連する臨床試験
📊 MPACT試験¹⁾²⁾ [転移性膵癌]
N Engl J Med. 2013 Oct 31;369(18):1691-703.
ClinicalTrials.gov. February 16, 2009
前治療のない転移性膵癌患者861例を対象とし、 GnP療法とGEM単独を比較した多施設共同無作為化非盲検比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は安全性、 無増悪生存期間 (PFS)、 奏効率 (ORR)、 病勢コントロール率 (DCR)、 治療成功期間 (TTF) など。
全生存期間 (OS)
GnP療法 : 8.5ヵ月 vs GEM単独 : 6.7ヵ月
HR 0.72 (95%CI 0.62–0.83, p<0.001)
無増悪生存期間 (PFS)
GnP療法 : 5.5ヵ月 vs GEM単独 : 3.7ヵ月
HR 0.69 (p<0.001)
奏効率 (ORR)
GnP療法 : 23% vs GEM単独 : 7%
病勢コントロール率 (DCR)
GnP療法 : 48% vs GEM単独 : 33%
治療成功期間 (TTF)
GnP療法 : 5.1ヵ月 vs GEM単独 : 3.6ヵ月
主なGrade3/4有害事象
GnP療法 : 好中球減少 38%、 疲労 17%、 末梢神経障害 17%、 治療関連死 4%
GEM単独 : 好中球減少 27%、 疲労 7%、 末梢神経障害 1%、 治療関連死 1%
📊 JCOG1407試験³⁾ [局所進行膵癌]
Eur J Cancer. 2023 Mar:181:135-144.
未治療局所進行膵癌 (LAPC) 患者125例を対象に、 mFOLFIRINOXとGnP療法を比較した第II相多施設共同無作為化非盲検比較試験。 主要評価項目は1年生存率、 副次評価項目は全生存期間 (OS)、 無増悪生存期間 (PFS)、 奏効率 (ORR)、 病勢コントロール率 (DCR)、 CA19-9反応率、 安全性など。
1年生存率 (主要評価項目)
mFOLFIRINOX : 77.4% (95%CI 64.9–86.0)
GnP療法 : 82.5% (70.7–89.9)
全生存期間 (OS)
mFOLFIRINOX : 23.0ヵ月 (19.3–29.3)
GnP療法 : 21.3ヵ月 (18.2–24.1)
HR 1.096 (95%CI 0.726–1.654)
無増悪生存期間 (PFS)
mFOLFIRINOX : 11.2ヵ月 (9.9–15.9)
GnP療法 : 9.4ヵ月 (7.4–12.8)
HR 1.359 (95%CI 0.939–1.968)
奏効率 (ORR)
mFOLFIRINOX : 30.9% vs GnP : 42.1%
病勢コントロール率 (DCR)
mFOLFIRINOX : 87.3% vs GnP : 96.5%
CA19-9反応率
mFOLFIRINOX : 57.1% vs GnP : 85.0%
コンバージョン手術率
mFOLFIRINOX : 8.1% vs GnP : 7.8%
主なGrade3/4有害事象
mFOLFIRINOX : 下痢 17.7%、食欲不振 16.1%
GnP療法 : 末梢神経障害 36.5%、 好中球減少 79.4%、 白血球減少 44.4%
発熱性好中球減少 : 8.1% vs 4.8%
治療関連死 : いずれも0%
出典
- Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013 Oct 31;369(18):1691-703. PMID: 24131140
- Phase III Study of ABI-007(Albumin-bound Paclitaxel) Plus Gemcitabine Versus Gemcitabine in Metastatic Adenocarcinoma of the Pancreas. ClinicalTrials.gov. February 16, 2009
- A randomised phase II study of modified FOLFIRINOX versus gemcitabine plus nab-paclitaxel for locally advanced pancreatic cancer (JCOG1407). Eur J Cancer. 2023 Mar:181:135-144. PMID: 36652891
最終更新日 : 2023年7月7日
執筆医 : 神奈川県立がんセンター 消化器内科 小林 智先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
GnP (GEM+nab-PTX)
nab-PTX:アルブミン懸濁型パクリタキセル(アブラキサン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 125mg/m² 点滴 | 1~ | Day1,8,15 |
GEM:ゲムシタビン(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1000mg/m² | 1~ | Day1,8,15 |
その他
| 1コース28日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
*大鵬薬品の外部サイトへ遷移します
投与スケジュール
1コース4週間

ジェムザール®、 アブラキサン®電子添文より作図
各プロトコル
適格基準

VTCAE4.0 アブラキサン®適正使用ガイドより作図
継続基準
各コースの開始前日又は当日に確認

アブラキサン®適正使用ガイドより作図
Day8、 Day15に確認

アブラキサン®適正使用ガイドより作図
減量・休薬基準

アブラキサン®適正使用ガイドより作図
コース内投与量調整基準Day8

アブラキサン®適正使用ガイドより作図
コース内投与量調整基準Day15

アブラキサン®適正使用ガイドより作図
初回基準量と減量レベル

アブラキサン®適正使用ガイドより作図
主な有害事象
CA046試験 : MPACT試験¹⁾²⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 46.1% (12.6%)
- 好中球減少 45.8% (36.1%)
- 血小板減少 35.4% (14.0%)
- 白血球減少 18.1% (12.4%)
- 疲労 53.7% (16.6%)
- 悪心 49.2% (4.0%)
- 下痢 37.1% (5.7%)
- 嘔吐 31.6% (4.5%)
- 発熱 29.0% (1.9%)
- 食欲減退 27.3% (3.1%)
- 便秘 11.9% (0.7%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 50.1% (1.4%)
- 末梢性感覚ニューロパチー 48.9% (15.7%)
N Engl J Med. 2013 Oct 31;369(18):1691-703⁵⁾より引用
特徴と注意点
有害事象について
投与初期は血液毒性、 非血液毒性ともに軽微であることが多いが、 治療継続に伴い、 脱毛、 末梢感覚性/運動性ニューロパチー、 疲労、 倦怠感、 末梢浮腫、 爪変形などが現れることがある。これらの有害事象は主にナブパクリタキセルに伴うものであり、 重篤性に合わせて、 ナブパクリタキセルの減量、 休薬を検討する。
ガイドラインでの扱い
膵癌診療ガイドライン2022年版において、 遠隔転移を有する膵癌に対してFOLFIRINOX療法と並んで推奨されているレジメンである。 本レジメンは、 76歳以上の高齢者やPS2の患者への適用も可能であるが、 年齢やPS以外にも併存症などを加味して、 適用を判断する。
排泄方法
ナブパクリタキセルは胆汁排泄性であるため、 胆道閉塞、 ビリルビン高値例では投与を避ける。
関連する臨床試験
📊 MPACT試験¹⁾²⁾ [転移性膵癌]
N Engl J Med. 2013 Oct 31;369(18):1691-703.
ClinicalTrials.gov. February 16, 2009
前治療のない転移性膵癌患者861例を対象とし、 GnP療法とGEM単独を比較した多施設共同無作為化非盲検比較試験。 主要評価項目は全生存期間 (OS)、 副次評価項目は安全性、 無増悪生存期間 (PFS)、 奏効率 (ORR)、 病勢コントロール率 (DCR)、 治療成功期間 (TTF) など。
全生存期間 (OS)
GnP療法 : 8.5ヵ月 vs GEM単独 : 6.7ヵ月
HR 0.72 (95%CI 0.62–0.83, p<0.001)
無増悪生存期間 (PFS)
GnP療法 : 5.5ヵ月 vs GEM単独 : 3.7ヵ月
HR 0.69 (p<0.001)
奏効率 (ORR)
GnP療法 : 23% vs GEM単独 : 7%
病勢コントロール率 (DCR)
GnP療法 : 48% vs GEM単独 : 33%
治療成功期間 (TTF)
GnP療法 : 5.1ヵ月 vs GEM単独 : 3.6ヵ月
主なGrade3/4有害事象
GnP療法 : 好中球減少 38%、 疲労 17%、 末梢神経障害 17%、 治療関連死 4%
GEM単独 : 好中球減少 27%、 疲労 7%、 末梢神経障害 1%、 治療関連死 1%
📊 JCOG1407試験³⁾ [局所進行膵癌]
Eur J Cancer. 2023 Mar:181:135-144.
未治療局所進行膵癌 (LAPC) 患者125例を対象に、 mFOLFIRINOXとGnP療法を比較した第II相多施設共同無作為化非盲検比較試験。 主要評価項目は1年生存率、 副次評価項目は全生存期間 (OS)、 無増悪生存期間 (PFS)、 奏効率 (ORR)、 病勢コントロール率 (DCR)、 CA19-9反応率、 安全性など。
1年生存率 (主要評価項目)
mFOLFIRINOX : 77.4% (95%CI 64.9–86.0)
GnP療法 : 82.5% (70.7–89.9)
全生存期間 (OS)
mFOLFIRINOX : 23.0ヵ月 (19.3–29.3)
GnP療法 : 21.3ヵ月 (18.2–24.1)
HR 1.096 (95%CI 0.726–1.654)
無増悪生存期間 (PFS)
mFOLFIRINOX : 11.2ヵ月 (9.9–15.9)
GnP療法 : 9.4ヵ月 (7.4–12.8)
HR 1.359 (95%CI 0.939–1.968)
奏効率 (ORR)
mFOLFIRINOX : 30.9% vs GnP : 42.1%
病勢コントロール率 (DCR)
mFOLFIRINOX : 87.3% vs GnP : 96.5%
CA19-9反応率
mFOLFIRINOX : 57.1% vs GnP : 85.0%
コンバージョン手術率
mFOLFIRINOX : 8.1% vs GnP : 7.8%
主なGrade3/4有害事象
mFOLFIRINOX : 下痢 17.7%、食欲不振 16.1%
GnP療法 : 末梢神経障害 36.5%、 好中球減少 79.4%、 白血球減少 44.4%
発熱性好中球減少 : 8.1% vs 4.8%
治療関連死 : いずれも0%
出典
- Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013 Oct 31;369(18):1691-703. PMID: 24131140
- Phase III Study of ABI-007(Albumin-bound Paclitaxel) Plus Gemcitabine Versus Gemcitabine in Metastatic Adenocarcinoma of the Pancreas. ClinicalTrials.gov. February 16, 2009
- A randomised phase II study of modified FOLFIRINOX versus gemcitabine plus nab-paclitaxel for locally advanced pancreatic cancer (JCOG1407). Eur J Cancer. 2023 Mar:181:135-144. PMID: 36652891
最終更新日 : 2023年7月7日
執筆医 : 神奈川県立がんセンター 消化器内科 小林 智先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

