本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヒト型抗ヒトPD-L1モノクローナル抗体 アベルマブ
*メルクバイオファーマ株式会社の外部サイトへ遷移します
投与スケジュール
JAVELIN Merkel 200試験³⁻⁵⁾のプロトコル

10mg/kgを2週間間隔、 1時間以上かけ点滴静注
バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾ より作図
各プロトコル
投与開始基準
JAVELIN Merkel 200試験³⁻⁵⁾のプロトコル
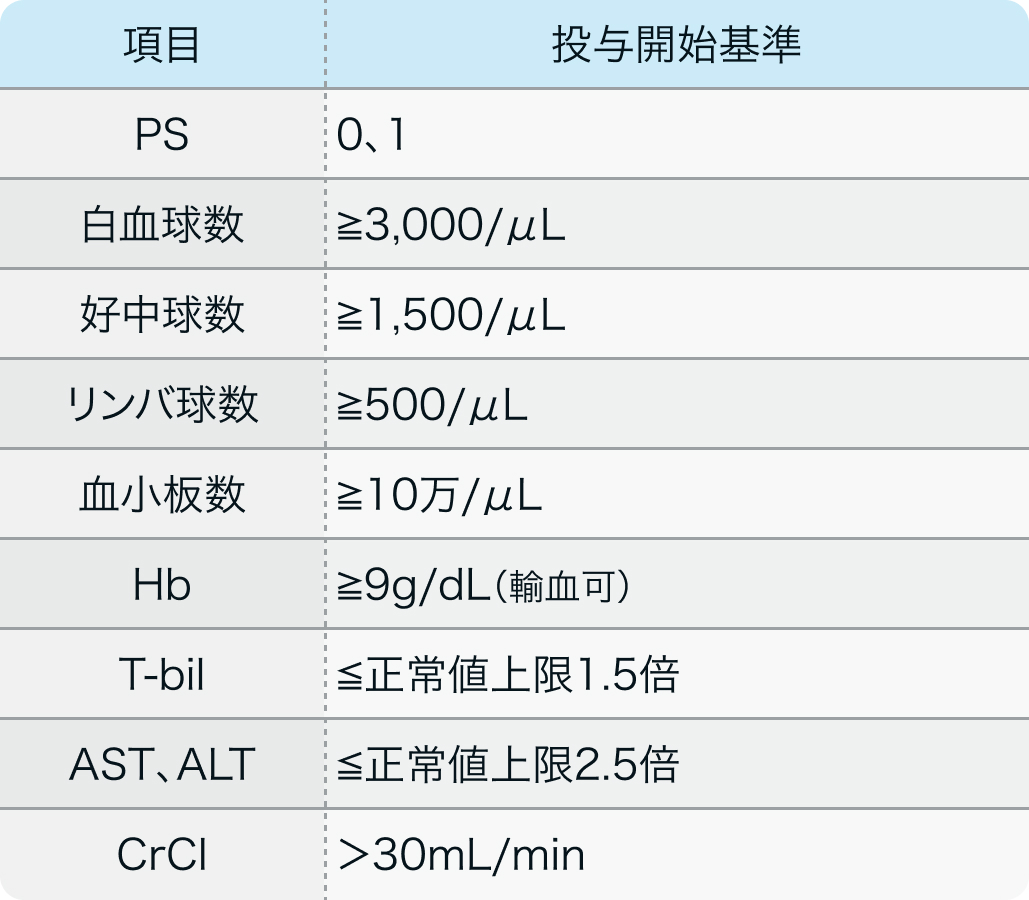
Lancet Oncol. 2016 Oct;17(10):1374-1385.³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準
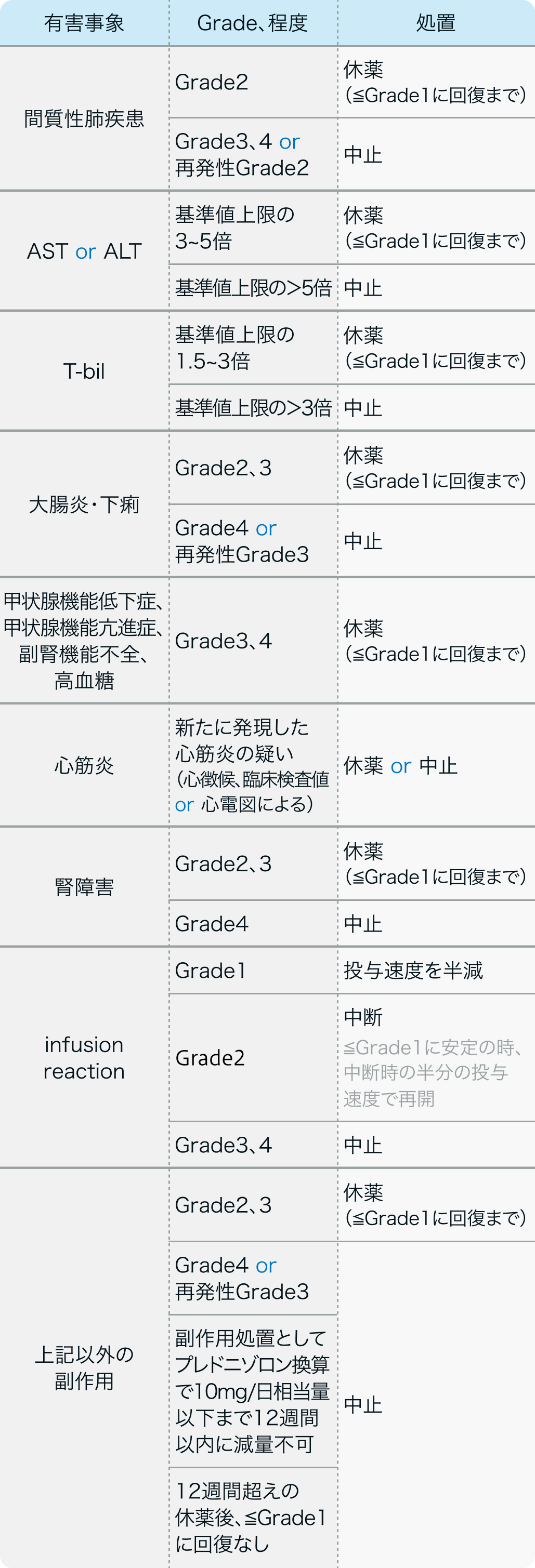
バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾より作図
主な有害事象
JAVELIN Merkel 200試験³⁻⁵⁾
主な有害事象 (カッコ内はGrade3)
- 倦怠感 23.9% (0%)
- Infusion reaction 17% (0%)
- 下痢 9.1% (0%)
- 悪心 9.1% (0%)
- 無力症 8% (0%)
- 発疹 6.8% (0%)
- 食欲減退 5.7% (0%)
- 斑状丘疹 5.7% (0%)
- 高CK血症 2.3% (1.1%)
- リンパ球数減少 2.3% (2.3%)
- 血中コレステロール上昇 1.1% (1.1%)
- AST、 ALT上昇 1.1% (1.1%)
- 甲状腺機能低下症 3.4% (0%)
- 甲状腺機能亢進症 2.3% (0%)
- 肺炎 1.1% (0%)
- 1型糖尿病 1.1% (0%)
Lancet Oncol. 2016 Oct;17(10):1374-1385⁵⁾より引用
エキスパートによるワンポイント
根治切除不能メルケル細胞癌の1次治療
メルケル細胞癌の薬物療法は従来、 同じ神経内分泌腫瘍である小細胞肺癌に準じて殺細胞性抗がん薬が使用されてきた。 直接比較した臨床試験は無いものの、 第II相臨床試験の結果をもって承認されたアベルマブが1次治療となっている。
なお、 アベルマブはヒト型抗ヒトPD-L1モノクローナル抗体であり、 免疫チェックポイント阻害薬に分類される。 自己免疫性疾患などの既往や合併症がある患者には慎重に適応を判断する必要がある。
投与スケジュールと減量について
アベルマブ1回10mg/kgを2週間間隔で1時間以上かけて点滴静注する。 副作用発現時には、 副作用の内容、 CTCAEの重症度に応じて休薬や中止を検討する。
内分泌系の副作用ではホルモンの補充を行いながら継続することも可能であるが、 他の副作用ではGrade2以上の場合は休薬や中止が必要である。 原則、 減量は行わない。 休薬や中止、 再開の判断は適正使用ガイドなどを参考にするが、 他の免疫チェックポイント阻害薬と同様の対応が必要である。
アベルマブ投与によりアナフィラキシー、 発熱、 悪寒、 呼吸困難などのinfusionreactionが現れることがあり、 投与時には緊急対応ができる準備を整える必要がある。 初回投与時に多く見られ、 投与回数が増えると発現例数は減少する。 症状を軽減させるために初回から4回投与までは抗ヒスタミン剤、 解熱鎮痛剤などの前投薬が推奨されている。 Grade1程度で治療中断を要さない場合は投与速度を50%に落として慎重に経過観察するが、 Grade2以上の場合は中断して治療を行い、 症状に応じて再開を検討する。
AVELIN Merkel 200試験の結果
国際共同第II相非盲検試験のJAVELIN Merkel 200試験³⁻⁵⁾はパートAで化学療法既治療の88症例、 パートBで未治療の116例が登録された。 パートAでは奏効率33.0%、 OS中央値12.6ヵ月、 5年OS 26%、 パートBでは奏効率39.7%、 OS中央値20.3ヵ月であった。 治療関連による死亡の報告は無く、 重篤な有害事象の発現割合はパートAで6%、 パートBで14.7%であった。 免疫関連有害事象に加え、 本薬剤で特徴的な副作用にinfusionreactionがあり、 パートAで17%、 パートBで29.3%に見られた。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
出典
- メルクバイオファーマ株式会社. バベンチオ®電子添文 (2023年7月改訂 第8版) [最終閲覧 : 2024/12/09]
- メルクバイオファーマ株式会社. バベンチオ®適正使用ガイド (2023年7月作成) [最終閲覧 : 2024/12/09]
- First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer. 2021 Jul;9(7):e002646. PMID: 34301810
- Avelumab in patients with previously treated metastatic Merkel cell carcinoma (JAVELIN Merkel 200): updated overall survival data after >5 years of follow-up. ESMO Open. 2021 Dec;6(6):100290. PMID: 34715570
- Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol. 2016 Oct;17(10):1374-1385. PMID: 27592805
最終更新日 : 2024年12月9日
監修薬剤師:国立がん研究センター中央病院 腫瘍内科 宇田川 涼子先生
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
Avelumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
ヒト型抗ヒトPD-L1モノクローナル抗体 アベルマブ
*メルクバイオファーマ株式会社の外部サイトへ遷移します
投与スケジュール
JAVELIN Merkel 200試験³⁻⁵⁾のプロトコル

10mg/kgを2週間間隔、 1時間以上かけ点滴静注
バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾ より作図
各プロトコル
投与開始基準
JAVELIN Merkel 200試験³⁻⁵⁾のプロトコル

Lancet Oncol. 2016 Oct;17(10):1374-1385.³⁾より作図
減量・休薬・中止基準
電子添文¹⁾の基準

バベンチオ®電子添文 (2023年7月改訂 第8版)¹⁾より作図
主な有害事象
JAVELIN Merkel 200試験³⁻⁵⁾
主な有害事象 (カッコ内はGrade3)
- 倦怠感 23.9% (0%)
- Infusion reaction 17% (0%)
- 下痢 9.1% (0%)
- 悪心 9.1% (0%)
- 無力症 8% (0%)
- 発疹 6.8% (0%)
- 食欲減退 5.7% (0%)
- 斑状丘疹 5.7% (0%)
- 高CK血症 2.3% (1.1%)
- リンパ球数減少 2.3% (2.3%)
- 血中コレステロール上昇 1.1% (1.1%)
- AST、 ALT上昇 1.1% (1.1%)
- 甲状腺機能低下症 3.4% (0%)
- 甲状腺機能亢進症 2.3% (0%)
- 肺炎 1.1% (0%)
- 1型糖尿病 1.1% (0%)
Lancet Oncol. 2016 Oct;17(10):1374-1385⁵⁾より引用
エキスパートによるワンポイント
根治切除不能メルケル細胞癌の1次治療
メルケル細胞癌の薬物療法は従来、 同じ神経内分泌腫瘍である小細胞肺癌に準じて殺細胞性抗がん薬が使用されてきた。 直接比較した臨床試験は無いものの、 第II相臨床試験の結果をもって承認されたアベルマブが1次治療となっている。
なお、 アベルマブはヒト型抗ヒトPD-L1モノクローナル抗体であり、 免疫チェックポイント阻害薬に分類される。 自己免疫性疾患などの既往や合併症がある患者には慎重に適応を判断する必要がある。
投与スケジュールと減量について
アベルマブ1回10mg/kgを2週間間隔で1時間以上かけて点滴静注する。 副作用発現時には、 副作用の内容、 CTCAEの重症度に応じて休薬や中止を検討する。
内分泌系の副作用ではホルモンの補充を行いながら継続することも可能であるが、 他の副作用ではGrade2以上の場合は休薬や中止が必要である。 原則、 減量は行わない。 休薬や中止、 再開の判断は適正使用ガイドなどを参考にするが、 他の免疫チェックポイント阻害薬と同様の対応が必要である。
アベルマブ投与によりアナフィラキシー、 発熱、 悪寒、 呼吸困難などのinfusionreactionが現れることがあり、 投与時には緊急対応ができる準備を整える必要がある。 初回投与時に多く見られ、 投与回数が増えると発現例数は減少する。 症状を軽減させるために初回から4回投与までは抗ヒスタミン剤、 解熱鎮痛剤などの前投薬が推奨されている。 Grade1程度で治療中断を要さない場合は投与速度を50%に落として慎重に経過観察するが、 Grade2以上の場合は中断して治療を行い、 症状に応じて再開を検討する。
AVELIN Merkel 200試験の結果
国際共同第II相非盲検試験のJAVELIN Merkel 200試験³⁻⁵⁾はパートAで化学療法既治療の88症例、 パートBで未治療の116例が登録された。 パートAでは奏効率33.0%、 OS中央値12.6ヵ月、 5年OS 26%、 パートBでは奏効率39.7%、 OS中央値20.3ヵ月であった。 治療関連による死亡の報告は無く、 重篤な有害事象の発現割合はパートAで6%、 パートBで14.7%であった。 免疫関連有害事象に加え、 本薬剤で特徴的な副作用にinfusionreactionがあり、 パートAで17%、 パートBで29.3%に見られた。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
出典
- メルクバイオファーマ株式会社. バベンチオ®電子添文 (2023年7月改訂 第8版) [最終閲覧 : 2024/12/09]
- メルクバイオファーマ株式会社. バベンチオ®適正使用ガイド (2023年7月作成) [最終閲覧 : 2024/12/09]
- First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer. 2021 Jul;9(7):e002646. PMID: 34301810
- Avelumab in patients with previously treated metastatic Merkel cell carcinoma (JAVELIN Merkel 200): updated overall survival data after >5 years of follow-up. ESMO Open. 2021 Dec;6(6):100290. PMID: 34715570
- Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol. 2016 Oct;17(10):1374-1385. PMID: 27592805
最終更新日 : 2024年12月9日
監修薬剤師:国立がん研究センター中央病院 腫瘍内科 宇田川 涼子先生
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。