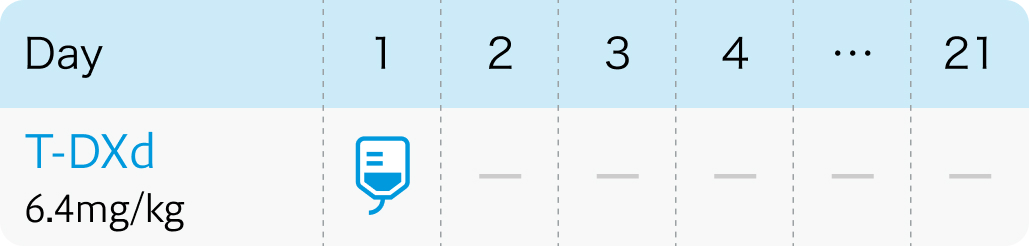
T-DXd:Trastuzumab deruxtecan(エンハーツ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 6.4mg/kg(体重) 点滴 | 1~ | Day1 |
前投薬
| NCCNガイドラインでは高度催吐性、 2023年10月改訂の国内ガイドラインでは中等度催吐性として扱われている。 |
| 制吐薬として、 3剤併用 (NK1拮抗薬+5HT3拮抗薬+ステロイド) が用いられていることがある。 |
その他
| 1コース21日間 |
| 通常、 成人には1回6.4mg/kg (体重) を90分かけて3週間間隔で点滴静注する。 なお、 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*第一三共株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量
1回6.4mg/kgを90分かけて3週間間隔で点滴静注する。 なお、 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。
エンハーツ®電子添文 (2024年4月改訂 第10版)¹⁾より作図、 引用
催吐性と前投薬
NCCNガイドライン⁴⁾では高度催吐性、 2023年10月改訂の国内ガイドライン⁵⁾では中等度催吐性として扱われている。 制吐薬として、 NK1拮抗薬や5HT3拮抗薬、 ステロイド、 それらの併用を投与することがある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
減量・休薬・中止基準
電子添付文書¹⁾の基準
(NCI-CTCAE ver.5.0)
1) 間質性肺疾患
- Grade1 : 投与中止し、 原則再開しない
ただし、 すべての所見が消失し、 かつ治療上の有益性が危険性を大きく上回ると判断された場合のみ、 1用量レベル減量して投与再開こともでき、 再発した場合は、 投与を中止する
- Grade2~4 : 投与中止
2) 左室駆出率 (LVEF) 低下
- 40%≦LVEF≦45%・ベースラインからの絶対値の低下<10% : 休薬を考慮し、 3週間以内に再測定を行い、 LVEFを確認する。
- 40%≦LVEF≦45%・10%≦ベースラインからの絶対値の低下≦20% : 休薬し、 3週間以内に再測定を行い、 LVEFのベースラインからの絶対値の低下<10%に回復しない場合は、 投与中止
- LVEF<40%又はLVEFのベースラインからの絶対値の低下>20% : 休薬し、 3週間以内に再測定を行い、 再度LVEF<40%又はベースラインからの絶対値の低下>20%が認められた場合は、 投与中止
3) 症候性うっ血性心不全
- 投与中止
4) QT間隔延長
- Grade3 : Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
- Grade4 : 投与中止
5) Infusion reaction
- Grade1 : 投与速度を50%減速し、 他の症状が出現しない場合は、 次回以降は元の速度で投与
- Grade2 : Grade1以下に回復まで投与中断
再開する場合は投与速度を50%減速し、 次回以降も減速した速度で投与する
- Grade3~4 : 投与中止
6) 好中球数減少
- Grade3 : Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量又は同一用量で投与再開
- Grade4 : Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
7) 発熱性好中球減少症
- 回復するまで休薬し、 回復後、 1用量レベル減量して投与再開
8) 貧血
- Grade3 : Grade2以下に回復まで休薬し、 回復後、 同一用量で投与再開
- Grade4 : Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
9) 血小板数減少
- Grade3 : Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4 : Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
10) 総ビリルビン増加
- Grade2 : Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade3 : Grade1以下に回復まで休薬
7日以内に回復した場合、 1用量レベル減量して投与再開し、 7日を過ぎてから回復した場合、 投与を中止する
- Grade4 : 投与中止
11) 下痢又は大腸炎
- Grade3 : Grade1以下に回復まで休薬
3日以内に回復した場合、 同一用量で投与再開し、 3日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4 : 投与中止
12) 前記以外の副作用
- Grade3 : Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4 : 投与中止
初回基準量と減量レベル

4.4mg/kgで忍容性が得られない場合、 中止
エンハーツ®電子添文 (2024年4月改訂 第10版)¹⁾より引用
主な有害事象
主な有害事象 (カッコ内はGrade3~4)
- 悪心 63.2% (4.8%)
- 好中球数減少 63.2% (51.2%)
- 食欲低下 60.0% (16.8%)
- 貧血 57.6% (37.6%)
- 血小板数減少 39.2% (11.2%)
- 白血球数減少 37.6% (20.8%)
- 下痢 32.0% (2.4%)
- 嘔吐 26.4% (0%)
- 便秘 24.0% (0%)
- 発熱 24.0% (0%)
- 倦怠感 21.6% (7.2%)
- リンパ球数減少 21.6% (11.2%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症22.4% (0%)
N Engl J Med. 2020 Jun 18;382(25):2419-2430³⁾より引用
特徴と注意点
胃癌の適応
電子化された添付文書の記載は 「がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の胃癌」である。
T-DXdについて
ヒトHER2を標的とした抗体薬物複合体 (ADC)。 抗HER2ヒト化モノクローナル抗体とトポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体 (DXd) を、 腫瘍細胞内切断型ペプチド含有リンカーを介して結合した薬剤。
T-mab後はHER2陽性の再確認を検討
T-mab (トラスツズマブ: ハーセプチン®) 治療後の生検でHER2陰性だった場合に効果が乏しい可能性がある。 ILD発症リスクが高いと想定される場合は、 可能であれば再生検を実施しHER2陽性を確認する。
副作用マネジメント
アンスラサイクリン系の投与歴、 胸部への放射線照射の治療歴、 心疾患合併又は既往歴のある患者では心機能低下が起こるおそれがあるため、 投与に際しては特に注意が必要。 投与開始前に心機能検査 (心エコー等) を必ず実施し、 左室駆出率 (LVEF) を含む心機能を確認する。
間質性肺疾患のある患者又はその既往歴のある患者では間質性肺疾患が発現又は増悪し、 死亡に至る可能性があるため投与に際し、 特に注意が必要。 投与開始前に必ず胸部CT検査、 胸部X線検査、 動脈血酸素飽和度 (SpO₂) 検査及び問診を実施する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
📊第Ⅱ相試験 (DESTINY-Gastric01)³⁾
治療歴のあるHER2陽性胃がんまたは胃食道接合部腺癌患者を対象に、 トラスツズマブ デルクステカンと化学療法を比較した非盲検無作為化第Ⅱ相試験。 主要評価項目は客観的奏効、 副次評価項目を全生存期間 (OS)、 奏効期間、 無増悪生存期間 (PFS)、 4週以上持続する奏効、 安全性とされた。
NEJM. 2020 Jun 18;382(25):2419-2430.
出典
1) 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2025年8月改訂 第12版
2) 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2025年8月改訂
4) NCCN guidelines. Antiemesis Version 2.2023
5) 日本癌治療学会. 制吐薬適正使用ガイドライン 2023年10月改訂 第3版. 金原出版 2023
最終更新日 : 2025年9月11日
監修医師 : HOKUTO編集部 医師
T-DXd (Trastuzumab deruxtecan)
T-DXd:Trastuzumab deruxtecan(エンハーツ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 6.4mg/kg(体重) 点滴 | 1~ | Day1 |
前投薬
| NCCNガイドラインでは高度催吐性、 2023年10月改訂の国内ガイドラインでは中等度催吐性として扱われている。 |
| 制吐薬として、 3剤併用 (NK1拮抗薬+5HT3拮抗薬+ステロイド) が用いられていることがある。 |
その他
| 1コース21日間 |
| 通常、 成人には1回6.4mg/kg (体重) を90分かけて3週間間隔で点滴静注する。 なお、 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*第一三共株式会社の外部サイトへ遷移します
用法用量
電子添文¹⁾の用法および用量

1回6.4mg/kgを90分かけて3週間間隔で点滴静注する。 なお、 初回投与の忍容性が良好であれば2回目以降の投与時間は30分間まで短縮できる。
エンハーツ®電子添文 (2024年4月改訂 第10版)¹⁾より作図、 引用
催吐性と前投薬
NCCNガイドライン⁴⁾では高度催吐性、 2023年10月改訂の国内ガイドライン⁵⁾では中等度催吐性として扱われている。 制吐薬として、 NK1拮抗薬や5HT3拮抗薬、 ステロイド、 それらの併用を投与することがある。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
減量・休薬・中止基準
電子添付文書¹⁾の基準
(NCI-CTCAE ver.5.0)
1) 間質性肺疾患
- Grade1 : 投与中止し、 原則再開しない
ただし、 すべての所見が消失し、 かつ治療上の有益性が危険性を大きく上回ると判断された場合のみ、 1用量レベル減量して投与再開こともでき、 再発した場合は、 投与を中止する
- Grade2~4 : 投与中止
2) 左室駆出率 (LVEF) 低下
- 40%≦LVEF≦45%・ベースラインからの絶対値の低下<10% : 休薬を考慮し、 3週間以内に再測定を行い、 LVEFを確認する。
- 40%≦LVEF≦45%・10%≦ベースラインからの絶対値の低下≦20% : 休薬し、 3週間以内に再測定を行い、 LVEFのベースラインからの絶対値の低下<10%に回復しない場合は、 投与中止
- LVEF<40%又はLVEFのベースラインからの絶対値の低下>20% : 休薬し、 3週間以内に再測定を行い、 再度LVEF<40%又はベースラインからの絶対値の低下>20%が認められた場合は、 投与中止
3) 症候性うっ血性心不全
- 投与中止
4) QT間隔延長
- Grade3 : Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
- Grade4 : 投与中止
5) Infusion reaction
- Grade1 : 投与速度を50%減速し、 他の症状が出現しない場合は、 次回以降は元の速度で投与
- Grade2 : Grade1以下に回復まで投与中断
再開する場合は投与速度を50%減速し、 次回以降も減速した速度で投与する
- Grade3~4 : 投与中止
6) 好中球数減少
- Grade3 : Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量又は同一用量で投与再開
- Grade4 : Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
7) 発熱性好中球減少症
- 回復するまで休薬し、 回復後、 1用量レベル減量して投与再開
8) 貧血
- Grade3 : Grade2以下に回復まで休薬し、 回復後、 同一用量で投与再開
- Grade4 : Grade2以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
9) 血小板数減少
- Grade3 : Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4 : Grade1以下に回復まで休薬し、 回復後、 1用量レベル減量して投与再開
10) 総ビリルビン増加
- Grade2 : Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade3 : Grade1以下に回復まで休薬
7日以内に回復した場合、 1用量レベル減量して投与再開し、 7日を過ぎてから回復した場合、 投与を中止する
- Grade4 : 投与中止
11) 下痢又は大腸炎
- Grade3 : Grade1以下に回復まで休薬
3日以内に回復した場合、 同一用量で投与再開し、 3日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4 : 投与中止
12) 前記以外の副作用
- Grade3 : Grade1以下に回復まで休薬
7日以内に回復した場合、 同一用量で投与再開し、 7日を過ぎてから回復した場合、 1用量レベル減量して投与再開
- Grade4 : 投与中止
初回基準量と減量レベル

4.4mg/kgで忍容性が得られない場合、 中止
エンハーツ®電子添文 (2024年4月改訂 第10版)¹⁾より引用
主な有害事象
主な有害事象 (カッコ内はGrade3~4)
- 悪心 63.2% (4.8%)
- 好中球数減少 63.2% (51.2%)
- 食欲低下 60.0% (16.8%)
- 貧血 57.6% (37.6%)
- 血小板数減少 39.2% (11.2%)
- 白血球数減少 37.6% (20.8%)
- 下痢 32.0% (2.4%)
- 嘔吐 26.4% (0%)
- 便秘 24.0% (0%)
- 発熱 24.0% (0%)
- 倦怠感 21.6% (7.2%)
- リンパ球数減少 21.6% (11.2%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症22.4% (0%)
N Engl J Med. 2020 Jun 18;382(25):2419-2430³⁾より引用
特徴と注意点
胃癌の適応
電子化された添付文書の記載は 「がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の胃癌」である。
T-DXdについて
ヒトHER2を標的とした抗体薬物複合体 (ADC)。 抗HER2ヒト化モノクローナル抗体とトポイソメラーゼⅠ阻害作用を有するカンプトテシン誘導体 (DXd) を、 腫瘍細胞内切断型ペプチド含有リンカーを介して結合した薬剤。
T-mab後はHER2陽性の再確認を検討
T-mab (トラスツズマブ: ハーセプチン®) 治療後の生検でHER2陰性だった場合に効果が乏しい可能性がある。 ILD発症リスクが高いと想定される場合は、 可能であれば再生検を実施しHER2陽性を確認する。
副作用マネジメント
アンスラサイクリン系の投与歴、 胸部への放射線照射の治療歴、 心疾患合併又は既往歴のある患者では心機能低下が起こるおそれがあるため、 投与に際しては特に注意が必要。 投与開始前に心機能検査 (心エコー等) を必ず実施し、 左室駆出率 (LVEF) を含む心機能を確認する。
間質性肺疾患のある患者又はその既往歴のある患者では間質性肺疾患が発現又は増悪し、 死亡に至る可能性があるため投与に際し、 特に注意が必要。 投与開始前に必ず胸部CT検査、 胸部X線検査、 動脈血酸素飽和度 (SpO₂) 検査及び問診を実施する。
監修 : 神奈川県立がんセンター消化器内科部長 町田望先生
関連する臨床試験
📊第Ⅱ相試験 (DESTINY-Gastric01)³⁾
治療歴のあるHER2陽性胃がんまたは胃食道接合部腺癌患者を対象に、 トラスツズマブ デルクステカンと化学療法を比較した非盲検無作為化第Ⅱ相試験。 主要評価項目は客観的奏効、 副次評価項目を全生存期間 (OS)、 奏効期間、 無増悪生存期間 (PFS)、 4週以上持続する奏効、 安全性とされた。
NEJM. 2020 Jun 18;382(25):2419-2430.
出典
1) 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2025年8月改訂 第12版
2) 第一三共株式会社 エンハーツ®︎ 適正使用ガイド 2025年8月改訂
4) NCCN guidelines. Antiemesis Version 2.2023
5) 日本癌治療学会. 制吐薬適正使用ガイドライン 2023年10月改訂 第3版. 金原出版 2023
最終更新日 : 2025年9月11日
監修医師 : HOKUTO編集部 医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
