IXA:イキサゾミブ(ニンラーロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 3mg 1日1回 経口 | 1~4 | Day 1、8、15 |
| 4mg 1日1回 経口 | 5~ | Day 1、8、15 |
その他
| 1コースは28日間. |
| イキサゾミブは、 1日1回 空腹時に内服. |
| サイクル1~4で忍容性が良好な場合、サイクル5から4mgに増量 |
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*武田薬品工業株式会社の外部サイトへ遷移します。
投与スケジュール
多発性骨髄腫における維持療法
【1コース】28日間
【催吐性】 軽度
【FN発症】不明*
*TOURMALINE-MM4試験³⁾では未報告
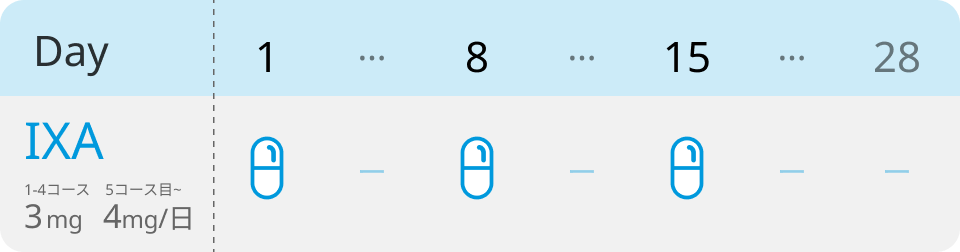
空腹時に週1回、 3週間 (1、 8及び15日目) 経口投与後、 13日間休薬 (16~28日目) する。 この4週間を1サイクルとし、 投与を繰り返す。 4サイクルまでは3mg、 5サイクル以降は4mgとする。
Key Data|臨床試験結果
📊 TOURMALINE-MM4試験³⁾
J Clin Oncol. 2020;38(34):4030-4041.
自家造血幹細胞移植 (ASCT) の適応とならない、 またはASCTを希望せず、 標準的な導入療法を6~12ヵ月間受けた後に部分奏効 (PR) 以上の奏効を達成した新規診断多発性骨髄腫 (NDMM) 患者706例を対象とした第III相二重盲検プラセボ対照試験。 患者はixazomib群 (425例) またはプラセボ群 (281例) に3:2の割合で無作為に割り付けられ、 主要評価項目として無増悪生存期間 (PFS) が設定された。
【有効性】 (Ixazomib群)
- PFS中央値 : 17.4ヵ月
導入療法後に完全奏効 (CR) または最良部分奏効 (VGPR) を達成した患者のPFS中央値 : 25.6ヵ月
- 進行までの期間中央値 : 17.8ヵ月
- 維持療法中の奏効改善率 (VGPR/PRから改善した患者の割合) : 14.6%
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 胃腸障害 52.1% (5.2%)
- 悪心 26.8% (0.5%)
- 嘔吐 24.2% (1.6%)
- 下痢 23.2% (1.9%)
- 感染症および寄生虫症 48.4% (6.6%)
- 上気道感染 15.7% (0.5%)
- 発疹 25.6% (2.8%)
- 末梢性ニューロパチー 19.5% (1.6%)
- 背部痛 14.3% (0.2%)
- 関節痛 11.5% (0.5%)
- 発熱 11.3% (0.2%)
- 疲労 10.8% (1.4%)
- 血小板減少症 4.7% (2.1%)
- 好中球減少症 2.3% (2.1%)
- 不整脈 4.2% (1.4%)
- 心不全 1.2% (0.5%)
- 低血圧 2.3% (0%)
- 肝機能障害 4.5% (1.4%)
- 心筋梗塞 0.2% (0.2%)
- 腎機能障害 3.8% (1.9%)
- 帯状疱疹 3.1% (0.2%)
予防あり0.4% (0%)、 予防なし7.9% (0.7%)
- 二次癌 5.2%
各プロトコル
TOURMALINE-MM4試験³⁾の主な適格基準
- 18歳以上
- 6~12ヵ月の標準導入療法後にPR以上の効果が得られた患者
- ECOG PS 0–2
- 好中球数 ≧1,000/mm³ (G-CSFなし)
- 血小板数 ≧75,000/mm³
- 総ビリルビン ≦1.5 × ULN
- ALT及びAST ≦3 × ULN
- クレアチニンクリアランス ≧30mL/min
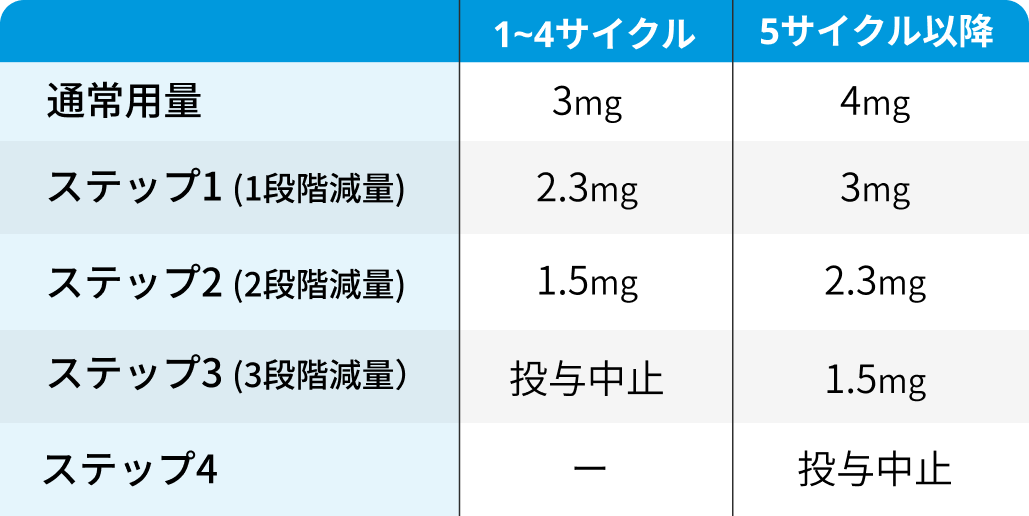
用量レベル¹⁾²⁾³⁾
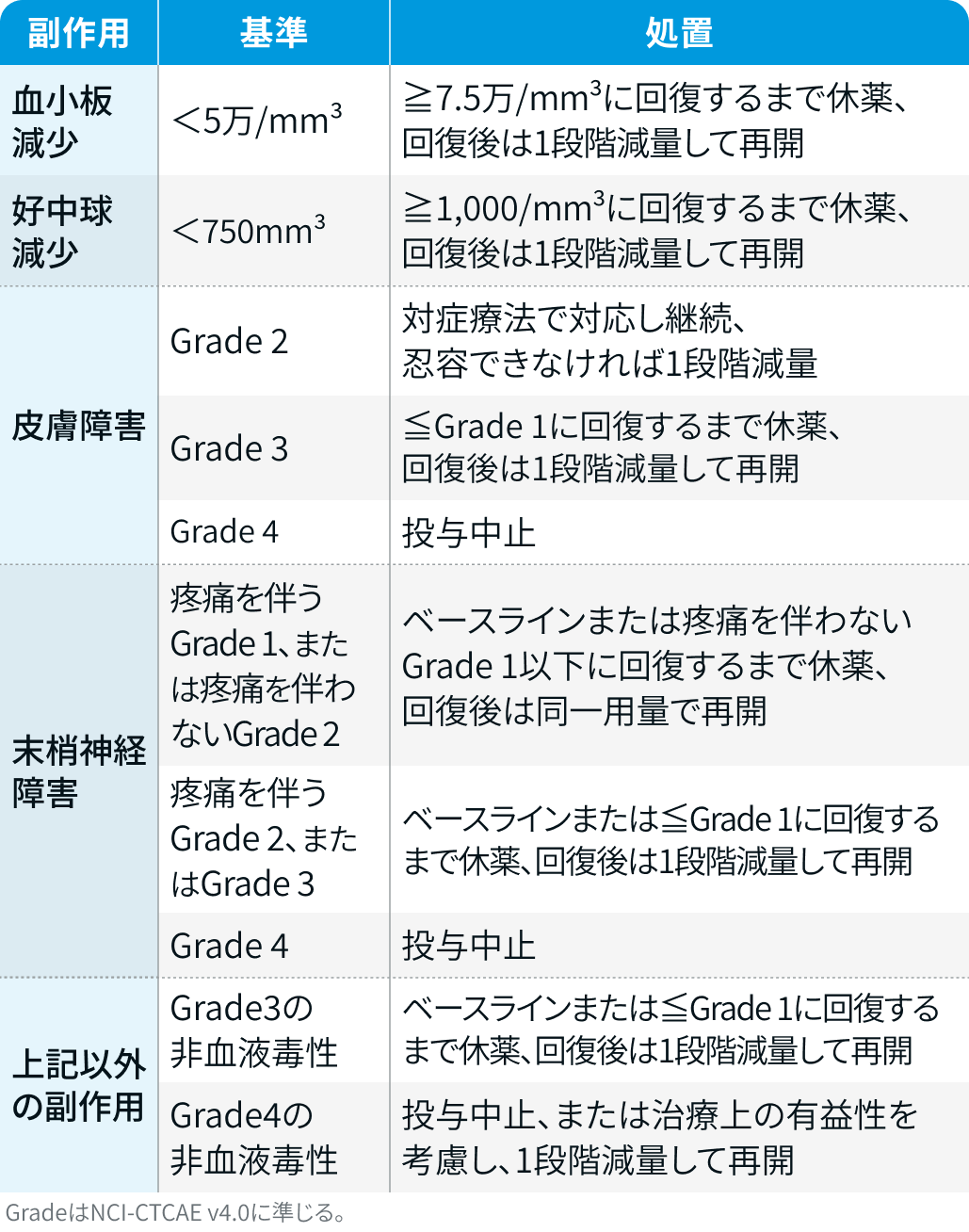
休薬・減量・中止基準¹⁾²⁾³⁾
レジメンの特徴と注意点
- 高脂肪食により血中濃度が低下するため、 食前1時間以上または食後2時間以上の空腹時に服用するよう指導
- 規定服用日に飲み忘れた場合は、 次回服用まで72時間以上あれば、 気づいた時点で服用するよう指導
- 帯状疱疹予防のため、 抗ヘルペスウイルス薬の予防投与を推奨
- 消化器系副作用発現時は、 止瀉薬・制吐薬の使用を検討
- 中等度以上の肝機能障害や重度腎機能障害では血中濃度上昇により副作用リスクが高まるため、 慎重な観察と有害事象への注意が必要

出典
- 武田薬品工業株式会社. ニンラーロ®カプセル0.5mg/2.3mg/3mg/4mg 電子添文 2024年11月作成 (第6版) [最終確認: 2025/5/9]
- 武田薬品工業株式会社. ニンラーロ®カプセル0.5mg/2.3mg/3mg/4mg 適正使用ガイド 2024年11月作成 [最終確認: 2025/5/9]
- J Clin Oncol. 2020;38(34):4030-4041.
- U.S. Food and Drug Administration. NINLARO® (ixazomib) capsules, for oral use. Initial U.S. Approval: 2015. Full prescribing information. [最終確認: 2025/5/9]
最終更新 : 2025年5月9日
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
IXA maintenance
IXA:イキサゾミブ(ニンラーロ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 3mg 1日1回 経口 | 1~4 | Day 1、8、15 |
| 4mg 1日1回 経口 | 5~ | Day 1、8、15 |
その他
| 1コースは28日間. |
| イキサゾミブは、 1日1回 空腹時に内服. |
| サイクル1~4で忍容性が良好な場合、サイクル5から4mgに増量 |
概要
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*武田薬品工業株式会社の外部サイトへ遷移します。
投与スケジュール
多発性骨髄腫における維持療法
【1コース】28日間
【催吐性】 軽度
【FN発症】不明*
*TOURMALINE-MM4試験³⁾では未報告

空腹時に週1回、 3週間 (1、 8及び15日目) 経口投与後、 13日間休薬 (16~28日目) する。 この4週間を1サイクルとし、 投与を繰り返す。 4サイクルまでは3mg、 5サイクル以降は4mgとする。
Key Data|臨床試験結果
📊 TOURMALINE-MM4試験³⁾
J Clin Oncol. 2020;38(34):4030-4041.
自家造血幹細胞移植 (ASCT) の適応とならない、 またはASCTを希望せず、 標準的な導入療法を6~12ヵ月間受けた後に部分奏効 (PR) 以上の奏効を達成した新規診断多発性骨髄腫 (NDMM) 患者706例を対象とした第III相二重盲検プラセボ対照試験。 患者はixazomib群 (425例) またはプラセボ群 (281例) に3:2の割合で無作為に割り付けられ、 主要評価項目として無増悪生存期間 (PFS) が設定された。
【有効性】 (Ixazomib群)
- PFS中央値 : 17.4ヵ月
導入療法後に完全奏効 (CR) または最良部分奏効 (VGPR) を達成した患者のPFS中央値 : 25.6ヵ月
- 進行までの期間中央値 : 17.8ヵ月
- 維持療法中の奏効改善率 (VGPR/PRから改善した患者の割合) : 14.6%
【安全性】主な有害事象 : 全Grade (Grade≧3)
- 胃腸障害 52.1% (5.2%)
- 悪心 26.8% (0.5%)
- 嘔吐 24.2% (1.6%)
- 下痢 23.2% (1.9%)
- 感染症および寄生虫症 48.4% (6.6%)
- 上気道感染 15.7% (0.5%)
- 発疹 25.6% (2.8%)
- 末梢性ニューロパチー 19.5% (1.6%)
- 背部痛 14.3% (0.2%)
- 関節痛 11.5% (0.5%)
- 発熱 11.3% (0.2%)
- 疲労 10.8% (1.4%)
- 血小板減少症 4.7% (2.1%)
- 好中球減少症 2.3% (2.1%)
- 不整脈 4.2% (1.4%)
- 心不全 1.2% (0.5%)
- 低血圧 2.3% (0%)
- 肝機能障害 4.5% (1.4%)
- 心筋梗塞 0.2% (0.2%)
- 腎機能障害 3.8% (1.9%)
- 帯状疱疹 3.1% (0.2%)
予防あり0.4% (0%)、 予防なし7.9% (0.7%)
- 二次癌 5.2%
各プロトコル
TOURMALINE-MM4試験³⁾の主な適格基準
- 18歳以上
- 6~12ヵ月の標準導入療法後にPR以上の効果が得られた患者
- ECOG PS 0–2
- 好中球数 ≧1,000/mm³ (G-CSFなし)
- 血小板数 ≧75,000/mm³
- 総ビリルビン ≦1.5 × ULN
- ALT及びAST ≦3 × ULN
- クレアチニンクリアランス ≧30mL/min
用量レベル¹⁾²⁾³⁾

休薬・減量・中止基準¹⁾²⁾³⁾

レジメンの特徴と注意点
- 高脂肪食により血中濃度が低下するため、 食前1時間以上または食後2時間以上の空腹時に服用するよう指導
- 規定服用日に飲み忘れた場合は、 次回服用まで72時間以上あれば、 気づいた時点で服用するよう指導
- 帯状疱疹予防のため、 抗ヘルペスウイルス薬の予防投与を推奨
- 消化器系副作用発現時は、 止瀉薬・制吐薬の使用を検討
- 中等度以上の肝機能障害や重度腎機能障害では血中濃度上昇により副作用リスクが高まるため、 慎重な観察と有害事象への注意が必要

出典
- 武田薬品工業株式会社. ニンラーロ®カプセル0.5mg/2.3mg/3mg/4mg 電子添文 2024年11月作成 (第6版) [最終確認: 2025/5/9]
- 武田薬品工業株式会社. ニンラーロ®カプセル0.5mg/2.3mg/3mg/4mg 適正使用ガイド 2024年11月作成 [最終確認: 2025/5/9]
- J Clin Oncol. 2020;38(34):4030-4041.
- U.S. Food and Drug Administration. NINLARO® (ixazomib) capsules, for oral use. Initial U.S. Approval: 2015. Full prescribing information. [最終確認: 2025/5/9]
最終更新 : 2025年5月9日
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
