治療スケジュール
概要
監修医師
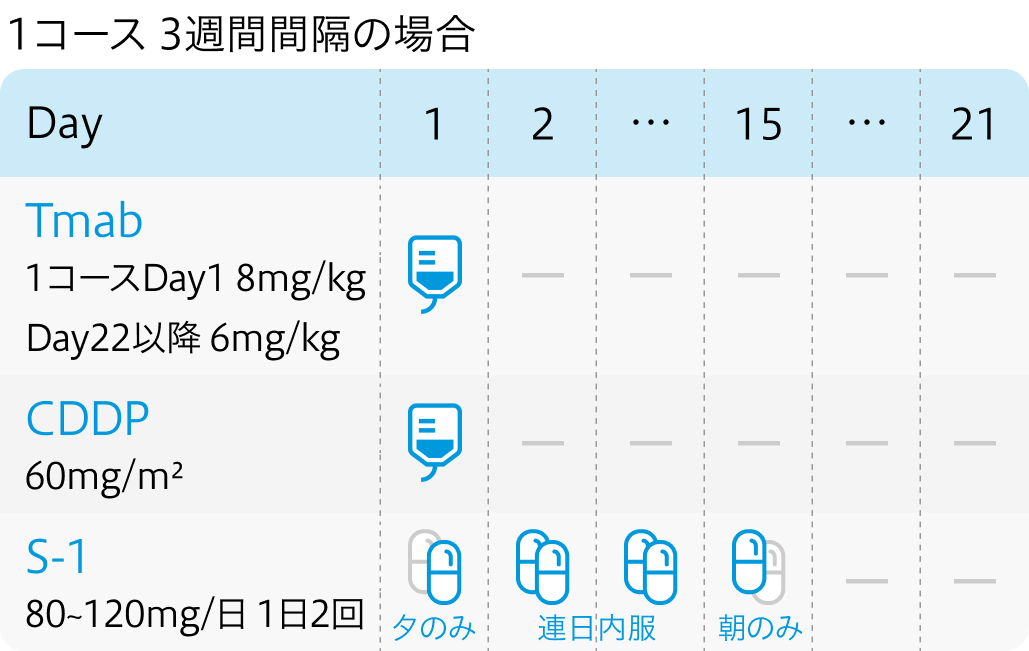
S-1:テガフール・ギメラシル・オテラシルカリウム(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/m² 経口分2 朝夕食後 | 1~ | day1夕~22朝 |
CDDP:シスプラチン(シスプラチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 60mg/m² 点滴 | 1~ | Day8 |
Tmab:トラスツズマブ(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1 | Day1 |
| 6mg/kg 点滴 | 2~ | Day1 |
その他
| S-1+シスプラチンをSP療法と呼ぶ。 |
| 1コース21日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
用法用量
前投薬
悪心・嘔吐予防
Day1:デキサメタゾン3.3mg/mL 3mL+パロノセトロン0.75mg 50mL
経口NK1受容体拮抗薬(Day2-3にも投与)もしくは静注NK1受容体拮抗薬
Day2-4:デキサメタゾン注射液3.3mg/mL 2mL
Day1-4:オランザピン5mg 1錠
投与開始基準
HERBIS-1試験¹⁾より抜粋

減量・休薬基準
HERBIS-1試験¹⁾より抜粋

主な有害事象
HERBIS-1試験¹⁾
試験の有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 白血球減少症 73.6% (7.5%)
- 好中球減少症 60.4% (35.8%)
- 発熱性好中球減少症 3.8% (3.8%)
- 貧血 66.0% (15.1%)
- 血小板減少症 49.1% (0%)
- 倦怠感 64.2% (3.8%)
- 悪心 62.3% (1.9%)
- 下痢 39.6% (7.5%)
- 口腔粘膜炎 32.1% (1.9%)
- 嘔吐 24.5% (5.7%)
- ALT上昇 24.5% (0%)
- 便秘 20.8% (0%)
- AST上昇 17.0% (0%)
- 発熱 7.5% (0%)
注意すべき有害事象
- 高血圧 41.5% (1.9%)
- 末梢感覚神経障害 11.3% (0%)
- 脱毛症 5.7% (0%)
上手に使うためのワンポイント
- 末梢神経障害を回避したい症例には良い適応であるが、 CDDPも漫然と投与するとオキサリプラチン同様、 末梢神経障害が生じるため注意が必要。
- 腎保護のため、 大量補液を要するため、 大量腹水を有する症例には不向きである。
- ステロイドを含む制吐剤をトラスツズマブ投与前に投与することで、 インフュージョンリアクションを予防できる事もある。
特徴と注意点
- 胃癌治療ガイドライン²⁾では、 1次治療の標準治療の1つである。
- S-1特有の有害事象として流涙がある。 流涙の予防には1日5〜6回の人工涙液の点眼が有効である。 休薬期間中も忘れずに点眼するように指導しておく。 防腐剤フリーの点眼薬が望ましい。 著者の施設ではソフトサンティア®を購入いただいている。
- 稀ではあるが、 角膜障害を生じることがあるため、 視力低下を訴える場合は必ず眼科へコンサルトする。
- シスプラチンの腎毒性のため、 CrCl< 50mL/minは禁忌である。
- 5週毎のレジメンと異なり、 シスプラチンのdose intensityが高くなるため、 毒性に注意。
- トラスツズマブは心毒性を有する。 治療開始前に心エコーを実施し、 LVEF<50%の症例には投与しない。 おおよそ3ヵ月程度の間隔で、 心エコーで心機能のスクリーニングを行う。
関連する臨床試験
HERBIS-1試験¹⁾
ヒト上皮成長因子受容体2型 (HER2) 陽性AGC患者におけるトラスツズマブとSPの併用の有効性と安全性を評価するための第Ⅱ相試験。 主要評価項目は奏効率 (RR) で、 副次評価項目は全生存期間 (OS) 、 無増悪生存期間 (PFS) 、 治療失敗までの時間 (TTF) 、 有害事象が含まれた。
Br J Cancer. 2014 Mar 4;110(5):1163-8.
出典
- Phase II study of trastuzumab in combination with S-1 plus cisplatin in HER2-positive gastric cancer (HERBIS-1). Br J Cancer. 2014 Mar 4;110(5):1163-8. PMID: 24473399
- 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日:2023年9月14日
執筆医:静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
SP+T-mab(3週)
S-1+シスプラチン+トラスツズマブ
2024年08月06日更新
S-1:テガフール・ギメラシル・オテラシルカリウム(ティーエスワン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 80~120mg/m² 経口分2 朝夕食後 | 1~ | day1夕~22朝 |
CDDP:シスプラチン(シスプラチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 60mg/m² 点滴 | 1~ | Day8 |
Tmab:トラスツズマブ(ハーセプチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1 | Day1 |
| 6mg/kg 点滴 | 2~ | Day1 |
その他
| S-1+シスプラチンをSP療法と呼ぶ。 |
| 1コース21日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
用法用量

前投薬
悪心・嘔吐予防
Day1:デキサメタゾン3.3mg/mL 3mL+パロノセトロン0.75mg 50mL
経口NK1受容体拮抗薬(Day2-3にも投与)もしくは静注NK1受容体拮抗薬
Day2-4:デキサメタゾン注射液3.3mg/mL 2mL
Day1-4:オランザピン5mg 1錠
投与開始基準
HERBIS-1試験¹⁾より抜粋

減量・休薬基準
HERBIS-1試験¹⁾より抜粋

主な有害事象
HERBIS-1試験¹⁾
試験の有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- 白血球減少症 73.6% (7.5%)
- 好中球減少症 60.4% (35.8%)
- 発熱性好中球減少症 3.8% (3.8%)
- 貧血 66.0% (15.1%)
- 血小板減少症 49.1% (0%)
- 倦怠感 64.2% (3.8%)
- 悪心 62.3% (1.9%)
- 下痢 39.6% (7.5%)
- 口腔粘膜炎 32.1% (1.9%)
- 嘔吐 24.5% (5.7%)
- ALT上昇 24.5% (0%)
- 便秘 20.8% (0%)
- AST上昇 17.0% (0%)
- 発熱 7.5% (0%)
注意すべき有害事象
- 高血圧 41.5% (1.9%)
- 末梢感覚神経障害 11.3% (0%)
- 脱毛症 5.7% (0%)
上手に使うためのワンポイント
- 末梢神経障害を回避したい症例には良い適応であるが、 CDDPも漫然と投与するとオキサリプラチン同様、 末梢神経障害が生じるため注意が必要。
- 腎保護のため、 大量補液を要するため、 大量腹水を有する症例には不向きである。
- ステロイドを含む制吐剤をトラスツズマブ投与前に投与することで、 インフュージョンリアクションを予防できる事もある。
特徴と注意点
- 胃癌治療ガイドライン²⁾では、 1次治療の標準治療の1つである。
- S-1特有の有害事象として流涙がある。 流涙の予防には1日5〜6回の人工涙液の点眼が有効である。 休薬期間中も忘れずに点眼するように指導しておく。 防腐剤フリーの点眼薬が望ましい。 著者の施設ではソフトサンティア®を購入いただいている。
- 稀ではあるが、 角膜障害を生じることがあるため、 視力低下を訴える場合は必ず眼科へコンサルトする。
- シスプラチンの腎毒性のため、 CrCl< 50mL/minは禁忌である。
- 5週毎のレジメンと異なり、 シスプラチンのdose intensityが高くなるため、 毒性に注意。
- トラスツズマブは心毒性を有する。 治療開始前に心エコーを実施し、 LVEF<50%の症例には投与しない。 おおよそ3ヵ月程度の間隔で、 心エコーで心機能のスクリーニングを行う。
関連する臨床試験
HERBIS-1試験¹⁾
ヒト上皮成長因子受容体2型 (HER2) 陽性AGC患者におけるトラスツズマブとSPの併用の有効性と安全性を評価するための第Ⅱ相試験。 主要評価項目は奏効率 (RR) で、 副次評価項目は全生存期間 (OS) 、 無増悪生存期間 (PFS) 、 治療失敗までの時間 (TTF) 、 有害事象が含まれた。
Br J Cancer. 2014 Mar 4;110(5):1163-8.
出典
- Phase II study of trastuzumab in combination with S-1 plus cisplatin in HER2-positive gastric cancer (HERBIS-1). Br J Cancer. 2014 Mar 4;110(5):1163-8. PMID: 24473399
- 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日:2023年9月14日
執筆医:静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
