治療スケジュール
概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*武田薬品工業株式会社の外部サイトへ遷移します
用法用量
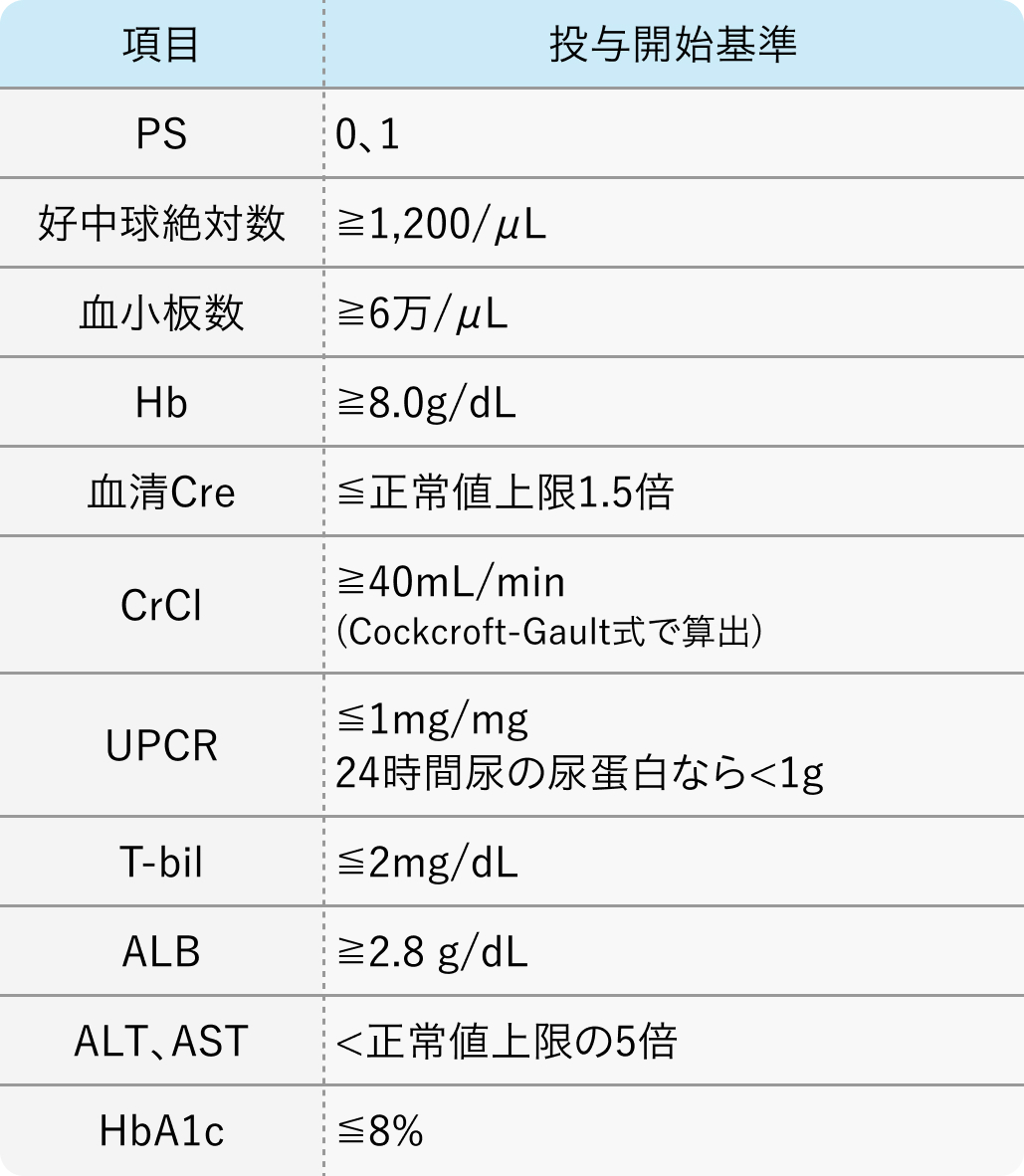
投与開始基準
HCCの組織学的または細胞学的診断がある18歳以上の患者
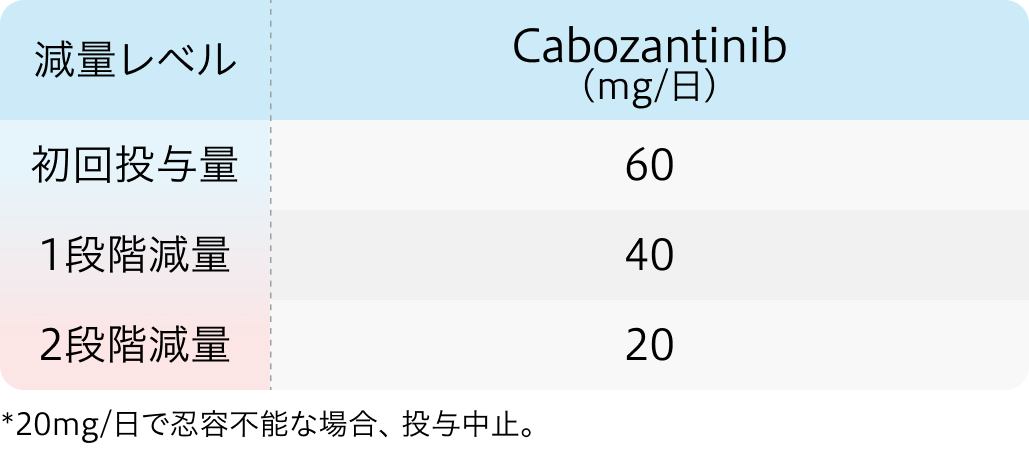
減量・休薬基準

初回基準量と減量レベル
主な有害事象
CELESTIAL試験¹⁾
試験の有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- AST上昇 22.5% (11.8%)
- ALT上昇 17.1% (4.9%)
- 血小板減少症 11.1% (3.4%)
- 血小板減少 9.6% (3.6%)
- 貧血 9.9% (4.1%)
- 下痢 53.7% (9.9%)
- 食欲低下 48.2% (5.8%)
- 倦怠感 45.4% (10.5%)
- 悪心 31.5% (2.1%)
- 嘔吐 25.9% (0.4%)
- 便秘 18.6% (0.4%)
- 体重減少 17.3% (1.1%)
- 粘膜炎症 13.9% (1.7%)
- 発熱13.7% (0%)
- 口内炎 13.5% (1.7%)
参考文献に記載がある有害事象のThrombocytopeniaを血小板減少症、 Decrease in platelet countを血小板減少と訳した。
注意すべき有害事象
- 手掌・足底赤血球感覚異常 46.5% (16.9%)
- 高血圧 29.3% (15.8%)
上手に使うためのワンポイント
- カボザンチニブはレンバチニブと比べて半減期が比較的長い薬剤である。 そのため、 早期から副作用の発見につとめて必要に応じて適宜休薬減量を行うことが重要である。 血中濃度が上がってから減量しても副作用が改善するまで時間がかかる可能性があるため、 導入後初期は特に頻回に肝障害などの早期発見目的で採血管理や多職種によるチーム医療 (テレホンフォローアップなど) によって患者の食欲や倦怠感などの変化を確認する必要がある。
- 最近では、 エビデンスは乏しいが実臨床において治療強度を保つための副作用対策として導入時から減量開始を行う報告も多くみられている。
特徴と注意点
- 本レジメンは切除不能肝細胞癌に対する二次・三次治療としてCELESTIAL試験後、 日本人集団においても国内第II相試験が行われて本邦で承認された。 Child-Pugh分類Aの症例が対象である。
- CELESTIAL試験において奏効率4.0%、 病勢制御率64%であった。 有害事象による初回用量調整 (減量または休薬) までの期間は手足症候群 (22日) 、 下痢 (23日)、 高血圧 (15日) 、 蛋白尿 (15日) 、 肝障害 (29日) 、 疲労倦怠感 (17日) 、 食欲減退 (22日) と報告されており、 いずれも1ヶ月以内にみられていた (各中央値) 。
- VEGF以外にMETやAXLを阻害することで抗腫瘍効果を発揮することが出来る唯一の分子標的薬で、 他の分子標的治療に不応となった肝細胞癌症例にも効果を発揮する可能性がある。
関連する臨床試験|CELESTIAL試験¹⁾
ソラフェニブ治療歴のある進行肝細胞癌患者において、 カボザンチニブの効果を、 プラセボを対照に検証した第Ⅲ相二重盲検ランダム化比較試験CELESTIALの結果より、 全生存期間 (OS) と無増悪生存期間 (PFS) における有効性が示された。
OS中央値
- カボザンチニブ群:10.2ヵ月
(95%CI 9.1-12.0ヵ月)
- プラセボ群:8.0ヵ月
(95%CI 6.8-9.4ヵ月)
HR 0.76 (95%CI 0.63-0.92)、 p=0.005
OS率 (6ヵ月時、 12ヵ月時、 18ヵ月時、 24ヵ月時)
- カボザンチニブ群:72%、 46%、 32%、 18%
- プラセボ群:61%、 34%、 18%、 13%
PFS中央値
- カボザンチニブ群:5.2ヵ月
(95%CI 4.0-5.5ヵ月)
- プラセボ群:1.9ヵ月
(95%CI 1.9-1.9ヵ月)
HR 0.44 (95%CI 0.36-0.52)、 p<0.001
ORR
- カボザンチニブ群:4%
(95%CI 2-6%)
- プラセボ群:<1%
(95%CI 0-2%)
p=0.009
出典
最終更新日:2023年11月15日
執筆医:愛媛県立中央病院 消化器内科主任部長 平岡淳先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
Cabozantinib
カボザンチニブ (カボメティクス®)
肝細胞癌 > 二次治療以降
2024年04月24日更新
カボザンチニブ:カボザンチニブ(カボメティクス®)
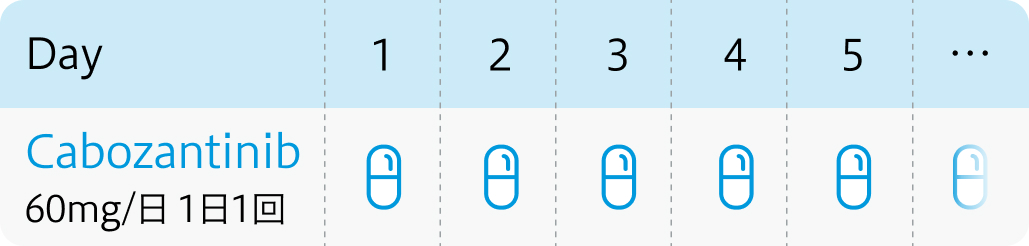
| 投与量 | コース | 投与日 |
|---|---|---|
| 60mg/日 分1 経口 | 1~ | 連日投与 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*武田薬品工業株式会社の外部サイトへ遷移します
用法用量

投与開始基準
HCCの組織学的または細胞学的診断がある18歳以上の患者

減量・休薬基準

初回基準量と減量レベル

主な有害事象
CELESTIAL試験¹⁾
試験の有害事象データを一部引用 (カッコ内はGrade3~4)
主な有害事象
- AST上昇 22.5% (11.8%)
- ALT上昇 17.1% (4.9%)
- 血小板減少症 11.1% (3.4%)
- 血小板減少 9.6% (3.6%)
- 貧血 9.9% (4.1%)
- 下痢 53.7% (9.9%)
- 食欲低下 48.2% (5.8%)
- 倦怠感 45.4% (10.5%)
- 悪心 31.5% (2.1%)
- 嘔吐 25.9% (0.4%)
- 便秘 18.6% (0.4%)
- 体重減少 17.3% (1.1%)
- 粘膜炎症 13.9% (1.7%)
- 発熱13.7% (0%)
- 口内炎 13.5% (1.7%)
参考文献に記載がある有害事象のThrombocytopeniaを血小板減少症、 Decrease in platelet countを血小板減少と訳した。
注意すべき有害事象
- 手掌・足底赤血球感覚異常 46.5% (16.9%)
- 高血圧 29.3% (15.8%)
上手に使うためのワンポイント
- カボザンチニブはレンバチニブと比べて半減期が比較的長い薬剤である。 そのため、 早期から副作用の発見につとめて必要に応じて適宜休薬減量を行うことが重要である。 血中濃度が上がってから減量しても副作用が改善するまで時間がかかる可能性があるため、 導入後初期は特に頻回に肝障害などの早期発見目的で採血管理や多職種によるチーム医療 (テレホンフォローアップなど) によって患者の食欲や倦怠感などの変化を確認する必要がある。
- 最近では、 エビデンスは乏しいが実臨床において治療強度を保つための副作用対策として導入時から減量開始を行う報告も多くみられている。
特徴と注意点
- 本レジメンは切除不能肝細胞癌に対する二次・三次治療としてCELESTIAL試験後、 日本人集団においても国内第II相試験が行われて本邦で承認された。 Child-Pugh分類Aの症例が対象である。
- CELESTIAL試験において奏効率4.0%、 病勢制御率64%であった。 有害事象による初回用量調整 (減量または休薬) までの期間は手足症候群 (22日) 、 下痢 (23日)、 高血圧 (15日) 、 蛋白尿 (15日) 、 肝障害 (29日) 、 疲労倦怠感 (17日) 、 食欲減退 (22日) と報告されており、 いずれも1ヶ月以内にみられていた (各中央値) 。
- VEGF以外にMETやAXLを阻害することで抗腫瘍効果を発揮することが出来る唯一の分子標的薬で、 他の分子標的治療に不応となった肝細胞癌症例にも効果を発揮する可能性がある。
関連する臨床試験|CELESTIAL試験¹⁾
ソラフェニブ治療歴のある進行肝細胞癌患者において、 カボザンチニブの効果を、 プラセボを対照に検証した第Ⅲ相二重盲検ランダム化比較試験CELESTIALの結果より、 全生存期間 (OS) と無増悪生存期間 (PFS) における有効性が示された。
OS中央値
- カボザンチニブ群:10.2ヵ月
(95%CI 9.1-12.0ヵ月)
- プラセボ群:8.0ヵ月
(95%CI 6.8-9.4ヵ月)
HR 0.76 (95%CI 0.63-0.92)、 p=0.005
OS率 (6ヵ月時、 12ヵ月時、 18ヵ月時、 24ヵ月時)
- カボザンチニブ群:72%、 46%、 32%、 18%
- プラセボ群:61%、 34%、 18%、 13%
PFS中央値
- カボザンチニブ群:5.2ヵ月
(95%CI 4.0-5.5ヵ月)
- プラセボ群:1.9ヵ月
(95%CI 1.9-1.9ヵ月)
HR 0.44 (95%CI 0.36-0.52)、 p<0.001
ORR
- カボザンチニブ群:4%
(95%CI 2-6%)
- プラセボ群:<1%
(95%CI 0-2%)
p=0.009
出典
最終更新日:2023年11月15日
執筆医:愛媛県立中央病院 消化器内科主任部長 平岡淳先生
監修医:神奈川県立がんセンター 消化器内科 上野 誠先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
