Amivantamab SC:Amivantamab+rHuPH20(リブロファズ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1600mg 皮下投与 | 1 | Day 1、8、15、22 |
| 1600mg 皮下投与 | 2~ | Day 1、15 |
Amivantamab IV:Amivantamab(ライブリバント®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 350mg 点滴 | 1 | Day 1 |
| 700mg (Bw≧80kgは1050mg) 点滴 | 1 | Day 2 |
| 1050mg (Bw≧80kgは1400mg) 点滴 | 1 | Day 8、15、22 |
| 1050mg (Bw≧80kgは1400mg) 点滴 | 2~ | Day 1、15 |
Lazertinib:ラゼルチニブ(ラズクルーズ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg 経口 1日1回 | 1~ | Day 1~28 |
前投薬
| リブロファズ®投与前は、サイクル1 Day1にステロイド+抗ヒスタミン剤+解熱鎮痛剤(必要時H2拮抗剤・制吐剤)を投与し、Day8以降は抗ヒスタミン剤+解熱鎮痛剤(必要時ステロイド・H2拮抗剤・制吐剤)を投与する。 |
| ライブリバント®投与前は、サイクル1 Day1・2にステロイド+抗ヒスタミン剤+解熱鎮痛剤(必要時H2拮抗剤・制吐剤)を投与し、Day8以降は抗ヒスタミン剤+解熱鎮痛剤(必要時ステロイド・H2拮抗剤・制吐剤)を投与する。 |
ラズクルーズ® : 2025年3月27日、 「EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」 で承認、 同年5月21日に薬価収載 (240mg 1錠 : 12,354.70円)。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
リブロファズ® (アミバンタマブ+rHuPH20)
ライブリバント® (アミバンタマブ)
EGFR/MET二重特異性抗体
ラズクルーズ® (ラゼルチニブ)
経口第3世代EGFR-TKI
*ヤンセンファーマ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】 低リスク
【FN発症】未報告*
*MARIPOSA試験では顕著な好中球減少やFNの増加は未報告
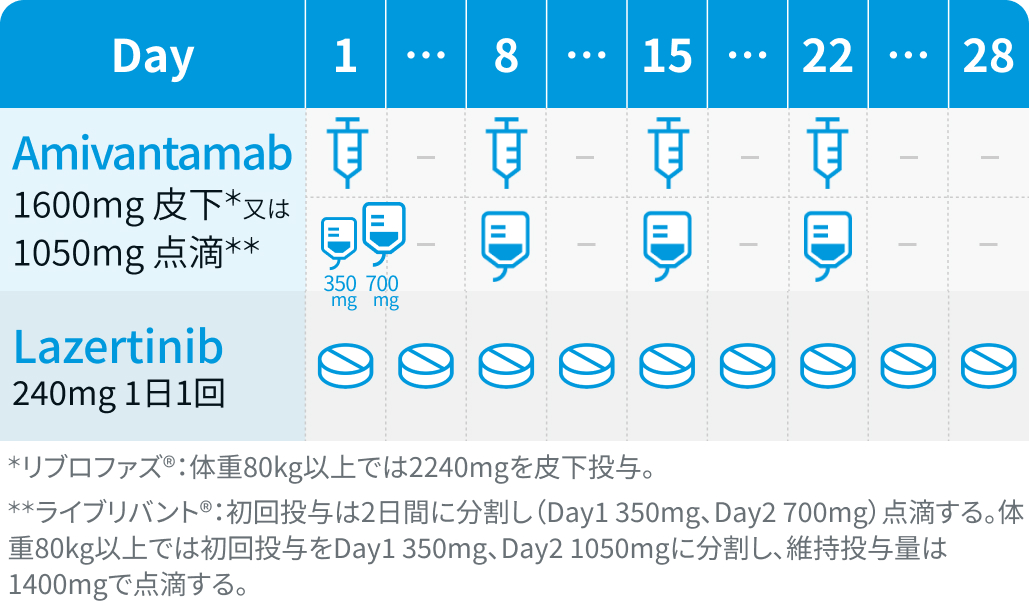
▼1サイクル目
▼2サイクル目以降
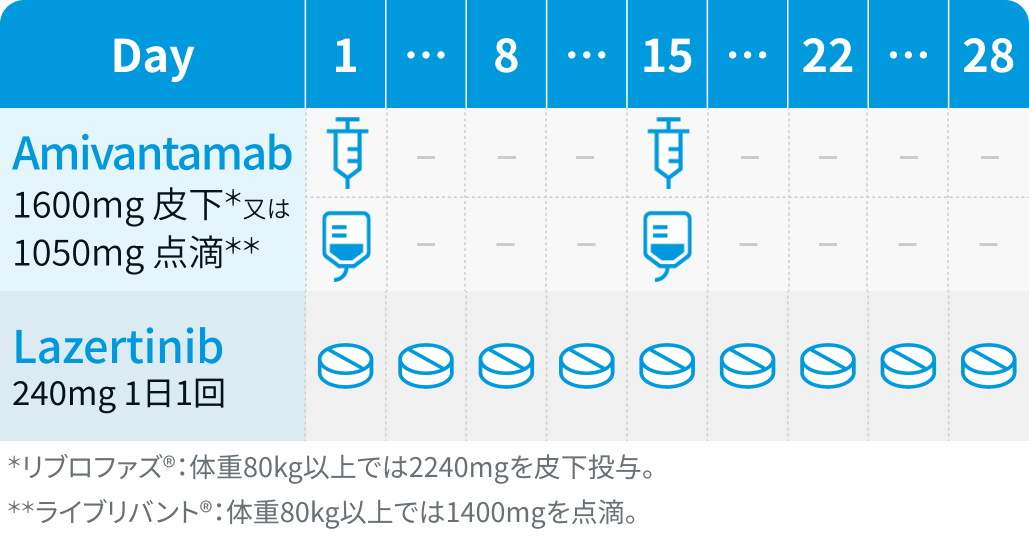
アミバンタマブ (Ami) : 4週間を1サイクルとし、 1サイクル目は週1回投与、 2サイクル目以降は2週ごとに継続投与 (用量は製剤ごとに以下のとおり)。
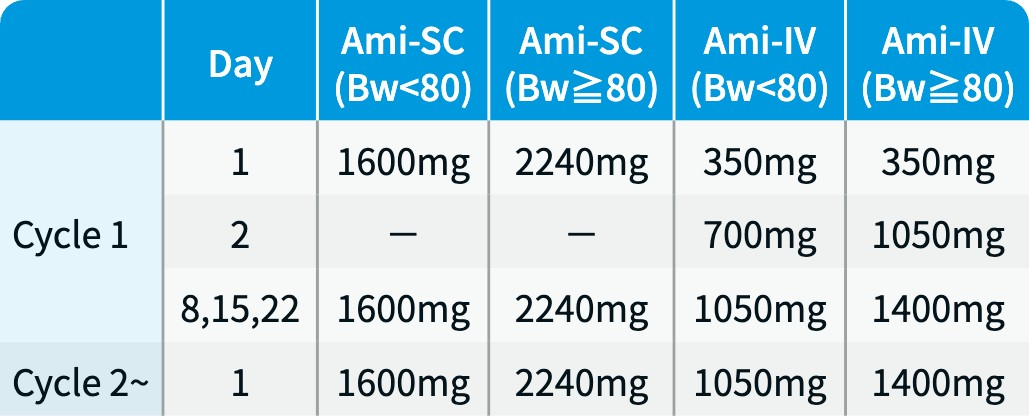
Ami-SC : リブロファズ®、 Ami-IV : ライブリバント®、 Bw (kg)
ラゼルチニブ (Laz) : 1日1回240mgを連日経口投与
静脈血栓塞栓症の予防 : 併用投与開始後4ヵ月間は、 アピキサバン1回2.5mgを1日2回経口投与
Key Data|臨床試験結果
MARIPOSA試験
N Engl J Med. 2024;391(16):1486-1498.⁶⁾
N Engl J Med. 2025;393(17):1681-1693.⁷⁾
未治療のEGFR変異陽性 (Ex19delまたはL858R) の局所進行または転移性NSCLC患者者1,074例 (日本人78例含む) を対象とした第III相無作為化比較試験。 2:2:1の比率でAmi+Laz群 (オープンラベル)、 オシメルチニブ群 (二重盲検)、 Laz群 (二重盲検) に割付し、 主要評価項目はPFSが設定された。
【有効性】Ami+Laz群 (vs オシメルチニブ群)
- PFS中央値 42.9ヵ月 (vs 32.8ヵ月)
- HR 0.74 (95%CI 0.61-0.90)
- OS中央値 NE (vs 36.7ヵ月)
- HR 0.75 (95%CI 0.61-0.92、 p<0.005)
- 24ヵ月OS率 75% vs 70%
- 36ヵ月OS率 60% vs 51%
- 42ヵ月OS率 56% vs 44%
📊 PALOMA-3試験
J Clin Oncol. 2024;42(30):3593-3605.⁸⁾
オシメルチニブおよびプラチナ製剤ベース化学療法後に増悪したEGFR変異 (Ex19delまたはL858R) 陽性の進行・再発NSCLCを対象に、 Ami皮下投与 (Ami-SC) +LazとAmi静注 (Ami-IV) +Lazを比較した第III相無作為化非劣性試験。 Ami-SC+Laz 206例とAmi-IV+Laz 212例に1 : 1で割り付け、 主要評価項目はAmi-IVに対するAmi-SCの薬物動態 (Ctrough、 AUC) の非劣性とした。
【有効性】Ami-SC+Laz群 (vs Ami-IV+Laz群)
- ORR 30% (vs 33%)
- 相対リスク 0.92 (95%CI 0.70–1.23、 p=0.001[非劣性])
- PFS中央値 6.1ヵ月 (vs 4.3ヵ月)
- HR 0.84 (95%CI 0.64–1.10、 p=0.2)
- OS中央値 12.9ヵ月 (vs 未到達)
- HR 0.62 (95%CI 0.42–0.92、 p=0.02)
【安全性】主な有害事象 : 全Grade (Grade≧3)
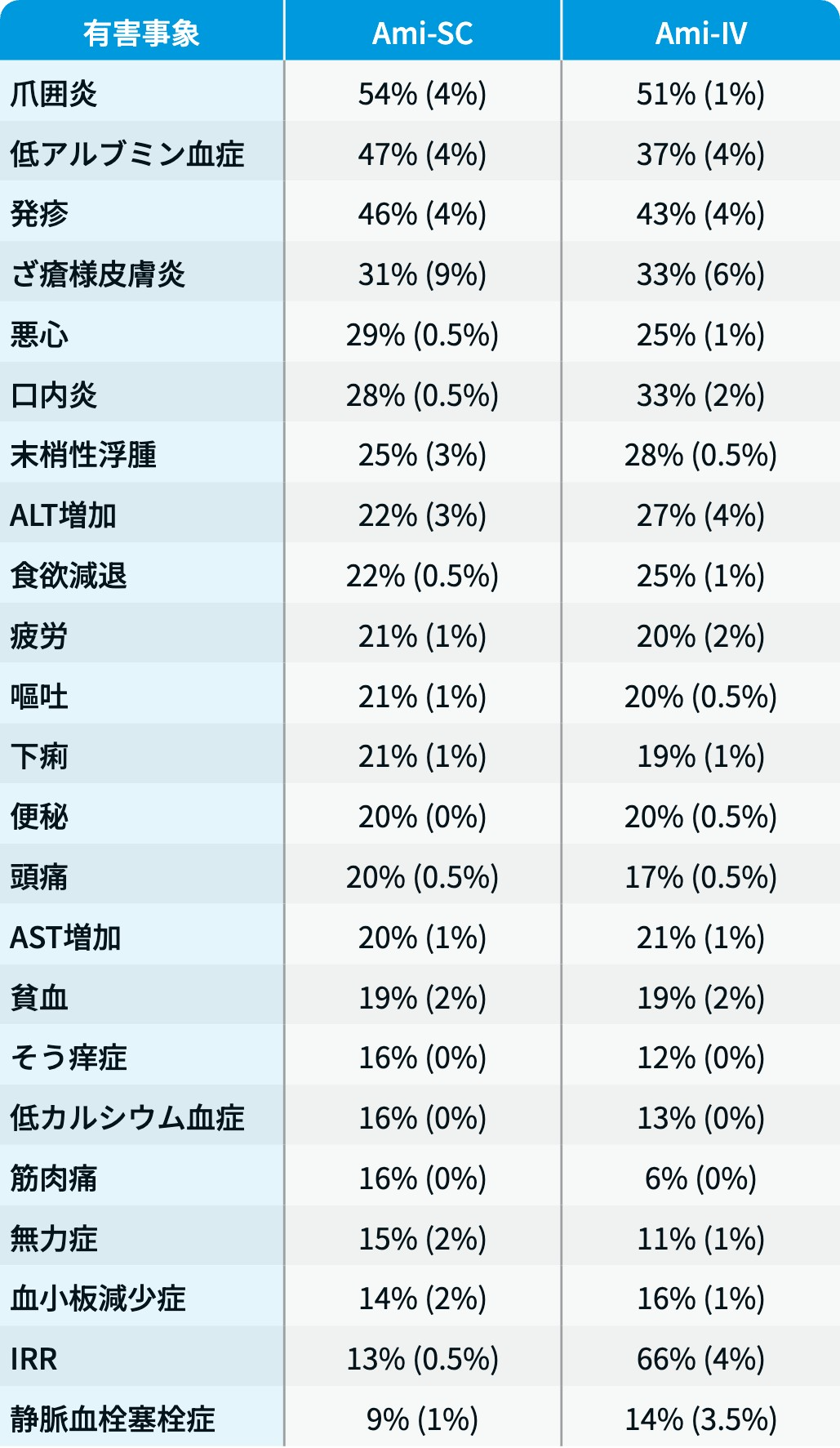
PALOMA-3試験⁹⁾結果を基に編集部作成
各プロトコル
適格基準
MARIPOSA試験⁶⁾⁷⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0–1
- 好中球≧1500/mm³
- ヘモグロビン≧10g/dL
- 血小板数≧7.5万/mm³
- 肝機能 : AST/ALT≦3xULN、 T-Bil≦1.5xULN
- 腎機能 : Cre<1.5xULN、 またはCrCl>45mL/min/1.73m²
リブロファズ®の減量・休薬・中止基準
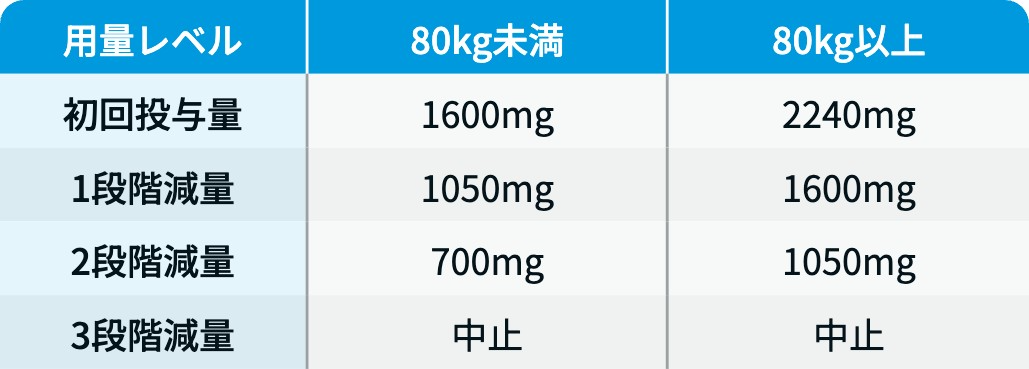
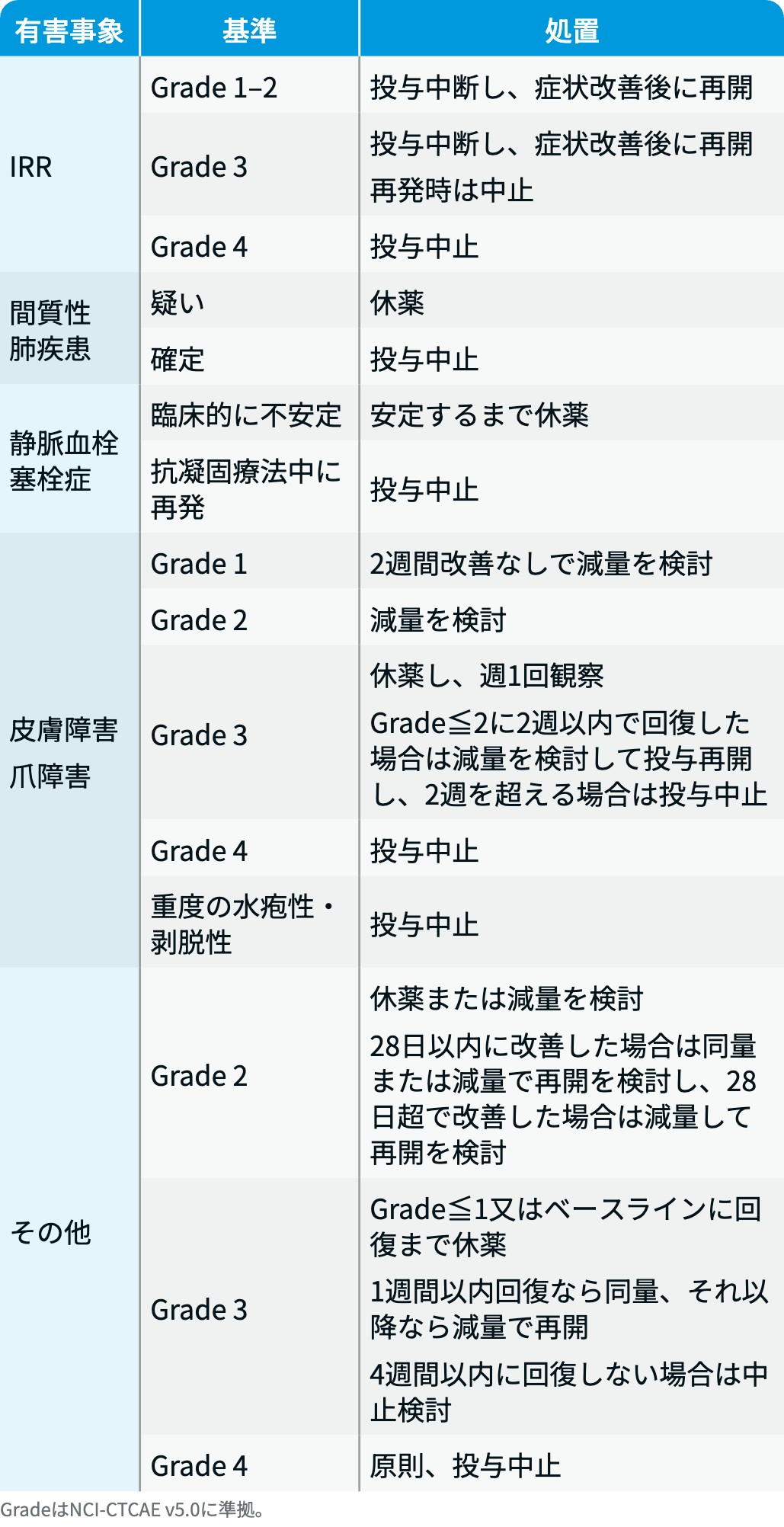
リブロファズ®電子添文情報¹⁾を基に編集部作成
ライブリバント®の減量・休薬・中止基準
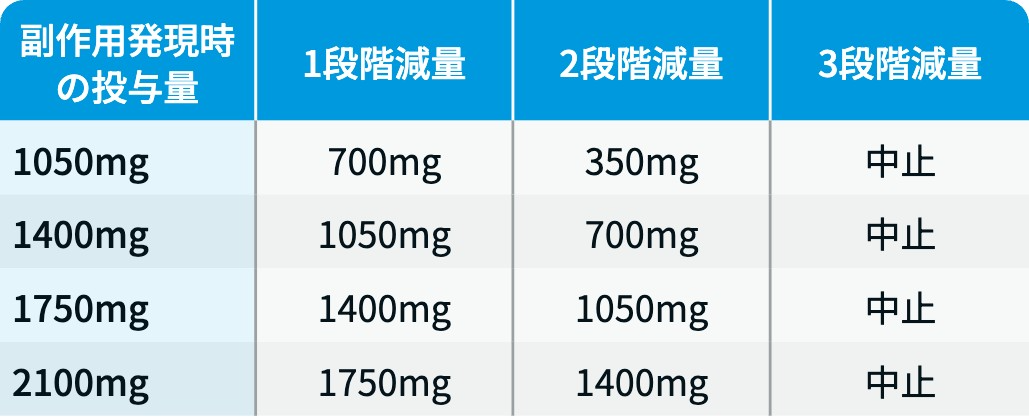
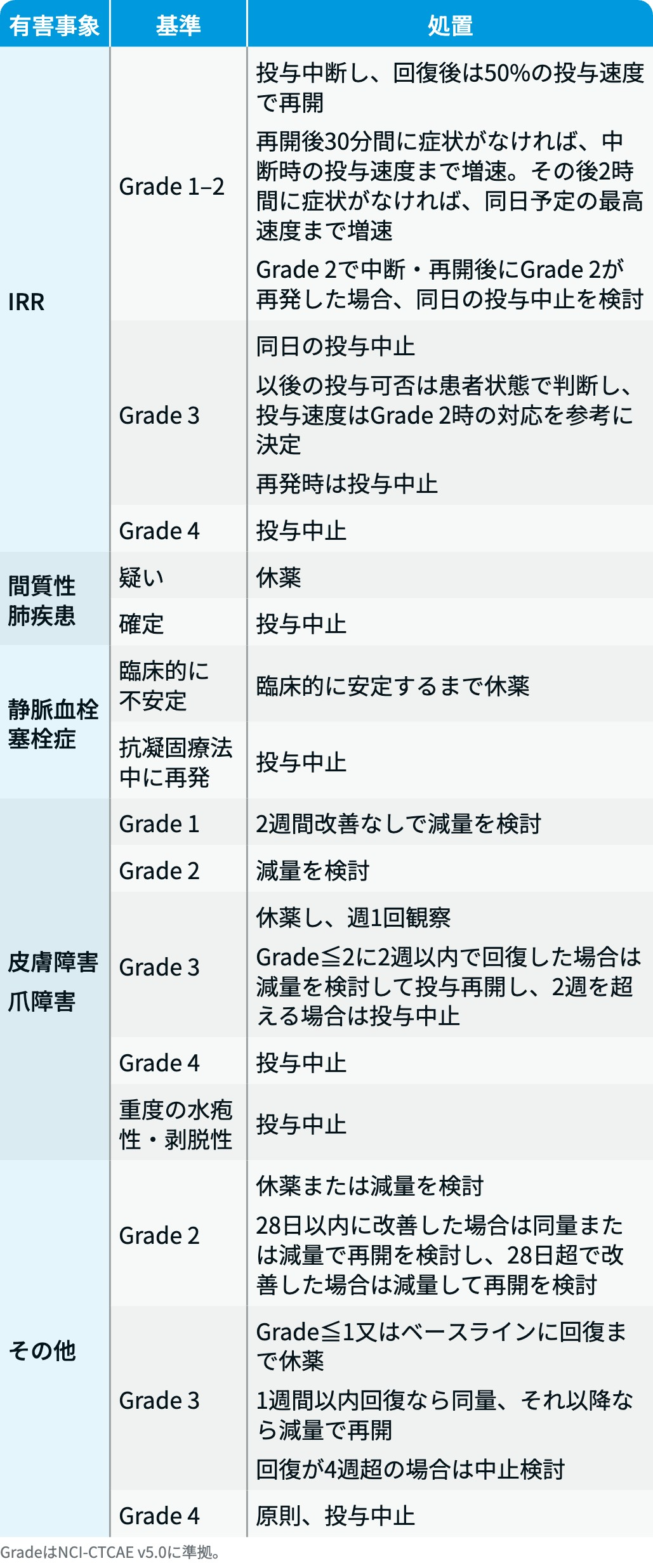
ライブリバント® 電子添文³⁾を基に編集部作成
ラゼルチニブの減量・休薬・中止基準
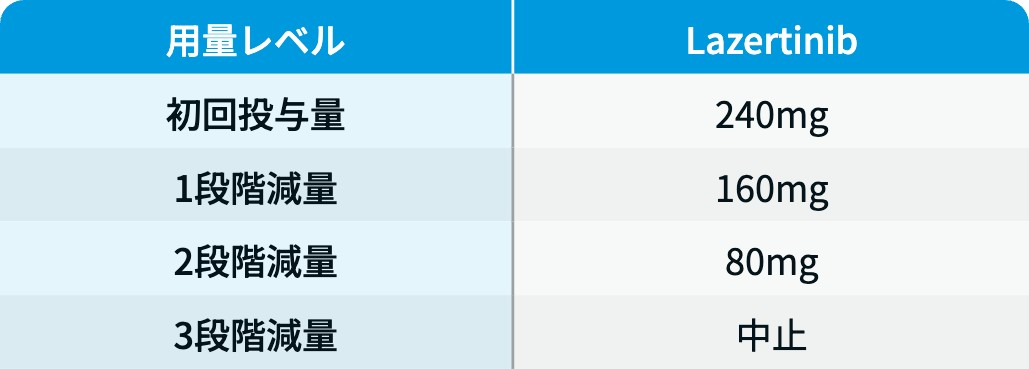
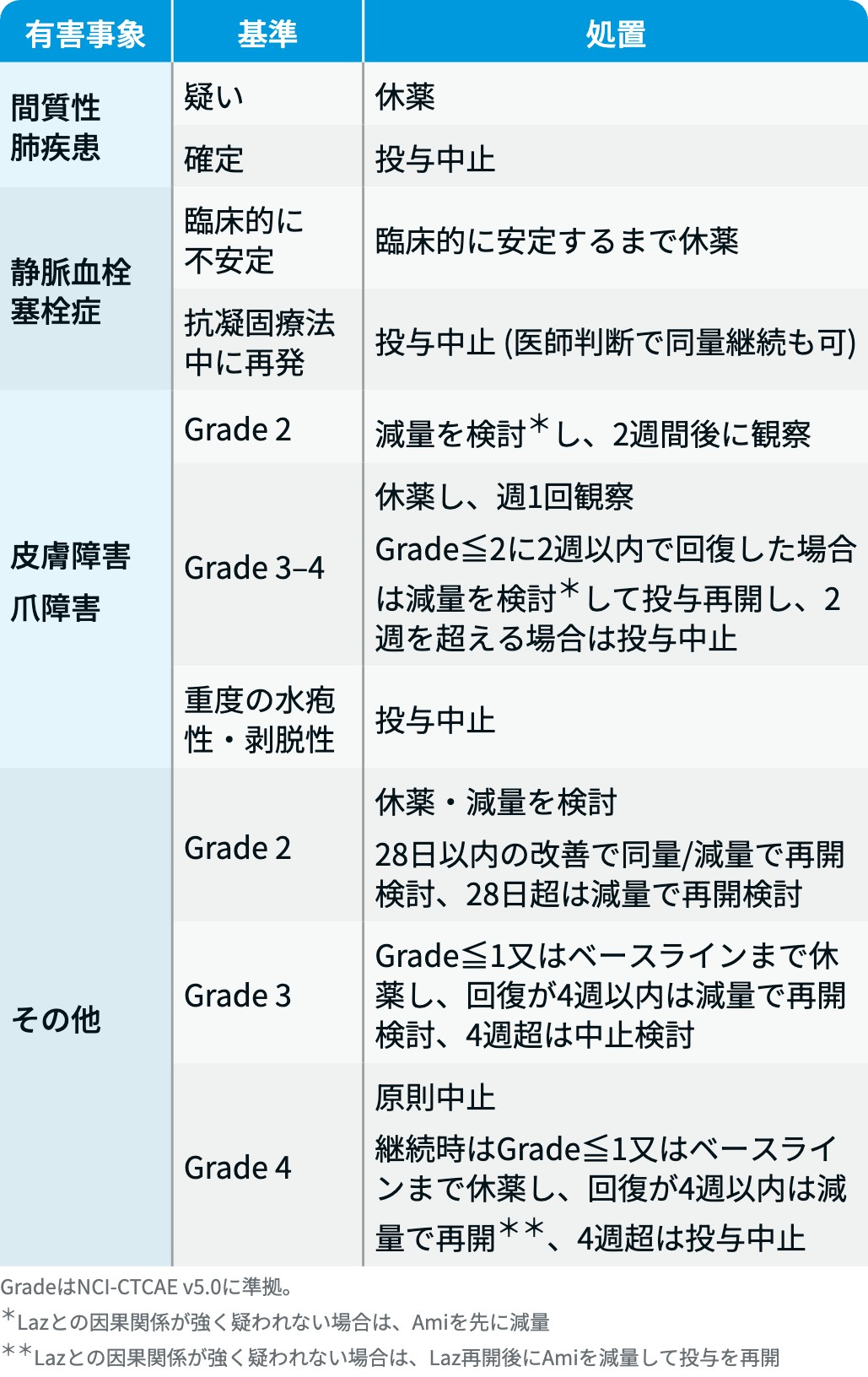
ラズクルーズ® 電子添文⁵⁾を基に編集部作成
腎障害患者に対する用量調節
Ami : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
Laz : 尿中未変化体排泄率は0.2%未満と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる。
ラズクルーズ® 医薬品インタビューフォームを引用
レジメンの特徴と注意点
2025年12月22日、 アミバンタマブ (ライブリバント®点滴静注) と同一の効能・効果で、 リブロファズ®配合皮下注 (アミバンタマブ・ボルヒアルロニダーゼ アルファ) が承認された。
🧑⚕️皮下投与により、 IRRおよびVTEの低減が期待されるほか、 投与時間の短縮も見込まれる。
和歌山県立医科大学附属病院 赤松弘朗先生
レジメン適用時の注意事項
IRR (ライブリバント®) : Day 1・Day 2の分割投与および必須の前投薬で予防し、 規定の投与速度で投与する。 以下に、 投与速度および前投薬を示す。
▼ライブリバント®調製後の希釈液 (投与量/250mL) 投与速度
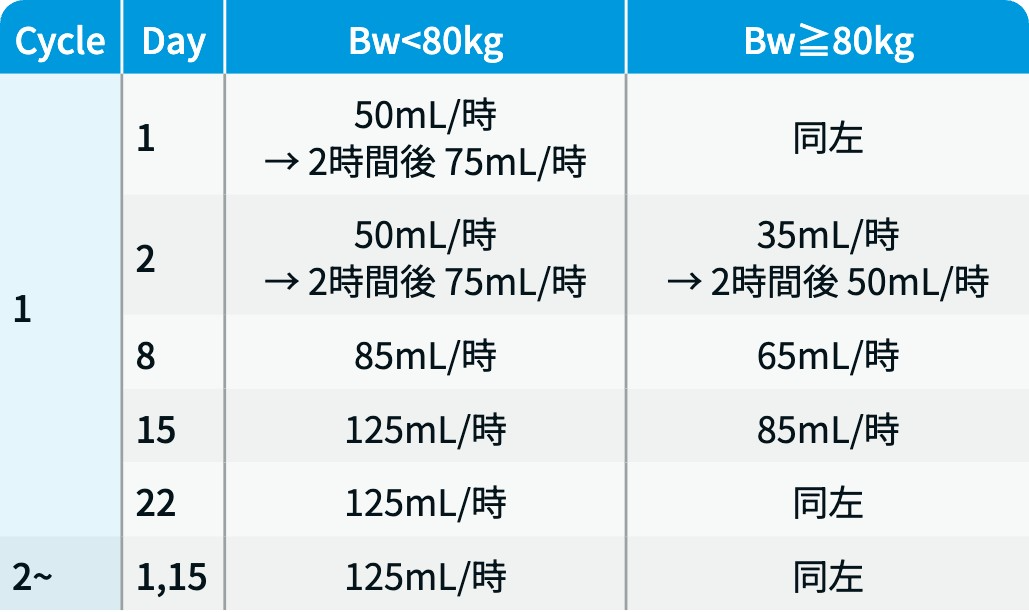
ライブリバント® 電子添文¹⁾を基に編集部作成
▼MARIPOSA試験⁶⁾⁷⁾で規定された必須の前投薬
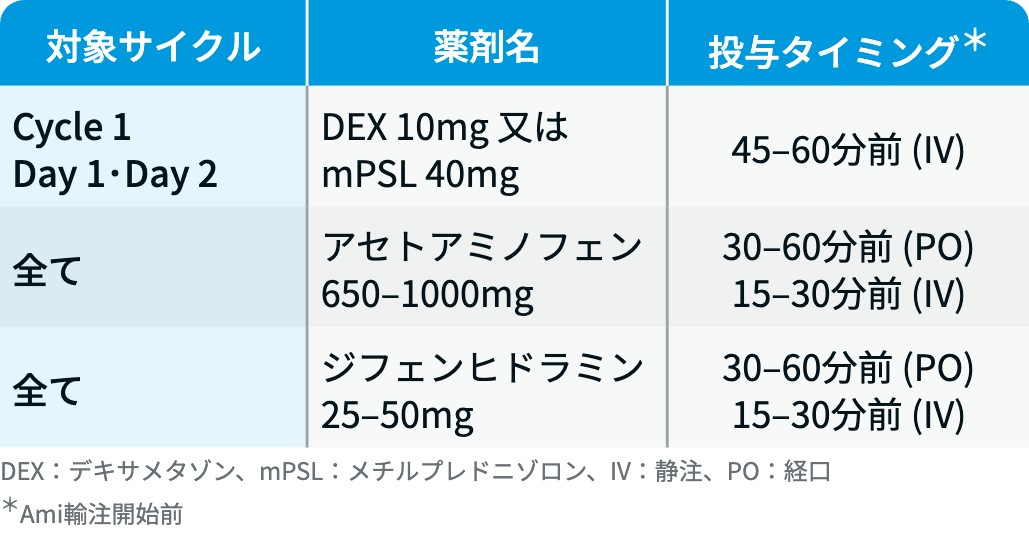
IRR (リブロファズ®) : 必須の前投薬で予防する。
▼リブロファズ®のピボタル試験で規定された必須の前投薬²⁾

皮膚・爪障害 : EGFR阻害薬に共通する症状であり、 保湿や日光防護に加え、 症状出現時はステロイド外用や抗生剤軟膏などで早期介入する。 重症例では休薬を検討する。
静脈血栓塞栓症 : Ami+Laz併用で発症率が高く、 治療開始数ヵ月以内に集中して起こるため、 呼吸困難や下肢痛・腫脹に注意し、 予防的抗凝固療法を行う。
間質性肺疾患 : 呼吸困難、 咳嗽、 発熱などの初期症状を確認し、 定期的に胸部画像検査を行って十分に観察し、 必要に応じてPaO2、 SpO2、 A-aDO2、 DLco等を評価し、 症状出現時は速やかに受診するよう指導する。
皮下投与時の注意事項 (リブロファズ®) : 21~23G針または皮下投与セットを使用し、 1回量は15mL以内とする。 15mL超は複数シリンジに均等分割し、 腹部皮下に約5分で投与する。 複数回投与時は臍周囲5cmを避け、 腹部の異なる部位に連続投与し、 必要に応じて生食でフラッシュする。
RMP【重要な特定されたリスク】
リブロファズ®/ライブリバント®医薬品リスク管理計画書 (RMP)
- Infusion reaction
- 間質性肺疾患
- 重度の皮膚障害
- 体液貯留
- 静脈血栓塞栓症
ラズクルーズ®医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 静脈血栓塞栓症
- 肝機能障害
- 重度の下痢
- 重度の皮膚障害
- 心不全
肺癌診療ガイドライン2025
本邦ガイドラインの推奨は以下のとおり⁹⁾。
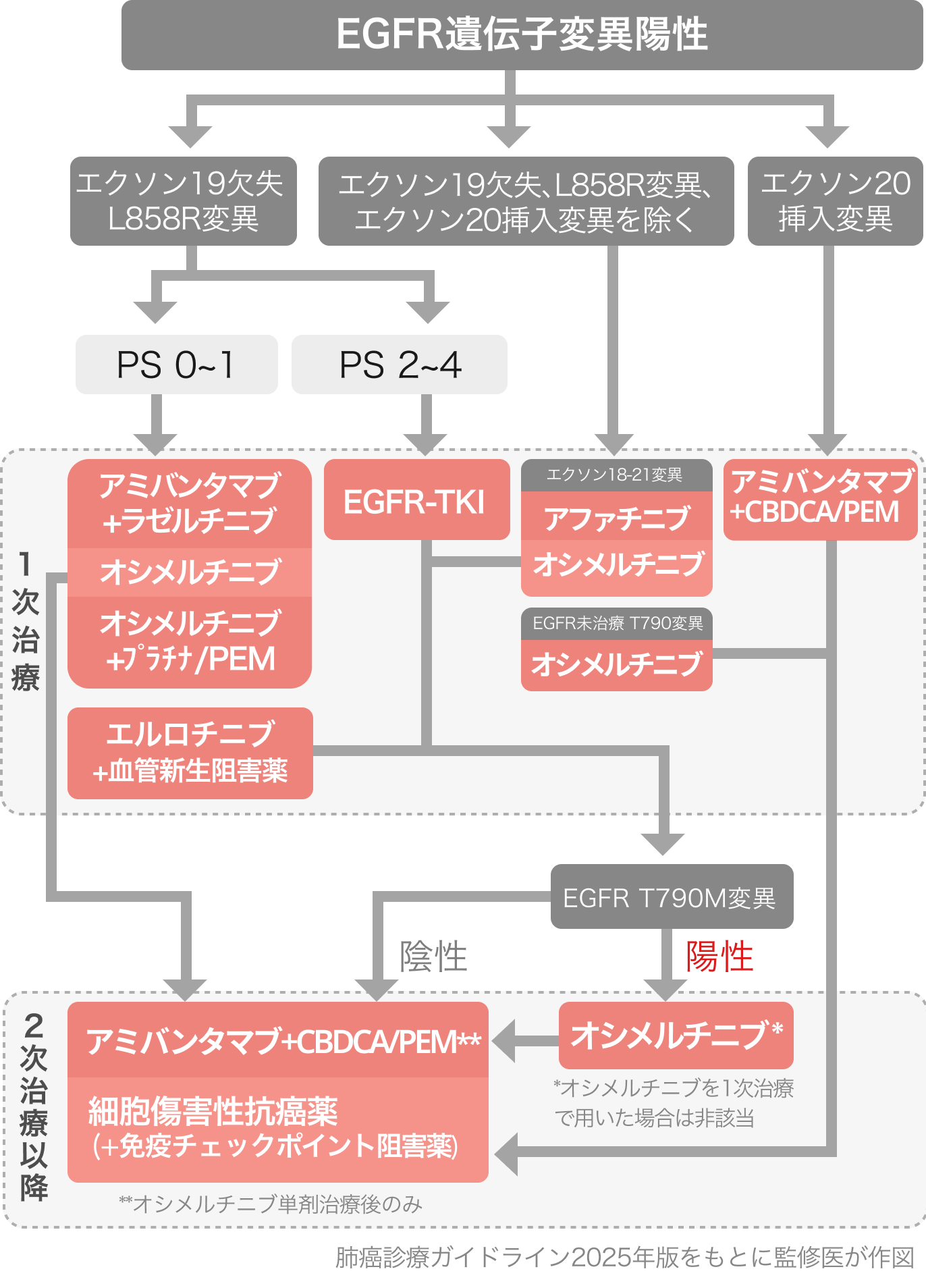
▼1次治療 PS 0-1
Amivantamab+Lazertinib [強く推奨 1B]
Osimertinib+プラチナ/PEM [強く推奨 1B]
Osimertinib単剤 [強く推奨 1A]
Erlotinib+RAM [弱く推奨 2A]
▼エクソン18-21変異
Afatinib単剤 [強く推奨 1B]
Osimertinib単剤 [弱く推奨 2C]
▼EGFR-TKI未治療のT790M変異
Osimertinib単剤 [弱く推奨 2D]
▼エクソン20変異
Amivantamab+CBDCA/PEM [強く推奨 1B]
▼EGFR-TKI耐性/増悪後のT790M変異陽性
Osimertinib単剤 [強く推奨 1B]
出典
1) ヤンセンファーマ株式会社. リブロファズ® 電子添文情報 2025年12月作成 第1版.
2) ヤンセンファーマ株式会社. リブロファズ® 適正使用ガイド 2025年12月作成.
3) ヤンセンファーマ株式会社. ライブリバント® 電子添文情報 2025年12月改訂 第5版.
4) ヤンセンファーマ株式会社. ライブリバント® 適正使用ガイド (ライブリバント®とラズクルーズ®の併用療法) 2025年5月改訂
5) ヤンセンファーマ株式会社. ラズクルーズ® 電子添文情報 2025年5月作成 第1版.
6) N Engl J Med. 2024;391(16):1486-1498.
7) N Engl J Med. 2025;393(17):1681-1693.
8) J Clin Oncol. 2024;42(30):3593-3605.
9) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終確認・更新日 : 2026年1月7日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : 和歌山県立医科大学附属病院 赤松弘
Amivantamab (IV/SC)+Lazertinib
Amivantamab SC:Amivantamab+rHuPH20(リブロファズ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1600mg 皮下投与 | 1 | Day 1、8、15、22 |
| 1600mg 皮下投与 | 2~ | Day 1、15 |
Amivantamab IV:Amivantamab(ライブリバント®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 350mg 点滴 | 1 | Day 1 |
| 700mg (Bw≧80kgは1050mg) 点滴 | 1 | Day 2 |
| 1050mg (Bw≧80kgは1400mg) 点滴 | 1 | Day 8、15、22 |
| 1050mg (Bw≧80kgは1400mg) 点滴 | 2~ | Day 1、15 |
Lazertinib:ラゼルチニブ(ラズクルーズ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 240mg 経口 1日1回 | 1~ | Day 1~28 |
前投薬
| リブロファズ®投与前は、サイクル1 Day1にステロイド+抗ヒスタミン剤+解熱鎮痛剤(必要時H2拮抗剤・制吐剤)を投与し、Day8以降は抗ヒスタミン剤+解熱鎮痛剤(必要時ステロイド・H2拮抗剤・制吐剤)を投与する。 |
| ライブリバント®投与前は、サイクル1 Day1・2にステロイド+抗ヒスタミン剤+解熱鎮痛剤(必要時H2拮抗剤・制吐剤)を投与し、Day8以降は抗ヒスタミン剤+解熱鎮痛剤(必要時ステロイド・H2拮抗剤・制吐剤)を投与する。 |
概要
ラズクルーズ® : 2025年3月27日、 「EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌」 で承認、 同年5月21日に薬価収載 (240mg 1錠 : 12,354.70円)。
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
リブロファズ® (アミバンタマブ+rHuPH20)
ライブリバント® (アミバンタマブ)
EGFR/MET二重特異性抗体
ラズクルーズ® (ラゼルチニブ)
経口第3世代EGFR-TKI
*ヤンセンファーマ株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】28日間
【催吐性】 低リスク
【FN発症】未報告*
*MARIPOSA試験では顕著な好中球減少やFNの増加は未報告
▼1サイクル目

▼2サイクル目以降

アミバンタマブ (Ami) : 4週間を1サイクルとし、 1サイクル目は週1回投与、 2サイクル目以降は2週ごとに継続投与 (用量は製剤ごとに以下のとおり)。

Ami-SC : リブロファズ®、 Ami-IV : ライブリバント®、 Bw (kg)
ラゼルチニブ (Laz) : 1日1回240mgを連日経口投与
静脈血栓塞栓症の予防 : 併用投与開始後4ヵ月間は、 アピキサバン1回2.5mgを1日2回経口投与
Key Data|臨床試験結果
MARIPOSA試験
N Engl J Med. 2024;391(16):1486-1498.⁶⁾
N Engl J Med. 2025;393(17):1681-1693.⁷⁾
未治療のEGFR変異陽性 (Ex19delまたはL858R) の局所進行または転移性NSCLC患者者1,074例 (日本人78例含む) を対象とした第III相無作為化比較試験。 2:2:1の比率でAmi+Laz群 (オープンラベル)、 オシメルチニブ群 (二重盲検)、 Laz群 (二重盲検) に割付し、 主要評価項目はPFSが設定された。
【有効性】Ami+Laz群 (vs オシメルチニブ群)
- PFS中央値 42.9ヵ月 (vs 32.8ヵ月)
- HR 0.74 (95%CI 0.61-0.90)
- OS中央値 NE (vs 36.7ヵ月)
- HR 0.75 (95%CI 0.61-0.92、 p<0.005)
- 24ヵ月OS率 75% vs 70%
- 36ヵ月OS率 60% vs 51%
- 42ヵ月OS率 56% vs 44%
📊 PALOMA-3試験
J Clin Oncol. 2024;42(30):3593-3605.⁸⁾
オシメルチニブおよびプラチナ製剤ベース化学療法後に増悪したEGFR変異 (Ex19delまたはL858R) 陽性の進行・再発NSCLCを対象に、 Ami皮下投与 (Ami-SC) +LazとAmi静注 (Ami-IV) +Lazを比較した第III相無作為化非劣性試験。 Ami-SC+Laz 206例とAmi-IV+Laz 212例に1 : 1で割り付け、 主要評価項目はAmi-IVに対するAmi-SCの薬物動態 (Ctrough、 AUC) の非劣性とした。
【有効性】Ami-SC+Laz群 (vs Ami-IV+Laz群)
- ORR 30% (vs 33%)
- 相対リスク 0.92 (95%CI 0.70–1.23、 p=0.001[非劣性])
- PFS中央値 6.1ヵ月 (vs 4.3ヵ月)
- HR 0.84 (95%CI 0.64–1.10、 p=0.2)
- OS中央値 12.9ヵ月 (vs 未到達)
- HR 0.62 (95%CI 0.42–0.92、 p=0.02)
【安全性】主な有害事象 : 全Grade (Grade≧3)

PALOMA-3試験⁹⁾結果を基に編集部作成
各プロトコル
適格基準
MARIPOSA試験⁶⁾⁷⁾の主な適格基準 :
- 18歳以上
- ECOG PS 0–1
- 好中球≧1500/mm³
- ヘモグロビン≧10g/dL
- 血小板数≧7.5万/mm³
- 肝機能 : AST/ALT≦3xULN、 T-Bil≦1.5xULN
- 腎機能 : Cre<1.5xULN、 またはCrCl>45mL/min/1.73m²
リブロファズ®の減量・休薬・中止基準


リブロファズ®電子添文情報¹⁾を基に編集部作成
ライブリバント®の減量・休薬・中止基準


ライブリバント® 電子添文³⁾を基に編集部作成
ラゼルチニブの減量・休薬・中止基準


ラズクルーズ® 電子添文⁵⁾を基に編集部作成
腎障害患者に対する用量調節
Ami : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
Laz : 尿中未変化体排泄率は0.2%未満と低く、 腎クリアランスの寄与は小さいため、 腎障害時の用量調整は不要と考えられる。
ラズクルーズ® 医薬品インタビューフォームを引用
レジメンの特徴と注意点
2025年12月22日、 アミバンタマブ (ライブリバント®点滴静注) と同一の効能・効果で、 リブロファズ®配合皮下注 (アミバンタマブ・ボルヒアルロニダーゼ アルファ) が承認された。
🧑⚕️皮下投与により、 IRRおよびVTEの低減が期待されるほか、 投与時間の短縮も見込まれる。
和歌山県立医科大学附属病院 赤松弘朗先生
レジメン適用時の注意事項
IRR (ライブリバント®) : Day 1・Day 2の分割投与および必須の前投薬で予防し、 規定の投与速度で投与する。 以下に、 投与速度および前投薬を示す。
▼ライブリバント®調製後の希釈液 (投与量/250mL) 投与速度

ライブリバント® 電子添文¹⁾を基に編集部作成
▼MARIPOSA試験⁶⁾⁷⁾で規定された必須の前投薬

IRR (リブロファズ®) : 必須の前投薬で予防する。
▼リブロファズ®のピボタル試験で規定された必須の前投薬²⁾

皮膚・爪障害 : EGFR阻害薬に共通する症状であり、 保湿や日光防護に加え、 症状出現時はステロイド外用や抗生剤軟膏などで早期介入する。 重症例では休薬を検討する。
静脈血栓塞栓症 : Ami+Laz併用で発症率が高く、 治療開始数ヵ月以内に集中して起こるため、 呼吸困難や下肢痛・腫脹に注意し、 予防的抗凝固療法を行う。
間質性肺疾患 : 呼吸困難、 咳嗽、 発熱などの初期症状を確認し、 定期的に胸部画像検査を行って十分に観察し、 必要に応じてPaO2、 SpO2、 A-aDO2、 DLco等を評価し、 症状出現時は速やかに受診するよう指導する。
皮下投与時の注意事項 (リブロファズ®) : 21~23G針または皮下投与セットを使用し、 1回量は15mL以内とする。 15mL超は複数シリンジに均等分割し、 腹部皮下に約5分で投与する。 複数回投与時は臍周囲5cmを避け、 腹部の異なる部位に連続投与し、 必要に応じて生食でフラッシュする。
RMP【重要な特定されたリスク】
リブロファズ®/ライブリバント®医薬品リスク管理計画書 (RMP)
- Infusion reaction
- 間質性肺疾患
- 重度の皮膚障害
- 体液貯留
- 静脈血栓塞栓症
ラズクルーズ®医薬品リスク管理計画書 (RMP)
- 間質性肺疾患
- 静脈血栓塞栓症
- 肝機能障害
- 重度の下痢
- 重度の皮膚障害
- 心不全
肺癌診療ガイドライン2025
本邦ガイドラインの推奨は以下のとおり⁹⁾。

▼1次治療 PS 0-1
Amivantamab+Lazertinib [強く推奨 1B]
Osimertinib+プラチナ/PEM [強く推奨 1B]
Osimertinib単剤 [強く推奨 1A]
Erlotinib+RAM [弱く推奨 2A]
▼エクソン18-21変異
Afatinib単剤 [強く推奨 1B]
Osimertinib単剤 [弱く推奨 2C]
▼EGFR-TKI未治療のT790M変異
Osimertinib単剤 [弱く推奨 2D]
▼エクソン20変異
Amivantamab+CBDCA/PEM [強く推奨 1B]
▼EGFR-TKI耐性/増悪後のT790M変異陽性
Osimertinib単剤 [強く推奨 1B]
出典
1) ヤンセンファーマ株式会社. リブロファズ® 電子添文情報 2025年12月作成 第1版.
2) ヤンセンファーマ株式会社. リブロファズ® 適正使用ガイド 2025年12月作成.
3) ヤンセンファーマ株式会社. ライブリバント® 電子添文情報 2025年12月改訂 第5版.
4) ヤンセンファーマ株式会社. ライブリバント® 適正使用ガイド (ライブリバント®とラズクルーズ®の併用療法) 2025年5月改訂
5) ヤンセンファーマ株式会社. ラズクルーズ® 電子添文情報 2025年5月作成 第1版.
6) N Engl J Med. 2024;391(16):1486-1498.
7) N Engl J Med. 2025;393(17):1681-1693.
8) J Clin Oncol. 2024;42(30):3593-3605.
9) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終確認・更新日 : 2026年1月7日
執筆 : HOKUTO編集部がん専門・指導薬剤師
監修医師 : 和歌山県立医科大学附属病院 赤松弘
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

