本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2024/8/25時点で、 乳房外パジェット病に対して本邦適応外
薬剤情報
2024/8/25時点で、 乳房外パジェット病に対して本邦適応外
*中外製薬株式会社の外部サイトへ遷移します
- タキソテール® (添付文書³⁾)
用法用量 ※適応外
第Ⅱ相単群試験⁴⁾のプロトコル
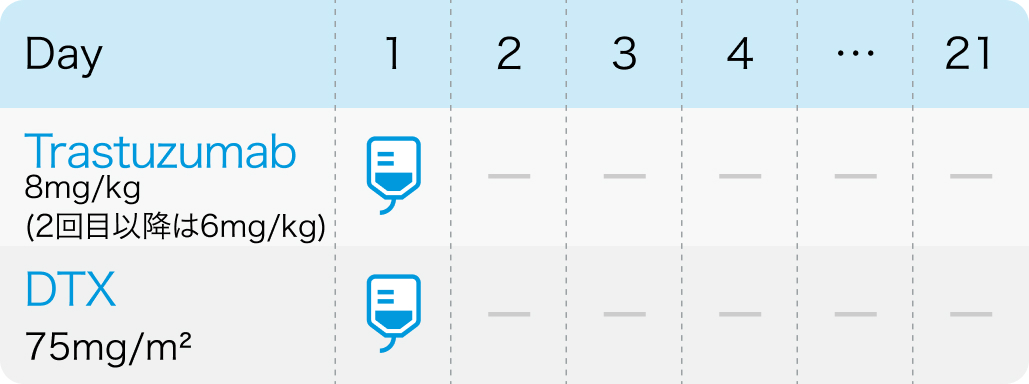
トラスツズマブを初回8mg/kg、 2回目以降6mg/kg、 ドセタキセル75mg/m²を点滴静注する。 3週間ごとに繰り返す。
Oncologist. 2024 Jun 1:oyae097⁴⁾より引用
血液毒性が高頻度に起きるため、 必要に応じてドセタキセルを減量、 中止する。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
エキスパートによるワンポイント
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
HER2陽性症例の2次治療以降の選択肢
根治切除不能な進行・再発の乳房外パジェット病に対しては、 様々な化学療法が報告されているが各レジメンを比較する試験は無く、 保険適用となっている薬剤はニボルマブのみである。 Trastuzumab+DTX療法はHER2陽性 (IHC 3+もしくは2+かつFISH陽性) 転移性乳房外パジェット病に対する単群介入試験で有効性、 安全性が評価されている⁴⁾。
なお、 13例中10例が未治療であったが、 乳房外パジェット病に対して保険適用外であることや、 ニボルマブが保険適用となったことから、 HER2陽性症例の2次治療以降で選択されることが予想される。
臨床試験の結果
日本で実施された第Ⅱ相単群試験⁴⁾では主要評価項目が3サイクル投与時の奏効割合と安全性で、 CR38.5%、 PR38.5%、 SD23.1%であり奏効割合は76.9%であった。
PFS中央値9.3ヵ月、 OS中央値は未到達と報告されている。 安全性については好中球数減少が100%で見られ、 うちGrade 4が92.3%であった。 Grade 3以上の有害事象は発熱性好中球減少7.7%、 貧血15.4%であり、 非血液毒性としては高血圧、 皮膚粘膜感染症がそれぞれ15.4%、 下痢、 肺水腫、 失神、 尿路閉塞、 関節痛が7.7%であった。 治療関連死は無かった。
世界中でも唯一の乳房外パジェット病に対する介入研究で評価されたレジメンではあるが、 保険適用外である。
出典
1) 中外製薬株式会社. ハーセプチン®電子添文 (2022年12月改訂 第5版) [最終閲覧 : 2024/7/11]
2) 中外製薬株式会社. ハーセプチン®適正使用ガイド (2023年12月改訂) [最終閲覧 : 2024/7/11]
3) サノフィ. タキソテール®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/18]
その他情報は随時更新予定です
最終更新日 : 2024年8月25日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
Trastuzumab + DTX
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
2024/8/25時点で、 乳房外パジェット病に対して本邦適応外
薬剤情報
2024/8/25時点で、 乳房外パジェット病に対して本邦適応外
*中外製薬株式会社の外部サイトへ遷移します
- タキソテール® (添付文書³⁾)
用法用量 ※適応外
第Ⅱ相単群試験⁴⁾のプロトコル

トラスツズマブを初回8mg/kg、 2回目以降6mg/kg、 ドセタキセル75mg/m²を点滴静注する。 3週間ごとに繰り返す。
Oncologist. 2024 Jun 1:oyae097⁴⁾より引用
血液毒性が高頻度に起きるため、 必要に応じてドセタキセルを減量、 中止する。
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
エキスパートによるワンポイント
監修 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
HER2陽性症例の2次治療以降の選択肢
根治切除不能な進行・再発の乳房外パジェット病に対しては、 様々な化学療法が報告されているが各レジメンを比較する試験は無く、 保険適用となっている薬剤はニボルマブのみである。 Trastuzumab+DTX療法はHER2陽性 (IHC 3+もしくは2+かつFISH陽性) 転移性乳房外パジェット病に対する単群介入試験で有効性、 安全性が評価されている⁴⁾。
なお、 13例中10例が未治療であったが、 乳房外パジェット病に対して保険適用外であることや、 ニボルマブが保険適用となったことから、 HER2陽性症例の2次治療以降で選択されることが予想される。
臨床試験の結果
日本で実施された第Ⅱ相単群試験⁴⁾では主要評価項目が3サイクル投与時の奏効割合と安全性で、 CR38.5%、 PR38.5%、 SD23.1%であり奏効割合は76.9%であった。
PFS中央値9.3ヵ月、 OS中央値は未到達と報告されている。 安全性については好中球数減少が100%で見られ、 うちGrade 4が92.3%であった。 Grade 3以上の有害事象は発熱性好中球減少7.7%、 貧血15.4%であり、 非血液毒性としては高血圧、 皮膚粘膜感染症がそれぞれ15.4%、 下痢、 肺水腫、 失神、 尿路閉塞、 関節痛が7.7%であった。 治療関連死は無かった。
世界中でも唯一の乳房外パジェット病に対する介入研究で評価されたレジメンではあるが、 保険適用外である。
出典
1) 中外製薬株式会社. ハーセプチン®電子添文 (2022年12月改訂 第5版) [最終閲覧 : 2024/7/11]
2) 中外製薬株式会社. ハーセプチン®適正使用ガイド (2023年12月改訂) [最終閲覧 : 2024/7/11]
3) サノフィ. タキソテール®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/18]
その他情報は随時更新予定です
最終更新日 : 2024年8月25日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。