治療スケジュール
概要
監修医師
ide-cel :イデカブタゲン ビクルユーセル(アベクマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| CAR発現T細胞として280×10⁶~540×10⁶個 点滴静注 | 1 | Day1 |
前投薬
| Infusion reaction軽減のため、 投与30~60分前に抗ヒスタミン薬、 解熱鎮痛薬を投与. |
その他
| 細胞採取から本剤投与に至るまでの手順は、 製造販売業者が提供するマニュアル等を参照すること. |
| リンパ球除去化学療法終了3日後に本剤を投与. |
| サイトカイン放出症候群の緊急時に備えて、 トシリズマブの在庫を確保する. |
| 1つの静注用バッグごとに解凍開始から60分以内に投与を完了する. |
| 複数の静注用バッグを用いる際は、 1つ目の投与が完了するまで、 2つ目以降の静注用バッグは解凍しない. |
| カリウムを含有するため、 注入速度は10mL/minを超えない. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは 「ブリストル・マイヤーズ スクイブ株式会社」 の外部サイトへ遷移します.
主な有害事象
KarMMa試験¹⁾ より引用
骨髄抑制
- 好中球減少 (91%、 ≧Grade3 89%)
- 貧血 (70%、 ≧Grade3 60%)
- 血小板減少 (63%、 ≧Grade3 52%)
- 白血球減少 (42%、 ≧Grade3 39%)
- リンパ球減少 (27%、 ≧Grade3 27%)
- 発熱性好中球減少症 (16%、 ≧Grade3 16%)
主な有害事象
消化器症状
- 下痢 (35%、 ≧Grade3 2%)
- 吐き気 (29%)
- 便秘 (16%)
検査値異常
- 低カリウム血症 (35%、 ≧Grade3 2%)
- 低リン血症 (30%、 ≧Grade3 16%)
- 低カルシウム血症 (27%、 ≧Grade3 8%)
- 低マグネシウム血症 (23%)
- 低ナトリウム血症 (19%、 ≧Grade3 5%)
- 低アルブミン血症 (17%、 ≧Grade3 3%)
- AST上昇 (16%、 ≧Grade3 2%)
その他
- CRS (84%、 ≧Grade3 5%)
- 倦怠感 (34%、 ≧Grade3 2%)
- 発熱 (25%、 ≧Grade3 2%)
- 食欲減退 (21%、 ≧Grade3 <1%)
- 頭痛 (21%、 ≧Grade3 <1%)
- 低ガンマグロブリン血症 (21%、 ≧Grade3 <1%)
- 咳嗽 (20%)
- 神経毒 (18%、 ≧Grade3 3%)
- 低血圧 (16%、 ≧Grade3 <1%)
特徴と注意点
作用機序
- レンチウイルスベクターを用い、 B細胞成熟抗原 (B-cell maturation antigen; BCMA) に対するキメラ抗原受容体 (Chimeric Antigen Receptor;CAR) をコードする遺伝子を患者自身のT細胞に導入したCAR‐T細胞を構成細胞とする細胞加工製品.
- 標的抗原を発現したがん細胞をCAR‐T細胞が認識すると、 主要組織適合遺伝子複合体とは非依存的に導入T細胞の増殖、 活性化、 標的細胞に対する攻撃、 導入T細胞を持続させるシグナルが伝達され、 抗腫瘍効果を示すと考えられている.
- 本剤は単回投与製剤.
適応疾患
- 再発又は難治性の多発性骨髄腫.
適格基準【MM】
下記の条件をいずれも満たす場合
- BCMA抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない.
- 免疫調節薬、 プロテアソーム阻害剤及び抗CD38モノクローナル抗体製剤を含む2つ以上の前治療歴*を有し、 かつ、 直近の前治療に対して病勢進行が認められた又は治療後に再発した.
*2023年12月6日付で一部変更承認取得 (2つ以上の前治療歴患者でも使用可能に)
白血球アフェレーシス
- 十分量のTリンパ球を含む非動員末梢血単核球を採取し、 白血球アフェレーシス産物を凍結保存する.
リンパ球除去化学療法前の抗腫瘍療法 (ブリッジング療法)
- ide-celの製造を待っている期間に患者の病態を安定させるため、 腫瘍量等に応じて抗腫瘍療法 (ブリッジング療法) を実施する.
《国際共同第2相試験におけるブリッジング療法》
- 全体で87.6%がブリッジング療法を実施.
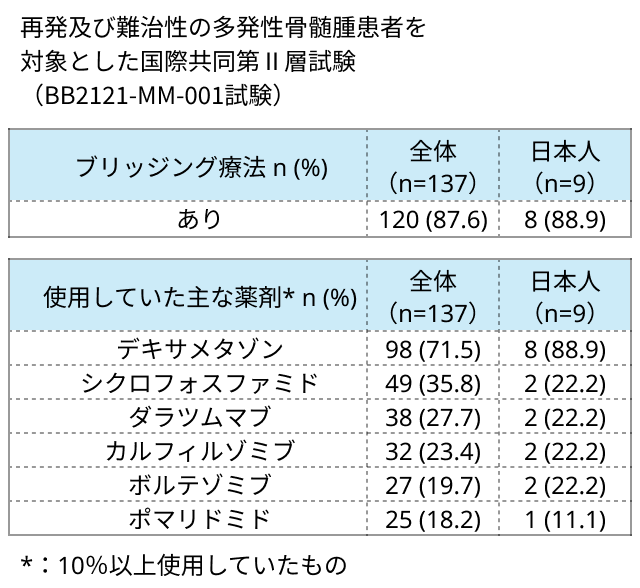
リンパ球除去化学療法
- ide-cel投与前にリンパ球数を減少させることで、 投与されたCAR‐T細胞の生着と恒常性の維持に基づく生体内の増殖を促進させる.
- ide-cel投与の5日前から、 下記のリンパ球除去化学療法を行う.
- シクロホスファミド (無水物換算) として300mg/m²及びフルダラビンリン酸エステルとして30mg/m²を1日1回3日間点滴静注. 腎機能障害時は用量調節を行う.

- リンパ球除去化学療法終了3日後*に本剤を投与.
*国際共同第2相試験では、 有害事象によっては終了3日後から最長7日間まで延期可としていた²⁾.
投与時の注意事項
- B型肝炎又はC型肝炎ウイルスキャリアの患者又は既往感染者は、 肝炎ウイルスが再活性化される可能性がある.
- HIV感染者はウイルスが増加する可能性がある.
- ide-cel受領時及び投与前に、 静注用バッグに貼付されたラベルの記載が患者本人の情報と一致していることを確認する.
- Infusion reaction軽減のため、 ide-cel投与の約30~60分前に抗ヒスタミン薬と解熱鎮痛薬を投与する.
- 生命を脅かす緊急事態を除き、 副腎皮質ステロイド薬は使用しない.
- サイトカイン放出症候群 (CRS) の緊急時に備え、 トシリズマブを2回投与分以上準備する.
- 1つの静注用バッグごとに解凍開始から60分以内に投与を完了する.
- 複数の静注用バッグを用いる際は、 1つ目の投与が完了するまで、 2つ目以降の静注用バッグは解凍しない.
- 本剤はカリウムを含有し、 最高濃度は28mEq/Lとなるため、 注入速度は10mL/minを超えない.
- 白血球除去フィルターは使用せず、 ラテックスフリーの点滴ルートを用いる.
- 投与前に生理食塩液にて点滴ルートのプライミングを行う. 全量投与後は、 バックプライミングにより静注用バッグを生理食塩液で洗浄し、 できるだけ多くの細胞を投与する.
- ジメチルスルホキシド (DMSO) 及びデキストランを含有しており、 アナフィラキシー等の過敏症反応を誘発する可能性がある.
- HIV-1を基に開発されたレンチウイルスベクターを使用しているためHIV核酸増幅検査で偽陽性になることがある.
- 移植のために血液、 臓器、 組織及び細胞を影響しないよう指導する.
副作用と対策【サイトカイン放出症候群;CRS】
- 活性化されたT細胞により放出されるサイトカインによって引き起こされる全身性炎症反応.
- 体内でのCAR‐T細胞の増殖、 活性化及び腫瘍細胞の死滅の結果発現する.
- ide-cel投与後1週間は患者の状態に注意し、少なくとも4週間は観察を継続する.
- 症状:高熱、 悪寒、 筋肉痛、 関節痛、 悪心、 嘔吐、 下痢、 発汗、 発疹、 食欲不振、 疲労、 頭痛、 低血圧、 呼吸困難、 呼吸不全、 肺水腫、 頻呼吸、 低酸素症、 凝固障害、 心不全、 不整脈、 腎不全、 肝障害、 播種性血管内凝固症候群、 毛細血管漏出症候群、 血球貪食症候群、 マクロファージ活性化症候群、 急性呼吸窮迫症候群等.
- CRSと神経系事象が同時に現れた場合、 双方のアルゴリズムを参照し、 いずれかより積極的な処置を行う.
- 本剤の用量とCRS発現割合は相関が認められている²⁾.
CRS (全Grade) 発現割合: 目標用量150×10⁶個で50.0% (4例中2例)、 目標用量300×10⁶個で75.7% (70例中 53例)、 目標用量450×10⁶個で96.8% (63例中61例).
- 発現時期中央値 (範囲):全Grade 1.0日 (1-12)、 ≧Grade3 3.0日 (2-9)²⁾ .
- 消失時期中央値 (範囲):全Grade 5.0日 (1-63)、 ≧Grade3 6.0日 (2-23)²⁾ .
《サイトカイン放出症候群管理アルゴリズム》


《国際共同第2相試験におけるCRS治療》
- トシリズマブ投与:54.7% (1回投与:36.5%、 2回投与:18.2%).
- 副腎皮質ステロイド:10%.
副作用と対策【神経系事象】
- 発現メカニズムは不明. 多くは一過性であり、 ほとんどが支持療法もしくは治療を要せず症状が消失.
- Ide-cel投与後少なくとも8週間は自動車の運転及び危険を伴う行動に従事しないよう指導する.
- 神経系事象とCRSが同時に現れた場合、 双方のアルゴリズムを参照し、 いずれかより積極的な処置を行う.
- 症状:脳症、 せん妄、 不安、 浮動性めまい、 振戦、 意識障害、 失見当識、 頭痛、 錯乱、 激越、 痙攣発作、 無言症、 失語症等.
- 発現時期中央値 (範囲):全Grade 2.0日 (1-10)、 ≧Grade3 4.0日 (2-6)²⁾ .
- 消失時期中央値 (範囲):全Grade 3.0日 (1-26)、 ≧Grade3 3.0日 (2-11)²⁾ .
《神経系事象管理アルゴリズム》


国際共同第2相試験時のアルゴリズムでは、 神経系事象のリスクが高い又は発現時には、 抗てんかん薬 (レベチラセタム等) の投与を推奨としていた²⁾.
《国際共同第2相試験における神経系事象治療》
- トシリズマブ投与:2.2%.
- 副腎皮質ステロイド:8%.
副作用と対策【感染症】
- 低γグロブリン血症又は無γグロブリン血症や重篤な遷延する血球減少に伴い、 細菌、 真菌、 ウイルス等による重度の感染症や発熱性好中球減少症が現れることがある.
- 免疫抑制によるウイルス性疾患の再燃・悪化に注意 (HBV、 HCV、 HIV、 CMV、 EBV等).
- 患者の易感染状態に応じた標準的な感染予防療法を実施する.
副作用と対策【低γグロブリン血症】
- 正常な形質細胞の一部も枯渇し、 低γグロブリン血症を発症することがある.
- CAR‐T細胞が患者の体内で持続する限り、 低γグロブリン血症が持続する可能性がある.
- 定期的に免疫グロブリンを測定し、 必要に応じて免疫補充療法や抗菌薬・抗ウイルス薬の予防投与を実施する.
- 国際共同第2相試験では、 62% (85/137例) に免疫グロブリンの投与が行われた²⁾ .
副作用と対策【血球減少・造血器疾患】
- Ide-cel投与後28日目までに回復しないGrade3以上の好中球減少症、 白血球減少症、 リンパ球減少症、 血小板減少症及び貧血が現れることがある.
- 血球減少には血液製剤、 骨髄増殖因子 (G-CSF等)、 抗菌薬等の投与を実施する.
- G-CSF製剤はCRSを悪化させる可能性があるため、 CAR-T投与後3週間以上経過、 又はCRSが発現している場合はCRSが回復するまでG-CSF製剤の投与は推奨されない³⁾ .
副作用と対策【二次発がん】
- レンチウイルスベクターによる遺伝子挿入をうけたT細胞によって、 細胞増殖を制御する重要な遺伝子に影響が及ぼされ、 二次発がんを引き起こす可能性あり. 投与後も長期間の経過観察が必要.
- 国際共同第2相試験では、 7.3% (10/137例) に二次発がんが認められた²⁾ .
内訳:基底細胞癌5例、 肛門癌、 肺腺癌、 骨髄異形成症候群、 扁平上皮癌及び形質芽球性リンパ腫 各1例
関連する臨床試験の結果
KarMMa試験¹⁾
概要
- 単群、 多施設共同第2相試験
- 対象:再発又は難治性のMM患者128例
- 主要評価項目:ORR
- 副次評価項目:CRR、 MRD、 TTR、 DOR、 PFS、 TTP、 OS、 安全性、 HRQoL
ORR:全奏効率 CRR:完全奏効割合 MRD:微小残存病変 TTR:PR以上の奏効までの期間 DOR:奏効持続期間
PFS:無増悪生存期間 TTP:無増悪期間 OS:全生存期間 HRQoL:健康関連QOL
PR:部分奏効 VGPR:非常に良好な部分奏効 CR:完全奏効
結果
- 追跡期間中央値:13.3ヵ月.
- 全体のORR:73% (95%CI 66-81, p<0.001).
- 全体のCRR:33%.
- 完全奏効を示した42人のうち、 33人 (79%) が感度レベル10*-5でMRD陰性.
- TTR:中央値1.0ヵ月 (範囲:0.5-8.8) .
- DOR:中央値 (推定) 全体で10.7ヵ月 (95%CI 9.0-11.3)、 450×10⁶用量で11.3ヵ月 (95%CI 10.3-11.4).
- DORは奏効の深さと共に延長. 奏効別のDOR中央値は、 PR:4.5ヵ月 (95%CI 2.9-6.7)、 VGPR:10.4ヵ月 (95%CI 5.1-11.3)、 CR又はsCR:19.0ヵ月 (95%CI 11.3-推定不能).
- PFS中央値 (推定):全体で8.8ヵ月 (95%CI 5.6-11.6)、 450×10⁶用量で12.1ヵ月 (95%CI 8.8-12.3)、CRもしくsCRで20.2ヵ月 (95%CI 12.3-推定不能).
- OS中央値 (推定):19.4ヵ月 (95%CI 18.2-推定不能)、 12ヵ月時点での全生存率は78%.
- 主な有害事象 (発現率≧30%):好中球減少症、 CRS、 貧血、 血小板減少症、 白血球減少症、 低カリウム血症、 下痢、 疲労等.
- 主な有害事象 (≧Grade 3):血液毒性、 CRS、 感染症等 (詳細は上記).
参考文献
- N Engl J Med. 2021 Feb 25;384(8):705-716.
- アベクマⓇ点滴静注 適正使用ガイド
- Int J Cancer. 2021 Mar 1;148(5):1192-1196.
最終更新:2023年12月8日
監修医師:東海大学血液腫瘍内科 扇屋大輔
Ide-cel(Idecabtagene vicleucel)
イデカブタゲン ビクルユーセル(アベクマ®)
2023年12月08日更新
ide-cel :イデカブタゲン ビクルユーセル(アベクマ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| CAR発現T細胞として280×10⁶~540×10⁶個 点滴静注 | 1 | Day1 |
前投薬
| Infusion reaction軽減のため、 投与30~60分前に抗ヒスタミン薬、 解熱鎮痛薬を投与. |
その他
| 細胞採取から本剤投与に至るまでの手順は、 製造販売業者が提供するマニュアル等を参照すること. |
| リンパ球除去化学療法終了3日後に本剤を投与. |
| サイトカイン放出症候群の緊急時に備えて、 トシリズマブの在庫を確保する. |
| 1つの静注用バッグごとに解凍開始から60分以内に投与を完了する. |
| 複数の静注用バッグを用いる際は、 1つ目の投与が完了するまで、 2つ目以降の静注用バッグは解凍しない. |
| カリウムを含有するため、 注入速度は10mL/minを超えない. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは 「ブリストル・マイヤーズ スクイブ株式会社」 の外部サイトへ遷移します.
主な有害事象
KarMMa試験¹⁾ より引用
骨髄抑制
- 好中球減少 (91%、 ≧Grade3 89%)
- 貧血 (70%、 ≧Grade3 60%)
- 血小板減少 (63%、 ≧Grade3 52%)
- 白血球減少 (42%、 ≧Grade3 39%)
- リンパ球減少 (27%、 ≧Grade3 27%)
- 発熱性好中球減少症 (16%、 ≧Grade3 16%)
主な有害事象
消化器症状
- 下痢 (35%、 ≧Grade3 2%)
- 吐き気 (29%)
- 便秘 (16%)
検査値異常
- 低カリウム血症 (35%、 ≧Grade3 2%)
- 低リン血症 (30%、 ≧Grade3 16%)
- 低カルシウム血症 (27%、 ≧Grade3 8%)
- 低マグネシウム血症 (23%)
- 低ナトリウム血症 (19%、 ≧Grade3 5%)
- 低アルブミン血症 (17%、 ≧Grade3 3%)
- AST上昇 (16%、 ≧Grade3 2%)
その他
- CRS (84%、 ≧Grade3 5%)
- 倦怠感 (34%、 ≧Grade3 2%)
- 発熱 (25%、 ≧Grade3 2%)
- 食欲減退 (21%、 ≧Grade3 <1%)
- 頭痛 (21%、 ≧Grade3 <1%)
- 低ガンマグロブリン血症 (21%、 ≧Grade3 <1%)
- 咳嗽 (20%)
- 神経毒 (18%、 ≧Grade3 3%)
- 低血圧 (16%、 ≧Grade3 <1%)
特徴と注意点
作用機序
- レンチウイルスベクターを用い、 B細胞成熟抗原 (B-cell maturation antigen; BCMA) に対するキメラ抗原受容体 (Chimeric Antigen Receptor;CAR) をコードする遺伝子を患者自身のT細胞に導入したCAR‐T細胞を構成細胞とする細胞加工製品.
- 標的抗原を発現したがん細胞をCAR‐T細胞が認識すると、 主要組織適合遺伝子複合体とは非依存的に導入T細胞の増殖、 活性化、 標的細胞に対する攻撃、 導入T細胞を持続させるシグナルが伝達され、 抗腫瘍効果を示すと考えられている.
- 本剤は単回投与製剤.
適応疾患
- 再発又は難治性の多発性骨髄腫.
適格基準【MM】
下記の条件をいずれも満たす場合
- BCMA抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない.
- 免疫調節薬、 プロテアソーム阻害剤及び抗CD38モノクローナル抗体製剤を含む2つ以上の前治療歴*を有し、 かつ、 直近の前治療に対して病勢進行が認められた又は治療後に再発した.
*2023年12月6日付で一部変更承認取得 (2つ以上の前治療歴患者でも使用可能に)
白血球アフェレーシス
- 十分量のTリンパ球を含む非動員末梢血単核球を採取し、 白血球アフェレーシス産物を凍結保存する.
リンパ球除去化学療法前の抗腫瘍療法 (ブリッジング療法)
- ide-celの製造を待っている期間に患者の病態を安定させるため、 腫瘍量等に応じて抗腫瘍療法 (ブリッジング療法) を実施する.
《国際共同第2相試験におけるブリッジング療法》
- 全体で87.6%がブリッジング療法を実施.

リンパ球除去化学療法
- ide-cel投与前にリンパ球数を減少させることで、 投与されたCAR‐T細胞の生着と恒常性の維持に基づく生体内の増殖を促進させる.
- ide-cel投与の5日前から、 下記のリンパ球除去化学療法を行う.
- シクロホスファミド (無水物換算) として300mg/m²及びフルダラビンリン酸エステルとして30mg/m²を1日1回3日間点滴静注. 腎機能障害時は用量調節を行う.

- リンパ球除去化学療法終了3日後*に本剤を投与.
*国際共同第2相試験では、 有害事象によっては終了3日後から最長7日間まで延期可としていた²⁾.
投与時の注意事項
- B型肝炎又はC型肝炎ウイルスキャリアの患者又は既往感染者は、 肝炎ウイルスが再活性化される可能性がある.
- HIV感染者はウイルスが増加する可能性がある.
- ide-cel受領時及び投与前に、 静注用バッグに貼付されたラベルの記載が患者本人の情報と一致していることを確認する.
- Infusion reaction軽減のため、 ide-cel投与の約30~60分前に抗ヒスタミン薬と解熱鎮痛薬を投与する.
- 生命を脅かす緊急事態を除き、 副腎皮質ステロイド薬は使用しない.
- サイトカイン放出症候群 (CRS) の緊急時に備え、 トシリズマブを2回投与分以上準備する.
- 1つの静注用バッグごとに解凍開始から60分以内に投与を完了する.
- 複数の静注用バッグを用いる際は、 1つ目の投与が完了するまで、 2つ目以降の静注用バッグは解凍しない.
- 本剤はカリウムを含有し、 最高濃度は28mEq/Lとなるため、 注入速度は10mL/minを超えない.
- 白血球除去フィルターは使用せず、 ラテックスフリーの点滴ルートを用いる.
- 投与前に生理食塩液にて点滴ルートのプライミングを行う. 全量投与後は、 バックプライミングにより静注用バッグを生理食塩液で洗浄し、 できるだけ多くの細胞を投与する.
- ジメチルスルホキシド (DMSO) 及びデキストランを含有しており、 アナフィラキシー等の過敏症反応を誘発する可能性がある.
- HIV-1を基に開発されたレンチウイルスベクターを使用しているためHIV核酸増幅検査で偽陽性になることがある.
- 移植のために血液、 臓器、 組織及び細胞を影響しないよう指導する.
副作用と対策【サイトカイン放出症候群;CRS】
- 活性化されたT細胞により放出されるサイトカインによって引き起こされる全身性炎症反応.
- 体内でのCAR‐T細胞の増殖、 活性化及び腫瘍細胞の死滅の結果発現する.
- ide-cel投与後1週間は患者の状態に注意し、少なくとも4週間は観察を継続する.
- 症状:高熱、 悪寒、 筋肉痛、 関節痛、 悪心、 嘔吐、 下痢、 発汗、 発疹、 食欲不振、 疲労、 頭痛、 低血圧、 呼吸困難、 呼吸不全、 肺水腫、 頻呼吸、 低酸素症、 凝固障害、 心不全、 不整脈、 腎不全、 肝障害、 播種性血管内凝固症候群、 毛細血管漏出症候群、 血球貪食症候群、 マクロファージ活性化症候群、 急性呼吸窮迫症候群等.
- CRSと神経系事象が同時に現れた場合、 双方のアルゴリズムを参照し、 いずれかより積極的な処置を行う.
- 本剤の用量とCRS発現割合は相関が認められている²⁾.
CRS (全Grade) 発現割合: 目標用量150×10⁶個で50.0% (4例中2例)、 目標用量300×10⁶個で75.7% (70例中 53例)、 目標用量450×10⁶個で96.8% (63例中61例).
- 発現時期中央値 (範囲):全Grade 1.0日 (1-12)、 ≧Grade3 3.0日 (2-9)²⁾ .
- 消失時期中央値 (範囲):全Grade 5.0日 (1-63)、 ≧Grade3 6.0日 (2-23)²⁾ .
《サイトカイン放出症候群管理アルゴリズム》


《国際共同第2相試験におけるCRS治療》
- トシリズマブ投与:54.7% (1回投与:36.5%、 2回投与:18.2%).
- 副腎皮質ステロイド:10%.
副作用と対策【神経系事象】
- 発現メカニズムは不明. 多くは一過性であり、 ほとんどが支持療法もしくは治療を要せず症状が消失.
- Ide-cel投与後少なくとも8週間は自動車の運転及び危険を伴う行動に従事しないよう指導する.
- 神経系事象とCRSが同時に現れた場合、 双方のアルゴリズムを参照し、 いずれかより積極的な処置を行う.
- 症状:脳症、 せん妄、 不安、 浮動性めまい、 振戦、 意識障害、 失見当識、 頭痛、 錯乱、 激越、 痙攣発作、 無言症、 失語症等.
- 発現時期中央値 (範囲):全Grade 2.0日 (1-10)、 ≧Grade3 4.0日 (2-6)²⁾ .
- 消失時期中央値 (範囲):全Grade 3.0日 (1-26)、 ≧Grade3 3.0日 (2-11)²⁾ .
《神経系事象管理アルゴリズム》


国際共同第2相試験時のアルゴリズムでは、 神経系事象のリスクが高い又は発現時には、 抗てんかん薬 (レベチラセタム等) の投与を推奨としていた²⁾.
《国際共同第2相試験における神経系事象治療》
- トシリズマブ投与:2.2%.
- 副腎皮質ステロイド:8%.
副作用と対策【感染症】
- 低γグロブリン血症又は無γグロブリン血症や重篤な遷延する血球減少に伴い、 細菌、 真菌、 ウイルス等による重度の感染症や発熱性好中球減少症が現れることがある.
- 免疫抑制によるウイルス性疾患の再燃・悪化に注意 (HBV、 HCV、 HIV、 CMV、 EBV等).
- 患者の易感染状態に応じた標準的な感染予防療法を実施する.
副作用と対策【低γグロブリン血症】
- 正常な形質細胞の一部も枯渇し、 低γグロブリン血症を発症することがある.
- CAR‐T細胞が患者の体内で持続する限り、 低γグロブリン血症が持続する可能性がある.
- 定期的に免疫グロブリンを測定し、 必要に応じて免疫補充療法や抗菌薬・抗ウイルス薬の予防投与を実施する.
- 国際共同第2相試験では、 62% (85/137例) に免疫グロブリンの投与が行われた²⁾ .
副作用と対策【血球減少・造血器疾患】
- Ide-cel投与後28日目までに回復しないGrade3以上の好中球減少症、 白血球減少症、 リンパ球減少症、 血小板減少症及び貧血が現れることがある.
- 血球減少には血液製剤、 骨髄増殖因子 (G-CSF等)、 抗菌薬等の投与を実施する.
- G-CSF製剤はCRSを悪化させる可能性があるため、 CAR-T投与後3週間以上経過、 又はCRSが発現している場合はCRSが回復するまでG-CSF製剤の投与は推奨されない³⁾ .
副作用と対策【二次発がん】
- レンチウイルスベクターによる遺伝子挿入をうけたT細胞によって、 細胞増殖を制御する重要な遺伝子に影響が及ぼされ、 二次発がんを引き起こす可能性あり. 投与後も長期間の経過観察が必要.
- 国際共同第2相試験では、 7.3% (10/137例) に二次発がんが認められた²⁾ .
内訳:基底細胞癌5例、 肛門癌、 肺腺癌、 骨髄異形成症候群、 扁平上皮癌及び形質芽球性リンパ腫 各1例
関連する臨床試験の結果
KarMMa試験¹⁾
概要
- 単群、 多施設共同第2相試験
- 対象:再発又は難治性のMM患者128例
- 主要評価項目:ORR
- 副次評価項目:CRR、 MRD、 TTR、 DOR、 PFS、 TTP、 OS、 安全性、 HRQoL
ORR:全奏効率 CRR:完全奏効割合 MRD:微小残存病変 TTR:PR以上の奏効までの期間 DOR:奏効持続期間
PFS:無増悪生存期間 TTP:無増悪期間 OS:全生存期間 HRQoL:健康関連QOL
PR:部分奏効 VGPR:非常に良好な部分奏効 CR:完全奏効
結果
- 追跡期間中央値:13.3ヵ月.
- 全体のORR:73% (95%CI 66-81, p<0.001).
- 全体のCRR:33%.
- 完全奏効を示した42人のうち、 33人 (79%) が感度レベル10*-5でMRD陰性.
- TTR:中央値1.0ヵ月 (範囲:0.5-8.8) .
- DOR:中央値 (推定) 全体で10.7ヵ月 (95%CI 9.0-11.3)、 450×10⁶用量で11.3ヵ月 (95%CI 10.3-11.4).
- DORは奏効の深さと共に延長. 奏効別のDOR中央値は、 PR:4.5ヵ月 (95%CI 2.9-6.7)、 VGPR:10.4ヵ月 (95%CI 5.1-11.3)、 CR又はsCR:19.0ヵ月 (95%CI 11.3-推定不能).
- PFS中央値 (推定):全体で8.8ヵ月 (95%CI 5.6-11.6)、 450×10⁶用量で12.1ヵ月 (95%CI 8.8-12.3)、CRもしくsCRで20.2ヵ月 (95%CI 12.3-推定不能).
- OS中央値 (推定):19.4ヵ月 (95%CI 18.2-推定不能)、 12ヵ月時点での全生存率は78%.
- 主な有害事象 (発現率≧30%):好中球減少症、 CRS、 貧血、 血小板減少症、 白血球減少症、 低カリウム血症、 下痢、 疲労等.
- 主な有害事象 (≧Grade 3):血液毒性、 CRS、 感染症等 (詳細は上記).
参考文献
- N Engl J Med. 2021 Feb 25;384(8):705-716.
- アベクマⓇ点滴静注 適正使用ガイド
- Int J Cancer. 2021 Mar 1;148(5):1192-1196.
最終更新:2023年12月8日
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。