本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 高度催吐性
【FN発症】中リスク (10%–20%)
*日本化薬の外部サイトへ遷移します
*中外製薬株式会社の外部サイトへ遷移します
*MSD製薬の外部サイトへ遷移します
用法用量
KEYNOTE-826試験⁸⁾のプロトコル
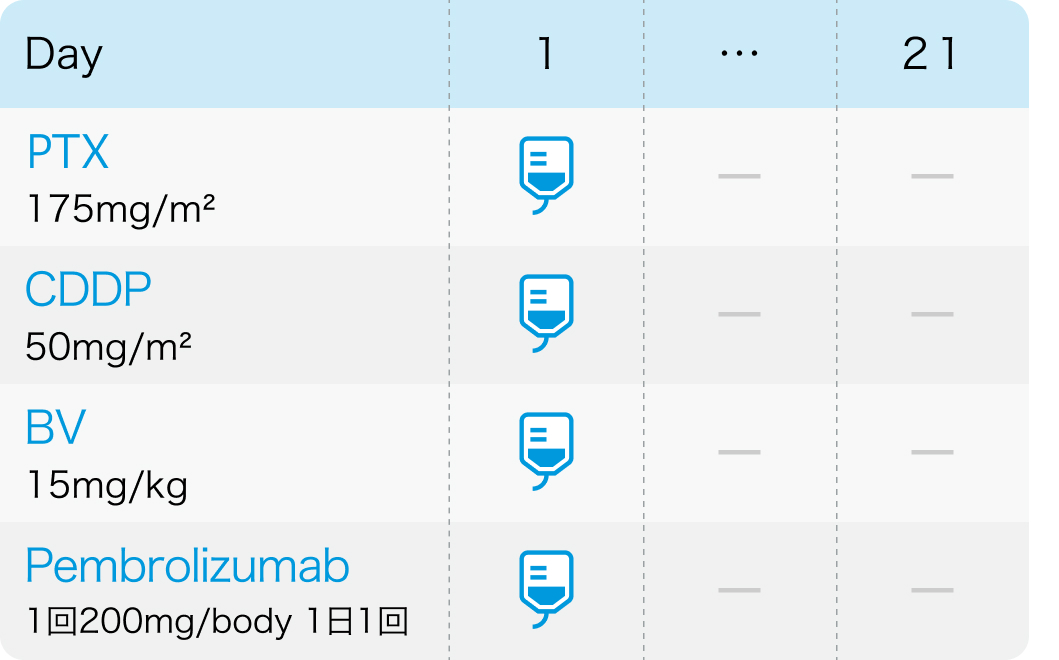
1コース3週間で、 PDまで継続 (Pembrolizumabは最大35コース、 その他は最大6コース)
N Engl J Med. 2021 Nov 11;385(20):1856-1867⁸⁾より作図、 引用
※BV以外、 電子添文の効能又は効果、 用法及び用量と異なる
電子添文の用法および用量
PTX : 子宮頸癌には[D法]を使用。 D法では、 1日1回135mg/m²を24時間かけ点滴静注、 少なくとも3週間休薬。 これを1クールとし繰り返す。 タキソール®電子添文 (2023年07月改訂第2版)¹⁾より引用
CDDP : 子宮頸癌には [A法] [E法]を使用。 A法では、 シスプラチンとして、 1日1回15~20mg/m²を1日1回、 5日間連続投与し、 少なくとも2週間休薬。 E法では、 70~90mg/m²を1日1回投与し、 少なくとも3週間休薬する。 これらを1クールとして、 投与を繰り返す。 パラプラチン®電子添文 (2023年5月改訂 第3版)²⁾より引用
Pembrolizumab : 子宮頸癌には他の抗悪性腫瘍剤との併用において、 1回200mgを3週間間隔または1回400mgを6週間間隔で30分間かけ点滴静注。 キイトルーダ®電子添文 (2024年1月改訂 第17版)⁶⁾より引用
前投薬・投与スケジュール例
- 生食 500ml+Mg 8~20mEq (60分)
- DEX 9.9mg+H₂拮抗薬+抗ヒスタミン薬+生食 50ml (30分)
- NK1阻害剤+5-HT₃+生食 50ml (30分)
- オランザピン5mg1日1回 Day1-4内服
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
PTX電子添文
投与約30分前までに投与を終了するように、 デキサメタゾンリン酸エステルナトリウム注射液 (デキサメタゾンとして8mg) 及びラニチジン塩酸塩注射液 (ラニチジンとして50mg) または注射用ファモチジン (ファモチジンとして20mg) を静脈内投与、 ジフェンヒドラミン塩酸塩錠 (ジフェンヒドラミン塩酸塩として50mg) を経口投与すること。
デキサメタゾンは初回投与時8mgとし、 次回投与時までに過敏症状の発現がみられなかった場合または臨床上特に問題のない過敏症状の場合は、 2週目の投与より半量 (4mg) に減量し投与してもよい。 以降の投与週においても同様の場合、 半量ずつ最低1mgまで減量し投与してもよい。
タキソール®電子添文 (2023年7月改訂 第2版)¹⁾より引用
投与開始基準
KEYNOTE-826試験⁸⁾のプロトコル
化学療法未治療の手術又は放射線療法による根治治療の対象とならない進行又は再発の子宮頸癌患者 (18歳以上)
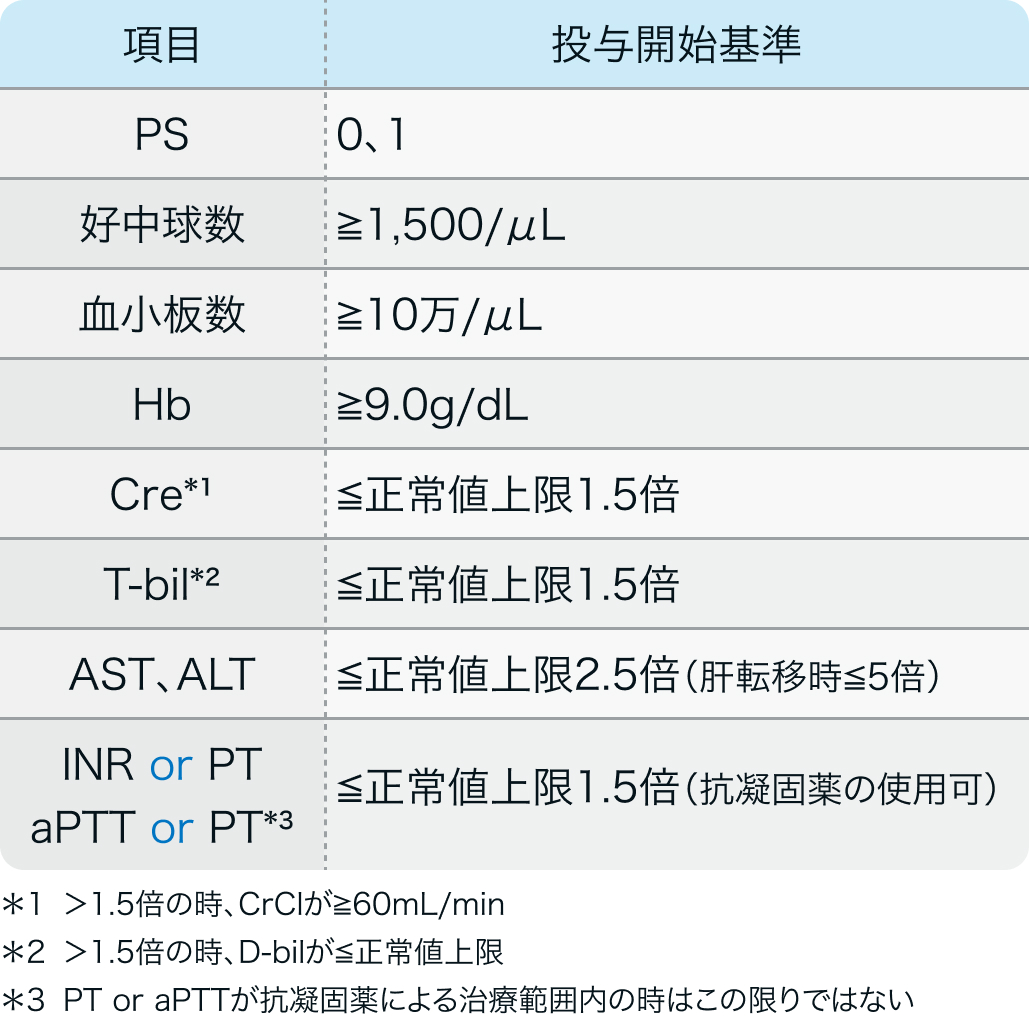
N Engl J Med. 2021 Nov 11;385(20):1856-1867⁸⁾より作図
減量・休薬・中止基準
ペムブロリズマブ電子添文⁶⁾の基準

キイトルーダ®電子添文 (2024年1月改訂 第17版)⁶⁾より作図
KeyData|臨床試験結果
KEYNOTE-826試験⁸⁾
対象: 治療抵抗性・再発または転移性の子宮頸癌患者617例 (日本人57例含む)
方法: Pembrolizumab 200mgQ3W + 化学療法* ± BV群 vs プラセボ + 化学療法* ± BV群
*併用化学療法はパクリタキセル+シスプラチン、 またはパクリタキセル+カルボプラチン
【有効性】 (全体集団)
- ORR 65.9%
- mPFS 10.4ヵ月
- OS率* 50.4%
*24ヵ月時点
【安全性】主な有害事象 (カッコ内 Grade3~5)
PembroにTP±BVまたはTC±BVを併用した群の結果
- 貧血 61.2% (30.3%)
- 悪心 39.7% (2.0%)
- 下痢 35.5% (2.0%)
- 倦怠感 28.7% (3.6%)
- 便秘 28.3% (0.3%)
- 嘔吐 26.4% (2.6%)
- 好中球数減少 23.5% (12.4%)
- 血小板数減少 19.9% (7.5%)
- 脱毛症 56.4% (0%)
- 高血圧 24.1% (9.4%)
N Engl J Med. 2021 Nov 11;385(20):1856-1867⁸⁾より引用
エキスパートによるワンポイント
再発・転移のある子宮頸がんの1次療法
TCまたは、 TP療法にペムブロリズマブを加えることにより、 PFS (無増悪生存期間)、 OS (全生存期間) を有意に延長しました⁸⁾。 保険適応では、 PD-L1の発現の有無に関わらず、 使用可能ではありますが、 サブグループ解析ですが、 PD-L1 (CPS)<1では、 ベネフィットが得られない傾向 (HR 0.94, 95%CI 0.52-1.70)⁸⁾にありますので、 PD-L1を確認することが望ましいと思います。
irAE対策のチーム体制構築が重要
また、 ペムブロリズマブを使用する際には、 重篤なirAE (免疫関連有害事象) にも対応できるよう、 各種専門家 (脳神経内科、 呼吸器内科、 リウマチ・膠原病内科、 消化器内科、 内分泌内科、 循環器内科、 腎臓内科、 血液内科、 眼科、 皮膚科) にもいつでも相談できるチーム体制を整えておくことが必要です。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- クリニジェン株式会社. タキソール®電子添文 (2023年7月改訂 第2版) [最終閲覧 : 2024/04/11]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/04/11]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/04/11]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/04/11]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2022年6月作成) [最終閲覧 : 2024/04/11]
- MSD製薬. キイトルーダ®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/11]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年3月作成) [最終閲覧 : 2024/04/11]
- Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. N Engl J Med. 2021 Nov 11;385(20):1856-1867. PMID: 34534429
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
TP ± BV + Pembrolizumab
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 高度催吐性
【FN発症】中リスク (10%–20%)
*日本化薬の外部サイトへ遷移します
*中外製薬株式会社の外部サイトへ遷移します
*MSD製薬の外部サイトへ遷移します
用法用量
KEYNOTE-826試験⁸⁾のプロトコル

1コース3週間で、 PDまで継続 (Pembrolizumabは最大35コース、 その他は最大6コース)
N Engl J Med. 2021 Nov 11;385(20):1856-1867⁸⁾より作図、 引用
※BV以外、 電子添文の効能又は効果、 用法及び用量と異なる
電子添文の用法および用量
PTX : 子宮頸癌には[D法]を使用。 D法では、 1日1回135mg/m²を24時間かけ点滴静注、 少なくとも3週間休薬。 これを1クールとし繰り返す。 タキソール®電子添文 (2023年07月改訂第2版)¹⁾より引用
CDDP : 子宮頸癌には [A法] [E法]を使用。 A法では、 シスプラチンとして、 1日1回15~20mg/m²を1日1回、 5日間連続投与し、 少なくとも2週間休薬。 E法では、 70~90mg/m²を1日1回投与し、 少なくとも3週間休薬する。 これらを1クールとして、 投与を繰り返す。 パラプラチン®電子添文 (2023年5月改訂 第3版)²⁾より引用
Pembrolizumab : 子宮頸癌には他の抗悪性腫瘍剤との併用において、 1回200mgを3週間間隔または1回400mgを6週間間隔で30分間かけ点滴静注。 キイトルーダ®電子添文 (2024年1月改訂 第17版)⁶⁾より引用
前投薬・投与スケジュール例
- 生食 500ml+Mg 8~20mEq (60分)
- DEX 9.9mg+H₂拮抗薬+抗ヒスタミン薬+生食 50ml (30分)
- NK1阻害剤+5-HT₃+生食 50ml (30分)
- オランザピン5mg1日1回 Day1-4内服
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
PTX電子添文
投与約30分前までに投与を終了するように、 デキサメタゾンリン酸エステルナトリウム注射液 (デキサメタゾンとして8mg) 及びラニチジン塩酸塩注射液 (ラニチジンとして50mg) または注射用ファモチジン (ファモチジンとして20mg) を静脈内投与、 ジフェンヒドラミン塩酸塩錠 (ジフェンヒドラミン塩酸塩として50mg) を経口投与すること。
デキサメタゾンは初回投与時8mgとし、 次回投与時までに過敏症状の発現がみられなかった場合または臨床上特に問題のない過敏症状の場合は、 2週目の投与より半量 (4mg) に減量し投与してもよい。 以降の投与週においても同様の場合、 半量ずつ最低1mgまで減量し投与してもよい。
タキソール®電子添文 (2023年7月改訂 第2版)¹⁾より引用
投与開始基準
KEYNOTE-826試験⁸⁾のプロトコル
化学療法未治療の手術又は放射線療法による根治治療の対象とならない進行又は再発の子宮頸癌患者 (18歳以上)

N Engl J Med. 2021 Nov 11;385(20):1856-1867⁸⁾より作図
減量・休薬・中止基準
ペムブロリズマブ電子添文⁶⁾の基準

キイトルーダ®電子添文 (2024年1月改訂 第17版)⁶⁾より作図
KeyData|臨床試験結果
KEYNOTE-826試験⁸⁾
対象: 治療抵抗性・再発または転移性の子宮頸癌患者617例 (日本人57例含む)
方法: Pembrolizumab 200mgQ3W + 化学療法* ± BV群 vs プラセボ + 化学療法* ± BV群
*併用化学療法はパクリタキセル+シスプラチン、 またはパクリタキセル+カルボプラチン
【有効性】 (全体集団)
- ORR 65.9%
- mPFS 10.4ヵ月
- OS率* 50.4%
*24ヵ月時点
【安全性】主な有害事象 (カッコ内 Grade3~5)
PembroにTP±BVまたはTC±BVを併用した群の結果
- 貧血 61.2% (30.3%)
- 悪心 39.7% (2.0%)
- 下痢 35.5% (2.0%)
- 倦怠感 28.7% (3.6%)
- 便秘 28.3% (0.3%)
- 嘔吐 26.4% (2.6%)
- 好中球数減少 23.5% (12.4%)
- 血小板数減少 19.9% (7.5%)
- 脱毛症 56.4% (0%)
- 高血圧 24.1% (9.4%)
N Engl J Med. 2021 Nov 11;385(20):1856-1867⁸⁾より引用
エキスパートによるワンポイント
再発・転移のある子宮頸がんの1次療法
TCまたは、 TP療法にペムブロリズマブを加えることにより、 PFS (無増悪生存期間)、 OS (全生存期間) を有意に延長しました⁸⁾。 保険適応では、 PD-L1の発現の有無に関わらず、 使用可能ではありますが、 サブグループ解析ですが、 PD-L1 (CPS)<1では、 ベネフィットが得られない傾向 (HR 0.94, 95%CI 0.52-1.70)⁸⁾にありますので、 PD-L1を確認することが望ましいと思います。
irAE対策のチーム体制構築が重要
また、 ペムブロリズマブを使用する際には、 重篤なirAE (免疫関連有害事象) にも対応できるよう、 各種専門家 (脳神経内科、 呼吸器内科、 リウマチ・膠原病内科、 消化器内科、 内分泌内科、 循環器内科、 腎臓内科、 血液内科、 眼科、 皮膚科) にもいつでも相談できるチーム体制を整えておくことが必要です。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- クリニジェン株式会社. タキソール®電子添文 (2023年7月改訂 第2版) [最終閲覧 : 2024/04/11]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/04/11]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/04/11]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/04/11]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2022年6月作成) [最終閲覧 : 2024/04/11]
- MSD製薬. キイトルーダ®電子添文 (2024年1月改訂 第17版) [最終閲覧 : 2024/04/11]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年3月作成) [最終閲覧 : 2024/04/11]
- Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. N Engl J Med. 2021 Nov 11;385(20):1856-1867. PMID: 34534429
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。