CPT-11: Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
RAM:Ramucirumab(サイラムザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1~ | Day1 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリー株式会社の外部サイトへ遷移します
用法用量
HGCSG1603試験⁴⁾のプロトコル
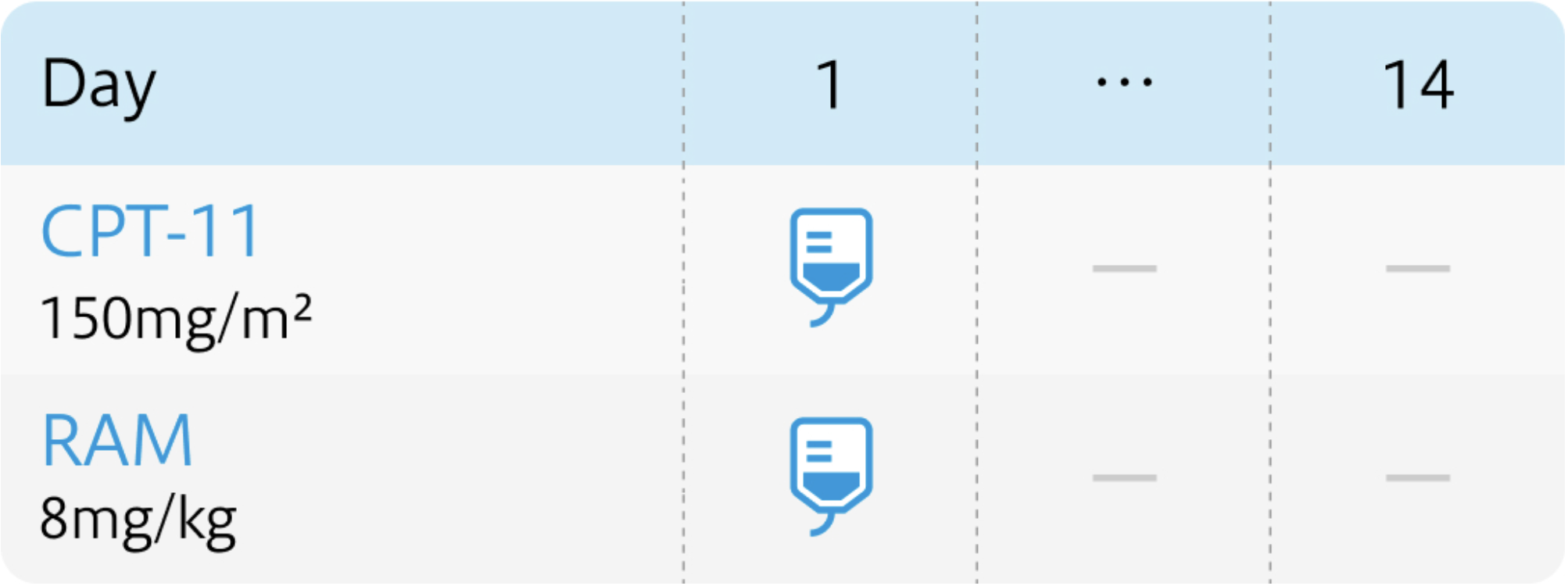
Oncologist. 2022 Aug 5;27(8):e642-e649⁴⁾より作図
前投薬
Infusion reaction予防として
デキサメタゾン3.3mg/mL 2mL+クロルフェニラミン5mg1A+パロノセトロン0.75mg 50mL
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
投与開始基準
HGCSG1603試験⁴⁾のプロトコル
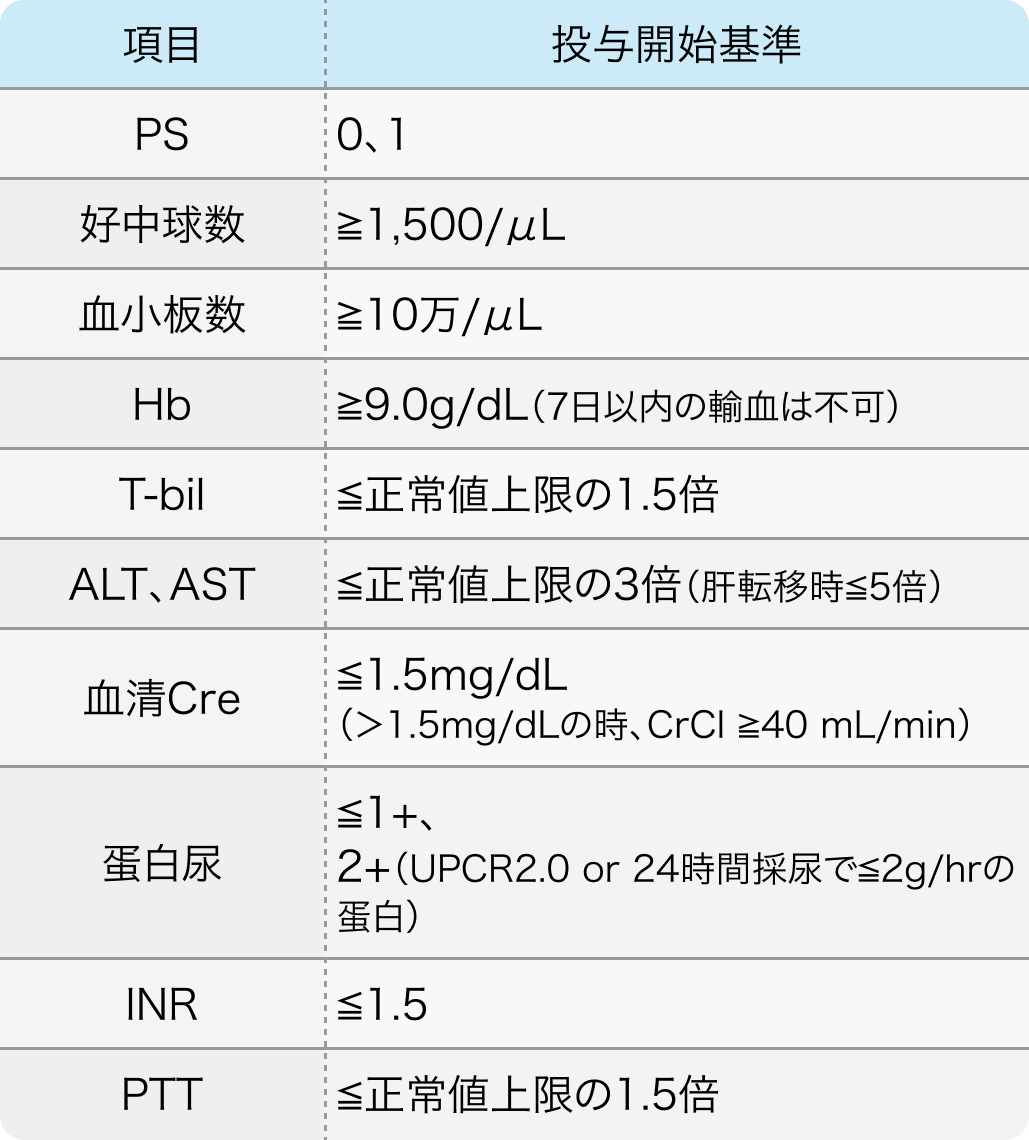
Oncologist. 2022 Aug 5;27(8):e642-e649⁴⁾より作図
RINDBeRG試験⁵⁾のプロトコル
以下に該当する患者
- 20歳以上
- 放射線学的に評価可能な切除不能または再発胃/食道胃接合部腺癌
- PS 0-1の患者
- ラムシルマブで効果不十分
- フッ化ピリミジン、 白金製剤、 タキサン系抗癌剤の治療歴があり
RINDBeRG Tria⁵⁾より引用
主な有害事象
HGCSG1603試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少 82.9% (51.4%)
- 貧血 82.9% (20.0%)
- 白血球数減少 77.1% (42.9%)
- 血小板数減少 62.9% (5.7%)
- 発熱性好中球減少症 11.4% (11.4%)
- 倦怠感 68.6% (2.9%)
- 下痢 48.6% (8.6%)
- 悪心 34.3% (0%)
- 嘔吐 25.7% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧 91.4% (8.6%)
- 蛋白尿 51.4% (8.6%)
- 脱毛症 42.9% (0%)
Oncologist. 2022 Aug 5;27(8):e642-e649⁴⁾より引用
RINDBeRG試験⁵⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 68.2% (25.1%)
- 好中球数減少 76.4% (46.7%)
- 血小板数減少 32.8% (2.1%)
- AST上昇 39.5% (3.1%)
- ALT上昇 30.8% (1.5%)
- 下痢 58.5% (9.2%)
- 悪心 50.8% (3.1%)
- 嘔吐 25.1% (1.5%)
- 粘膜炎 22.1% (1.0%)
- 便秘 16.4% (0.5%)
- 発熱性好中球減少症 4.1% (4.1%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 18.5% (0%)
- 高血圧 11.8% (5.1%)
RINDBeRG Tria⁵⁾より引用
上手に使うためのワンポイント
- RAMの血中濃度と有効性に相関が見られる報告があり⁶⁾ 、 nab-PTXが投与困難な場合でもRAMの禁忌が無い場合はRAMのみ投与する。
- RAMのinfusion reactionの頻度は低く⁷⁾⁸⁾、 適正使用ガイドにおいてもinfusion reaction予防の前投与は 「考慮」 となっている。 症例によっては前投薬のヒスタミン阻害剤は省略可能である。
- RAMで蛋白尿を生じることがあるが、 尿定性で2+以上でもUPCR<2であれば投与可能である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドライン⁹⁾では、 2次治療以降の推奨されるレジメンの1つである。
- UGT1A1活性が低い症例 (UGT1A16及びUGT1A128のいずれかがホモ接合体またはダブルヘテロ接合体) の多型で好中球数減少や下痢の頻度が高くなるため、 可能な限り治療開始前に測定しておく。 ホモ欠損、 ダブルヘテロ型では1段階以上減量して開始する。
- IRIの代謝産物であるSN-38は腸管で排泄されるため、 通過障害を有する症例には投与禁忌である。
- 大量腹水も重篤な副作用の発現リスクがあるため、 投与禁忌である。
- 間質性肺炎・肺線維症の症例は薬剤性肺炎のリスクが高いため、 投与禁忌である。 投与前に必ずCTで肺野所見を確認する。
- RAMはBmabと異なり、 蛋白尿Grade3を生じた場合は次回投与以降減量が必要である。
- RAMのbeyond progressionやadj DSの早期再発例での有効性が期待されている。 前者はIRIとIRI+RAMを比較検討した第Ⅲ相試験であるRINDBeRG試験⁵⁾ (jRCTs051180187) の結果がESMO 2023で報告されるため、 参考いただきたい。 後者は術後ドセタキセル+S1 (DS) 療法後早期再発例を対象とした第Ⅱ相試験であるOGSG1901試験 (jRCTs051190071) が現在進行中である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
HGCSG1603試験⁴⁾
初回化学療法に不応の治癒切除不能進行・再発胃癌に対するイリノテカン/ラムシルマブ併用療法の有効性と安全性を評価することを目的とした多施設共同医師主導前向き第II相試験。 主要評価項目は6ヵ月時点の無増悪生存割合で、 副次評価項目は全生存期間 (OS)、 無増悪生存期間 (PFS)、 奏効率 (ORR)、 安全性、 各薬剤の用量強度とされた。
Oncologist. 2022 Aug 5;27(8):e642-e649.
出典
1) アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/7/11]
2) 日本イーライリリー株式会社. サイラムザ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/7/11]
3) 日本イーライリリー株式会社. サイラムザ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/7/11]
*Annals of Oncologyの外部サイトへ遷移します
9) 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年8月21日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
IRI + RAM
CPT-11: Irinotecan(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
RAM:Ramucirumab(サイラムザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 8mg/kg 点滴 | 1~ | Day1 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリー株式会社の外部サイトへ遷移します
用法用量
HGCSG1603試験⁴⁾のプロトコル

Oncologist. 2022 Aug 5;27(8):e642-e649⁴⁾より作図
前投薬
Infusion reaction予防として
デキサメタゾン3.3mg/mL 2mL+クロルフェニラミン5mg1A+パロノセトロン0.75mg 50mL
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
投与開始基準
HGCSG1603試験⁴⁾のプロトコル

Oncologist. 2022 Aug 5;27(8):e642-e649⁴⁾より作図
RINDBeRG試験⁵⁾のプロトコル
以下に該当する患者
- 20歳以上
- 放射線学的に評価可能な切除不能または再発胃/食道胃接合部腺癌
- PS 0-1の患者
- ラムシルマブで効果不十分
- フッ化ピリミジン、 白金製剤、 タキサン系抗癌剤の治療歴があり
RINDBeRG Tria⁵⁾より引用
主な有害事象
HGCSG1603試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 好中球減少 82.9% (51.4%)
- 貧血 82.9% (20.0%)
- 白血球数減少 77.1% (42.9%)
- 血小板数減少 62.9% (5.7%)
- 発熱性好中球減少症 11.4% (11.4%)
- 倦怠感 68.6% (2.9%)
- 下痢 48.6% (8.6%)
- 悪心 34.3% (0%)
- 嘔吐 25.7% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧 91.4% (8.6%)
- 蛋白尿 51.4% (8.6%)
- 脱毛症 42.9% (0%)
Oncologist. 2022 Aug 5;27(8):e642-e649⁴⁾より引用
RINDBeRG試験⁵⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球数減少 68.2% (25.1%)
- 好中球数減少 76.4% (46.7%)
- 血小板数減少 32.8% (2.1%)
- AST上昇 39.5% (3.1%)
- ALT上昇 30.8% (1.5%)
- 下痢 58.5% (9.2%)
- 悪心 50.8% (3.1%)
- 嘔吐 25.1% (1.5%)
- 粘膜炎 22.1% (1.0%)
- 便秘 16.4% (0.5%)
- 発熱性好中球減少症 4.1% (4.1%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 18.5% (0%)
- 高血圧 11.8% (5.1%)
RINDBeRG Tria⁵⁾より引用
上手に使うためのワンポイント
- RAMの血中濃度と有効性に相関が見られる報告があり⁶⁾ 、 nab-PTXが投与困難な場合でもRAMの禁忌が無い場合はRAMのみ投与する。
- RAMのinfusion reactionの頻度は低く⁷⁾⁸⁾、 適正使用ガイドにおいてもinfusion reaction予防の前投与は 「考慮」 となっている。 症例によっては前投薬のヒスタミン阻害剤は省略可能である。
- RAMで蛋白尿を生じることがあるが、 尿定性で2+以上でもUPCR<2であれば投与可能である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
特徴と注意点
- 胃癌治療ガイドライン⁹⁾では、 2次治療以降の推奨されるレジメンの1つである。
- UGT1A1活性が低い症例 (UGT1A16及びUGT1A128のいずれかがホモ接合体またはダブルヘテロ接合体) の多型で好中球数減少や下痢の頻度が高くなるため、 可能な限り治療開始前に測定しておく。 ホモ欠損、 ダブルヘテロ型では1段階以上減量して開始する。
- IRIの代謝産物であるSN-38は腸管で排泄されるため、 通過障害を有する症例には投与禁忌である。
- 大量腹水も重篤な副作用の発現リスクがあるため、 投与禁忌である。
- 間質性肺炎・肺線維症の症例は薬剤性肺炎のリスクが高いため、 投与禁忌である。 投与前に必ずCTで肺野所見を確認する。
- RAMはBmabと異なり、 蛋白尿Grade3を生じた場合は次回投与以降減量が必要である。
- RAMのbeyond progressionやadj DSの早期再発例での有効性が期待されている。 前者はIRIとIRI+RAMを比較検討した第Ⅲ相試験であるRINDBeRG試験⁵⁾ (jRCTs051180187) の結果がESMO 2023で報告されるため、 参考いただきたい。 後者は術後ドセタキセル+S1 (DS) 療法後早期再発例を対象とした第Ⅱ相試験であるOGSG1901試験 (jRCTs051190071) が現在進行中である。
執筆 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
関連する臨床試験
HGCSG1603試験⁴⁾
初回化学療法に不応の治癒切除不能進行・再発胃癌に対するイリノテカン/ラムシルマブ併用療法の有効性と安全性を評価することを目的とした多施設共同医師主導前向き第II相試験。 主要評価項目は6ヵ月時点の無増悪生存割合で、 副次評価項目は全生存期間 (OS)、 無増悪生存期間 (PFS)、 奏効率 (ORR)、 安全性、 各薬剤の用量強度とされた。
Oncologist. 2022 Aug 5;27(8):e642-e649.
出典
1) アルフレッサ ファーマ株式会社. トポテシン®電子添文 (2023年8月改訂 第1版) [最終閲覧 : 2024/7/11]
2) 日本イーライリリー株式会社. サイラムザ®電子添文 (2024年6月改訂第4版) [最終閲覧 : 2024/7/11]
3) 日本イーライリリー株式会社. サイラムザ®適正使用ガイド (2024年6月作成) [最終閲覧 : 2024/7/11]
*Annals of Oncologyの外部サイトへ遷移します
9) 日本胃癌学会. 胃癌治療ガイドライン医師用2021年7月改訂 第6版
最終更新日 : 2024年8月21日
執筆医 : 静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
