治療スケジュール
概要
監修医師
Imatinib:イマチニブ(グリベック®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1日1回 400mg 経口 | 1 | Day 1~ |
その他
| 食後に経口投与. |
| TDMを行い用量調節 (概要欄参照). |
| 肝障害、 骨髄抑制が規定以上あった場合は回復するまで中止. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
- グリベック® (添付文書)
主な有害事象
N Engl J Med. 2003 Mar 13;348(11):994-1004.¹⁾より引用.
骨髄抑制
- 貧血 (44.6%、 ≧Grade3 3.1%)
- 好中球減少 (60.8%、 ≧Grade3 14.3%)
- 血小板減少 (56.6%、 ≧Grade3 7.8%)
重大な有害事象
- ALTまたはAST上昇 (43.2%、 ≧Grade3 5.1%)
- 浮腫 (55.5%、 ≧Grade3 0.9%)
- 吐き気 (43.7%、 ≧Grade3 0.7%)
- 嘔吐 (16.9%、 ≧Grade3 1.5%)
- 筋痙攣 (38.3%、 ≧Grade3 1.3%)
- 筋骨格痛 (36.5%、 ≧Grade3 2.7%)
- 発疹 (33.9%、 ≧Grade3 2.0%)
- 倦怠感 (34.5%、 ≧Grade3 1.1%)
- 下痢 (32.8%、 ≧Grade3 1.8%)
- 頭痛 (31.2%、 ≧Grade3 0.4%)
- 関節痛 (28.3%、 ≧Grade3 2.4%)
- 腹部痛 (27.0%、 ≧Grade3 2.4%)
- 鼻咽頭痛 (22.0%、 ≧Grade3 0%)
- 筋肉痛 (21.4%、 ≧Grade3 1.5%)
- 出血 (20.9%、 ≧Grade3 0.7%)
- ディスペプシア (16.2%、 ≧Grade3 0%)
- 咽頭喉頭痛 (16.0%、 ≧Grade3 0.2%)
- 咳嗽 (14.5%、 ≧Grade3 0.2%)
- 眩暈 (14.5%、 ≧Grade3 0.9%)
- 上気道感染 (14.5%、 ≧Grade3 0.2%)
- 体重増加 (13.4%、 ≧Grade3 0.9%)
- 発熱 (13.1%、 ≧Grade3 0.7%)
- 不眠 (12.2%、 ≧Grade3 0%)
- 抑うつ (10.2%、 ≧Grade3 0.4%)
その他
- 便秘 (8.5%、 ≧Grade3 0.7%)
特徴と注意点
- イマチニブは慢性期CMLに対し、 第一選択とされるTKIの一つ.
- 用量比較試験 (800mg vs 400mg) では、 有効性に関する差は明らかでないため、 400mgからの開始を推奨²⁾.
- 治療効果やアドヒアランス確認のため、 TDMが推奨される³⁾.
- TDMの指標:イマチニブの最小有効濃度1000ng/mL⁴⁾.
- CYP3A4阻害作用、 また誘導作用をもつ薬剤との併用は、 本薬剤、 相手薬剤ともに血中濃度が増減する可能性があるため注意.
- 治療効果モニタリングは3ヵ月ごとに行い、 無効又は鈍化となった場合は遺伝子変異検査を行い治療薬の変更を考慮.
- 第二世代TKI (ニロチニブ、ダサチニブ) は、 イマチニブに比べ、 治療効果の優位性が示されているが、 心血管系副作用の頻度が高い⁵⁾ ⁶⁾.
- DMRが得られてもTKI治療終了については明確な基準が無く、 臨床試験や特別な事情 (妊娠や重篤な副作用) がある場合を除いてはTKIの中止は推奨されない.
感染対策
- HBV再活性化リスクを考慮し、 適切なスクリーニング検査とモニタリングを行う.
副作用と対策
- 吐き気が強い場合は、 1日のうち最も量の多い食後に多めの水で内服し、 就寝2時間前までに済ませる.
- 催奇形性があるため、 服用中は避妊を行う. 服用中止後は6ヵ月の避妊が望ましい.
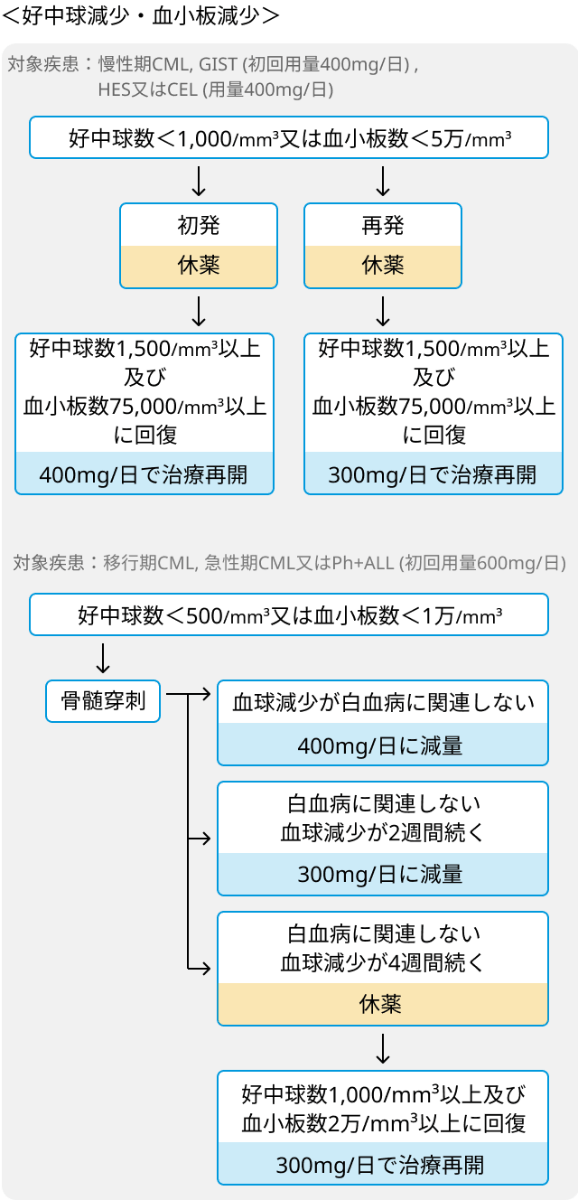
- 肝機能障害、 好中球減少・血小板減少があった場合は、 下記を参照の上で休薬、 再開を検討.

関連する臨床試験の結果
N Engl J Med. 2003 Mar 13;348(11):994-1004.¹⁾
概要
- 慢性期CML1106人に対して行われた第3相ランダム化比較試験.
- イマチニブ群 (400mg経口) と低用量シタラビン+インターフェロン群 (以下対照群) において、 CHR、 CyR、 CCyR、 PFS、 進行抑制率、 忍容性ついて比較.
CHR:血液学的完全奏功 CyR:細胞遺伝学的奏効
CCyR:細胞遺伝学的完全奏効 PFS:無増悪生存期間
結果
- 追跡期間中央値19ヵ月.
- CHR:イマチニブ群95.3% vs 対照群55.5% (p<0.001).
- CyR推定率:イマチニブ群87.1% (95%CI 84.1~90.0) vs 対照群34.7% (95%CI 29.3~40.0).
- CCyR推定率:イマチニブ群76.2% (95%CI 72.5~79.9) vs 対照群14.5% (95%CI 10.5~18.5).
- 12ヵ月PFS:イマチニブ群96.6% vs 対照群79.9% (p<0.001).
- AP期、 BP期への抑制推定率:イマチニブ群96.7% vs 対照群91.5% (p<0.001).
- イマチニブ群の有害事象は、 概ねGrade1~2であり、 多くは浮腫、 吐き気、 筋肉痛、 発疹であった.
- イマチニブは、 慢性期CMLの第一選択療法として、 効果、 忍容性ともに対照群よりも優れていた.
参考文献
- N Engl J Med. 2003 Mar 13;348(11):994-1004.
- J Clin Oncol. 2010 Jan 20;28(3):424-30.
- Blood. 2015 Feb 5;125(6):915-23.
- Clin Pharmacol Ther. 2010 Dec;88(6):809-13.
- Leukemia. 2016 May;30(5):1044-54.
- J Clin Oncol. 2016 Jul 10;34(20):2333-40.
最終更新:2023年5月26日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
Imatinib
イマチニブ(グリベック®)
2023年05月26日更新
Imatinib:イマチニブ(グリベック®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1日1回 400mg 経口 | 1 | Day 1~ |
その他
| 食後に経口投与. |
| TDMを行い用量調節 (概要欄参照). |
| 肝障害、 骨髄抑制が規定以上あった場合は回復するまで中止. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
- グリベック® (添付文書)
主な有害事象
N Engl J Med. 2003 Mar 13;348(11):994-1004.¹⁾より引用.
骨髄抑制
- 貧血 (44.6%、 ≧Grade3 3.1%)
- 好中球減少 (60.8%、 ≧Grade3 14.3%)
- 血小板減少 (56.6%、 ≧Grade3 7.8%)
重大な有害事象
- ALTまたはAST上昇 (43.2%、 ≧Grade3 5.1%)
- 浮腫 (55.5%、 ≧Grade3 0.9%)
- 吐き気 (43.7%、 ≧Grade3 0.7%)
- 嘔吐 (16.9%、 ≧Grade3 1.5%)
- 筋痙攣 (38.3%、 ≧Grade3 1.3%)
- 筋骨格痛 (36.5%、 ≧Grade3 2.7%)
- 発疹 (33.9%、 ≧Grade3 2.0%)
- 倦怠感 (34.5%、 ≧Grade3 1.1%)
- 下痢 (32.8%、 ≧Grade3 1.8%)
- 頭痛 (31.2%、 ≧Grade3 0.4%)
- 関節痛 (28.3%、 ≧Grade3 2.4%)
- 腹部痛 (27.0%、 ≧Grade3 2.4%)
- 鼻咽頭痛 (22.0%、 ≧Grade3 0%)
- 筋肉痛 (21.4%、 ≧Grade3 1.5%)
- 出血 (20.9%、 ≧Grade3 0.7%)
- ディスペプシア (16.2%、 ≧Grade3 0%)
- 咽頭喉頭痛 (16.0%、 ≧Grade3 0.2%)
- 咳嗽 (14.5%、 ≧Grade3 0.2%)
- 眩暈 (14.5%、 ≧Grade3 0.9%)
- 上気道感染 (14.5%、 ≧Grade3 0.2%)
- 体重増加 (13.4%、 ≧Grade3 0.9%)
- 発熱 (13.1%、 ≧Grade3 0.7%)
- 不眠 (12.2%、 ≧Grade3 0%)
- 抑うつ (10.2%、 ≧Grade3 0.4%)
その他
- 便秘 (8.5%、 ≧Grade3 0.7%)
特徴と注意点
- イマチニブは慢性期CMLに対し、 第一選択とされるTKIの一つ.
- 用量比較試験 (800mg vs 400mg) では、 有効性に関する差は明らかでないため、 400mgからの開始を推奨²⁾.
- 治療効果やアドヒアランス確認のため、 TDMが推奨される³⁾.
- TDMの指標:イマチニブの最小有効濃度1000ng/mL⁴⁾.
- CYP3A4阻害作用、 また誘導作用をもつ薬剤との併用は、 本薬剤、 相手薬剤ともに血中濃度が増減する可能性があるため注意.
- 治療効果モニタリングは3ヵ月ごとに行い、 無効又は鈍化となった場合は遺伝子変異検査を行い治療薬の変更を考慮.
- 第二世代TKI (ニロチニブ、ダサチニブ) は、 イマチニブに比べ、 治療効果の優位性が示されているが、 心血管系副作用の頻度が高い⁵⁾ ⁶⁾.
- DMRが得られてもTKI治療終了については明確な基準が無く、 臨床試験や特別な事情 (妊娠や重篤な副作用) がある場合を除いてはTKIの中止は推奨されない.
感染対策
- HBV再活性化リスクを考慮し、 適切なスクリーニング検査とモニタリングを行う.
副作用と対策
- 吐き気が強い場合は、 1日のうち最も量の多い食後に多めの水で内服し、 就寝2時間前までに済ませる.
- 催奇形性があるため、 服用中は避妊を行う. 服用中止後は6ヵ月の避妊が望ましい.
- 肝機能障害、 好中球減少・血小板減少があった場合は、 下記を参照の上で休薬、 再開を検討.


関連する臨床試験の結果
N Engl J Med. 2003 Mar 13;348(11):994-1004.¹⁾
概要
- 慢性期CML1106人に対して行われた第3相ランダム化比較試験.
- イマチニブ群 (400mg経口) と低用量シタラビン+インターフェロン群 (以下対照群) において、 CHR、 CyR、 CCyR、 PFS、 進行抑制率、 忍容性ついて比較.
CHR:血液学的完全奏功 CyR:細胞遺伝学的奏効
CCyR:細胞遺伝学的完全奏効 PFS:無増悪生存期間
結果
- 追跡期間中央値19ヵ月.
- CHR:イマチニブ群95.3% vs 対照群55.5% (p<0.001).
- CyR推定率:イマチニブ群87.1% (95%CI 84.1~90.0) vs 対照群34.7% (95%CI 29.3~40.0).
- CCyR推定率:イマチニブ群76.2% (95%CI 72.5~79.9) vs 対照群14.5% (95%CI 10.5~18.5).
- 12ヵ月PFS:イマチニブ群96.6% vs 対照群79.9% (p<0.001).
- AP期、 BP期への抑制推定率:イマチニブ群96.7% vs 対照群91.5% (p<0.001).
- イマチニブ群の有害事象は、 概ねGrade1~2であり、 多くは浮腫、 吐き気、 筋肉痛、 発疹であった.
- イマチニブは、 慢性期CMLの第一選択療法として、 効果、 忍容性ともに対照群よりも優れていた.
参考文献
- N Engl J Med. 2003 Mar 13;348(11):994-1004.
- J Clin Oncol. 2010 Jan 20;28(3):424-30.
- Blood. 2015 Feb 5;125(6):915-23.
- Clin Pharmacol Ther. 2010 Dec;88(6):809-13.
- Leukemia. 2016 May;30(5):1044-54.
- J Clin Oncol. 2016 Jul 10;34(20):2333-40.
最終更新:2023年5月26日
執筆:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。