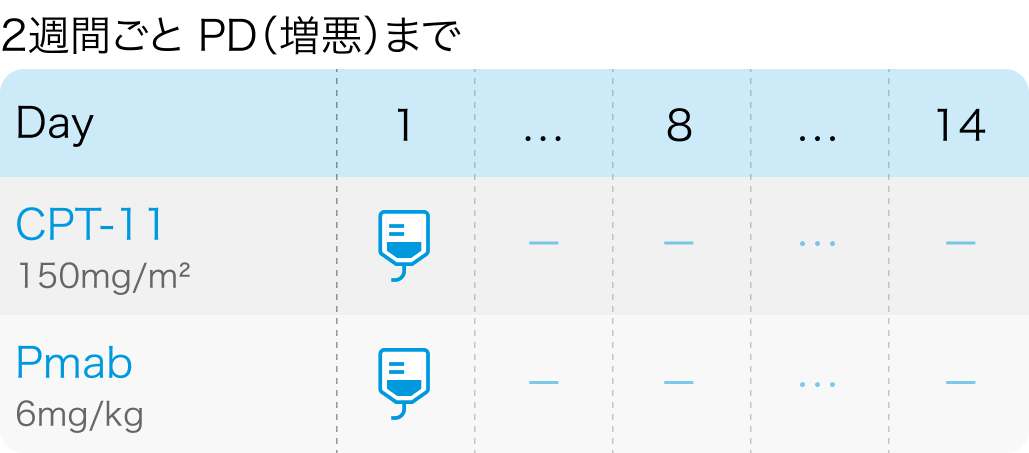
治療スケジュール
概要
監修医師
CPT-11:イリノテカン塩酸塩水和物(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
Pmab:パニツムマブ(ベクティビックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 6mg/kg 点滴 | 1~ | Day1 |
その他
| 1コース14日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
用法用量
前投薬
Pmabは遺伝子組換え型の完全ヒト型IgG2モノクローナル抗体であり、 infusion reaction予防は原則不要である。 IRIの悪心・嘔吐予防のため、 5–HT3受容体阻害薬、 ステロイド剤を投与する。
例)デキサメタゾン注射液3.3mg2A+パロノセトロン点滴静注バッグ0.75m
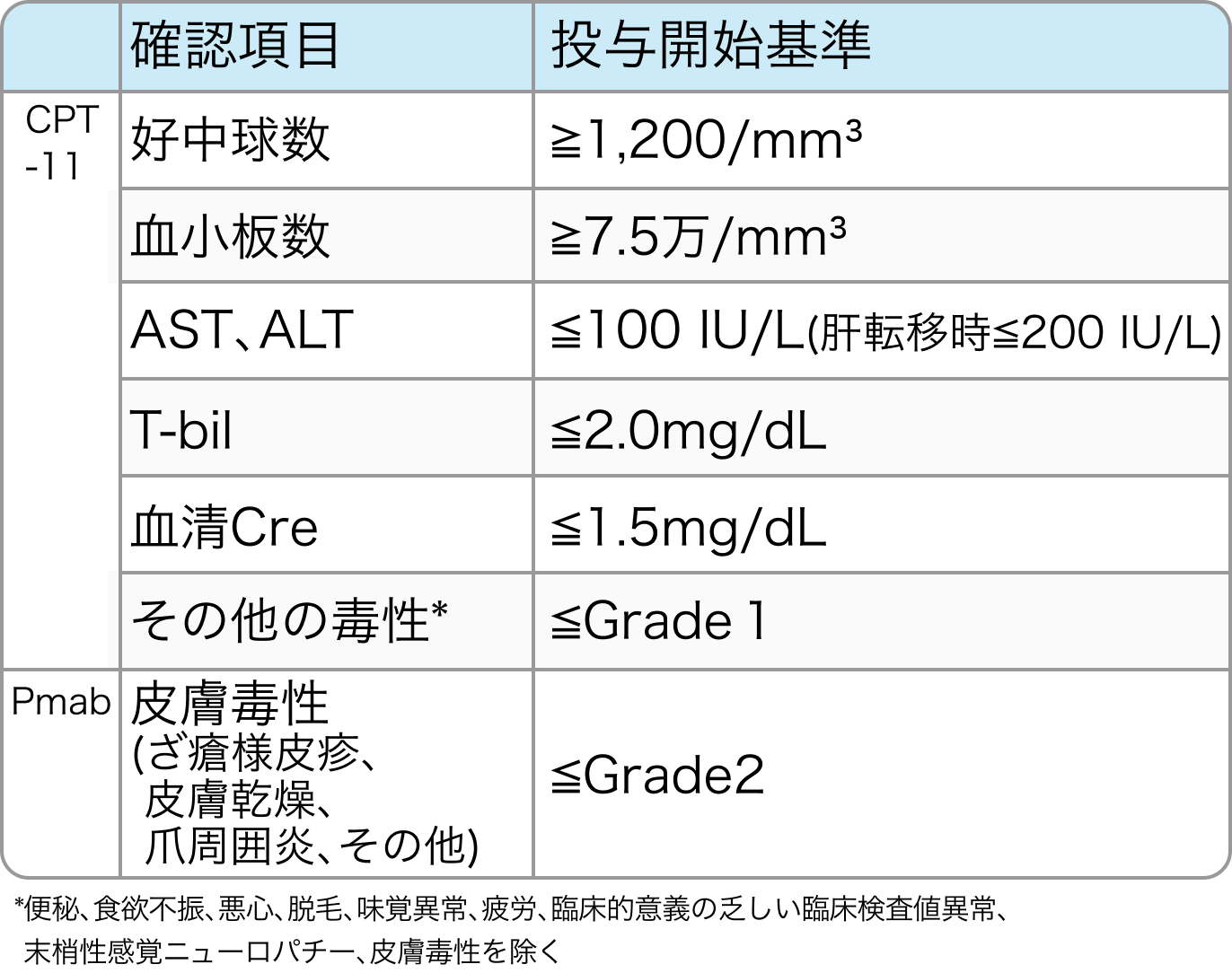
投与開始基準
減量基準
初回基準量と減量レベル
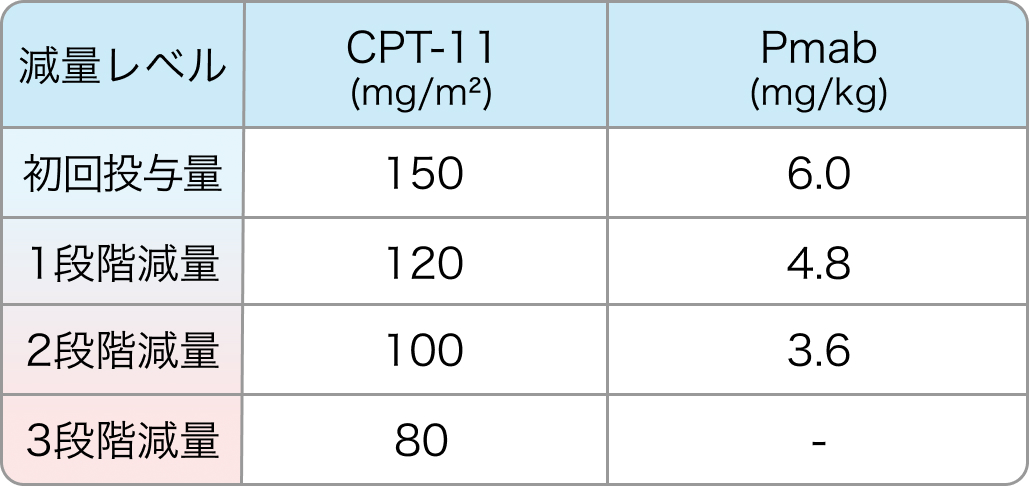
①CPT-11の減量基準
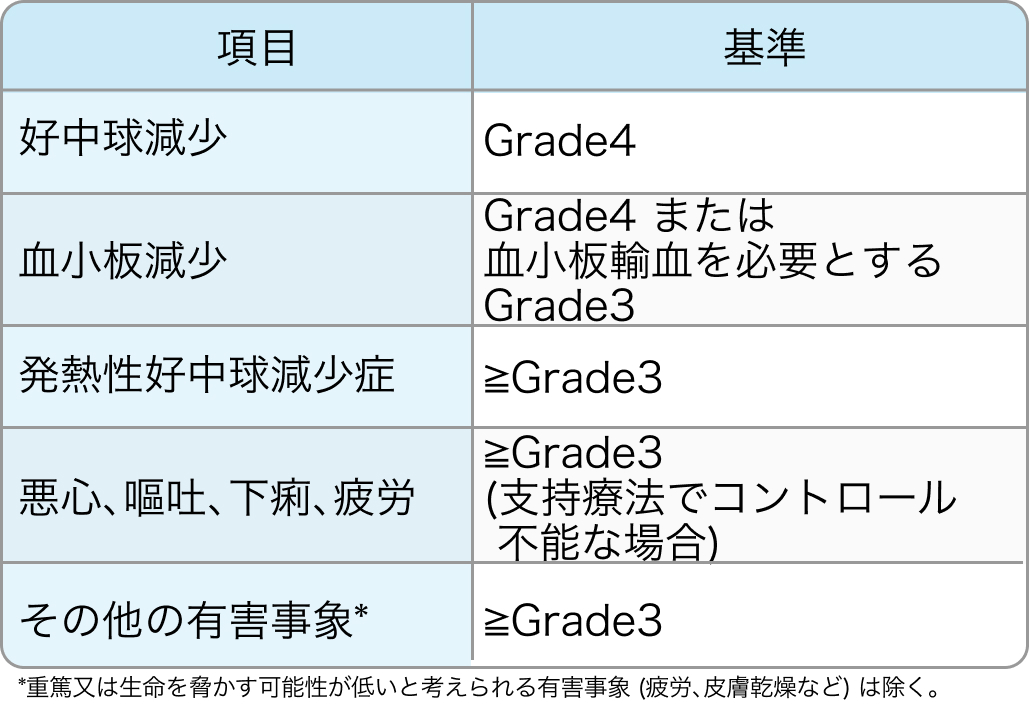
②Pmabの減量基準
Grade3以上の皮膚毒性が生じた場合
主な有害事象
WJOG6510G試験¹⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少 45.0% (3.3%)
- 好中球減少 48.3% (8.3%)
- 貧血 6.7% (1.7%)
- 血小板減少 25.0% (6.7%)
- 発熱性好中球減少症 1.7% (1.7%)
- 食欲不振 50.0% (8.3%)
- 口内炎 50.0% (3.3%)
- 悪心 43.3% (0%)
- 嘔吐 15.0% (0%)
- 疲労 40.0% (3.3%)
- 下痢 53.3% (3.3%)
上手に使うためのワンポイント
- 本レジメンをリチャレンジとして投与する場合は、 効果が得られる症例は限定的であることに留意する。 これまでの臨床試験の結果²⁾³⁾からは、 投与直前のOncoBEAM RAS検査でRAS野生型、 1次治療でPR以上の奏効が得られている、 抗EGFR抗体最終投与からの期間が4ヵ月以上空いている症例がリチャレンジでの有効性が期待出来る症例像と考えられている。
- 一般的には抗EGFR抗体はGrade2以上の皮膚障害が出現した場合は休薬することが推奨されている。 著者は、 本レジメンでは後方治療であるため、 抗EGFR抗体による皮膚障害がGr2まで到達しなくても、 患者さんがQOL低下を訴えている場合は、抗EGFR抗体は無理せず休薬し、 IRI単剤のみ投与、 皮膚障害回復後に再開している。 また、 好中球数減少など明らかなイリノテカンの有害事象でイリノテカンが投与出来ない場合でも抗EGFR抗体は投与する。
特徴と注意点
- パニツムマブとIRI+Pmabを直接比較した臨床試験は実施されていないが、 両レジメンを比較検討したランダム化第II相試験であるWJOG 6510G試験でIRI+CmabとIRI+Pmabの非劣性が示されている¹⁾。
- 試験が実施された時代と異なり、 PARADIGM試験⁴⁾の結果から、 RAS野生型・左側結腸に対しては1次治療で抗EGFR抗体併用療法が使用されていると考えられる。 現在では多くの場合、 右側結腸例の3次治療以降、 左側結腸例ではリチャレンジとして使用する事が想定される。
関連する臨床試験|WJOG6510G試験¹⁾
フルオロウラシル、 イリノテカン、 オキサリプラチンに不応または不耐となったKRAS exon 2野生型で切除不能な進行再発大腸癌患者を対象に、 無増悪生存期間 (PFS)におけるIRI+Pmab (イリノテカン+パニツムマブ) のIRI+Cmab (イリノテカン+セツキシマブ) に対する非劣性を検証した第Ⅱ相無作為化比較試験WJOG 6510Gの結果から、 非劣性が証明された。 また、 PFSおよび全生存期間 (OS) はIRI+Pmabでより良好な傾向にあった。
PFS中央値
- IRI+Pmab群 : 5.42ヵ月
(95%CI 4.14-6.90ヵ月)
- IRI+Cmab群 : 4.27ヵ月
(95%CI 3.48-5.39ヵ月)
HR 0.64 (95%CI 0.44-0.94)、 p<0.001 (非劣性)、 p=0.058 (優越性)
※非劣性マージンは0.30 (HR 1.30)
OS中央値 (IRI+Pmab群、 IRI+Cmab群)
- IRI+Pmab群 : 14.85ヵ月
(95%CI 12.81-17.54ヵ月)
- IRI+Cmab群 : 11.53ヵ月
(95%CI 10.05-14.13ヵ月)
HR 0.66 (95%CI 0.44-1.00)、 p<0.001 (非劣性)、 p=0.050 (優越性)
ORR
- IRI+Pmab群 : 26%
- IRI+Cmab群 : 22%
p=0.67
出典
- Randomised phase II study of panitumumab plus irinotecan versus cetuximab plus irinotecan in patients with KRAS wild-type metastatic colorectal cancer refractory to fluoropyrimidine, irinotecan and oxaliplatin (WJOG 6510G). Eur J Cancer. 2020 Aug;135:11-21. PMID: 32526634
- Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial. JAMA Oncol. 2019 Mar 1;5(3):343-350. PMID: 30476968
- Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282. PMID: 37071094
- Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282. PMID: 37071094
最終更新日:2024年2月19日
執筆医:静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
IRI + Pmab
イリノテカン塩酸塩水和物+パニツムマブ
2024年12月06日更新
CPT-11:イリノテカン塩酸塩水和物(トポテシン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 150mg/m² 点滴 | 1~ | Day1 |
Pmab:パニツムマブ(ベクティビックス®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 6mg/kg 点滴 | 1~ | Day1 |
その他
| 1コース14日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
用法用量

前投薬
Pmabは遺伝子組換え型の完全ヒト型IgG2モノクローナル抗体であり、 infusion reaction予防は原則不要である。 IRIの悪心・嘔吐予防のため、 5–HT3受容体阻害薬、 ステロイド剤を投与する。
例)デキサメタゾン注射液3.3mg2A+パロノセトロン点滴静注バッグ0.75m
投与開始基準

減量基準
初回基準量と減量レベル

①CPT-11の減量基準

②Pmabの減量基準
Grade3以上の皮膚毒性が生じた場合
主な有害事象
WJOG6510G試験¹⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少 45.0% (3.3%)
- 好中球減少 48.3% (8.3%)
- 貧血 6.7% (1.7%)
- 血小板減少 25.0% (6.7%)
- 発熱性好中球減少症 1.7% (1.7%)
- 食欲不振 50.0% (8.3%)
- 口内炎 50.0% (3.3%)
- 悪心 43.3% (0%)
- 嘔吐 15.0% (0%)
- 疲労 40.0% (3.3%)
- 下痢 53.3% (3.3%)
上手に使うためのワンポイント
- 本レジメンをリチャレンジとして投与する場合は、 効果が得られる症例は限定的であることに留意する。 これまでの臨床試験の結果²⁾³⁾からは、 投与直前のOncoBEAM RAS検査でRAS野生型、 1次治療でPR以上の奏効が得られている、 抗EGFR抗体最終投与からの期間が4ヵ月以上空いている症例がリチャレンジでの有効性が期待出来る症例像と考えられている。
- 一般的には抗EGFR抗体はGrade2以上の皮膚障害が出現した場合は休薬することが推奨されている。 著者は、 本レジメンでは後方治療であるため、 抗EGFR抗体による皮膚障害がGr2まで到達しなくても、 患者さんがQOL低下を訴えている場合は、抗EGFR抗体は無理せず休薬し、 IRI単剤のみ投与、 皮膚障害回復後に再開している。 また、 好中球数減少など明らかなイリノテカンの有害事象でイリノテカンが投与出来ない場合でも抗EGFR抗体は投与する。
特徴と注意点
- パニツムマブとIRI+Pmabを直接比較した臨床試験は実施されていないが、 両レジメンを比較検討したランダム化第II相試験であるWJOG 6510G試験でIRI+CmabとIRI+Pmabの非劣性が示されている¹⁾。
- 試験が実施された時代と異なり、 PARADIGM試験⁴⁾の結果から、 RAS野生型・左側結腸に対しては1次治療で抗EGFR抗体併用療法が使用されていると考えられる。 現在では多くの場合、 右側結腸例の3次治療以降、 左側結腸例ではリチャレンジとして使用する事が想定される。
関連する臨床試験|WJOG6510G試験¹⁾
フルオロウラシル、 イリノテカン、 オキサリプラチンに不応または不耐となったKRAS exon 2野生型で切除不能な進行再発大腸癌患者を対象に、 無増悪生存期間 (PFS)におけるIRI+Pmab (イリノテカン+パニツムマブ) のIRI+Cmab (イリノテカン+セツキシマブ) に対する非劣性を検証した第Ⅱ相無作為化比較試験WJOG 6510Gの結果から、 非劣性が証明された。 また、 PFSおよび全生存期間 (OS) はIRI+Pmabでより良好な傾向にあった。
PFS中央値
- IRI+Pmab群 : 5.42ヵ月
(95%CI 4.14-6.90ヵ月)
- IRI+Cmab群 : 4.27ヵ月
(95%CI 3.48-5.39ヵ月)
HR 0.64 (95%CI 0.44-0.94)、 p<0.001 (非劣性)、 p=0.058 (優越性)
※非劣性マージンは0.30 (HR 1.30)
OS中央値 (IRI+Pmab群、 IRI+Cmab群)
- IRI+Pmab群 : 14.85ヵ月
(95%CI 12.81-17.54ヵ月)
- IRI+Cmab群 : 11.53ヵ月
(95%CI 10.05-14.13ヵ月)
HR 0.66 (95%CI 0.44-1.00)、 p<0.001 (非劣性)、 p=0.050 (優越性)
ORR
- IRI+Pmab群 : 26%
- IRI+Cmab群 : 22%
p=0.67
出典
- Randomised phase II study of panitumumab plus irinotecan versus cetuximab plus irinotecan in patients with KRAS wild-type metastatic colorectal cancer refractory to fluoropyrimidine, irinotecan and oxaliplatin (WJOG 6510G). Eur J Cancer. 2020 Aug;135:11-21. PMID: 32526634
- Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial. JAMA Oncol. 2019 Mar 1;5(3):343-350. PMID: 30476968
- Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282. PMID: 37071094
- Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282. PMID: 37071094
最終更新日:2024年2月19日
執筆医:静岡県立静岡がんセンター 消化器内科 川上 武志先生
監修医師:神奈川県立がんセンター消化器内科部長 町田望先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(消化器)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

