ルマケラス®は従来、 がん化学療法後に増悪したKRAS G12C変異陽性の切除不能な進行・再発の非小細胞肺癌に適応を有していたが、 2025年9月19日に 「がん化学療法後に増悪したKRAS G12C変異陽性の治癒切除不能な進行・再発の結腸・直腸癌」 が追加承認された。
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アムジェン株式会社の外部サイトへ遷移します。
*武田薬品工業株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】28日間
【催吐性】 最小度
【FN発症】不明*
*CodeBreaK 300試験³⁾ではFN未報告

ソトラシブ : 960mgを1日1回経口投与
パニツムマブ (Pmab) : 2週毎に6mg/kgを60分以上かけて点滴静注
Key Data|臨床試験結果
📊 CodeBreaK 300試験
N Engl J Med. 2023;389(23):2125-2139.
治療歴のある化学療法抵抗性のKRAS G12C変異を有する転移性大腸癌患者160例を対象とした、 多施設共同・非盲検・第III相無作為化比較試験。 ソトラシブ960mg+Pmab群 (53例)、 ソトラシブ240mg+Pmab群 (53例)、 または標準治療群* (54例) に1:1:1の比率で無作為に割り付け、 主要評価項目はPFSとされた。
*トリフルリジン・チピラシルまたはレゴラフェニブ
【有効性】ソトラシブ+Pmab群 (vs 標準治療)
ソトラシブ960mg⁴⁾ :
- PFS中央値 5.7ヵ月 (vs 2.0ヵ月)
- HR 0.45 (95%CI 0.29–0.72)
- OS中央値 未到達 (vs 10.3ヵ月)
- HR 0.70 (95%CI 0.41–1.18)
- 奏効率 30.2% (vs 1.9%)
- 病勢コントロール率 71.7% (vs 46.3%)
- 奏効期間中央値 10.1ヵ月 (vs 未報告)
ソトラシブ240mg⁴⁾ :
- PFS中央値 4.0ヵ月 (vs 2.0ヵ月)
- HR 0.57 (95%CI 0.37–0.88)
- OS中央値 11.9ヵ月 (vs 10.3ヵ月)
- HR 0.83 (95%CI 0.49–1.39)
- 奏効率 7.5% (vs 1.9%)
- 病勢コントロール率 69.8% (vs 46.3%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
ソトラシブ960mg群 / 240mg群⁴⁾
- 貧血 7.5% (3.8%) / 9.4% (1.9%)
- 血小板減少 1.9% (0%) / 3.8% (0%)
- 白血球減少 0% (0%) / 0% (0%)
- 好中球減少 0% (0%) / 0% (0%)
- 下痢 22.6% (3.8%) / 18.9% (5.7%)
- 悪心 11.3% (1.9%) / 22.6% (3.8%)
- 嘔吐 5.7% (0%) / 13.2% (0%)
- 便秘 3.8% (0%) / 7.5% (0%)
- 口内炎 7.5% (0%) / 9.4% (0%)
- 倦怠感 7.5% (0%) / 7.5% (0%)
- 粘膜炎 13.2% (0%) / 1.9% (0%)
- 無力症 7.5% (0%) / 5.7% (0%)
- 乾皮症 11.3% (0%) / 1.9% (0%)
- 全身倦怠感 0% (0%) / 3.8% (0%)
- 発熱 0% (0%) / 0% (0%)
- 毛包炎 17.0% (0%) / 18.9% (0%)
- 爪囲炎 11.3% (0%) / 9.4% (0%)
- 結膜炎 5.7% (0%) / 3.8% (0%)
- 体重減少 1.9% (0%) / 1.9% (0%)
- 好中球数減少 1.9% (0%) / 3.8% (0%)
- 低Mg血症 30.2% (7.5%) / 30.2% (11.3%)
- 食欲減退 7.5% (0%) / 5.7% (0%)
- 低Ca血症 5.7% (0%) / 3.8% (0%)
- 発疹 28.3% (5.7%) / 24.5% (5.7%)
- ざ瘡様皮膚炎 26.4% (17.0%) / 43.4% (5.7%)
- 皮膚乾燥 18.9% (0%) / 24.5% (0%)
- 掻痒 18.9% (0%) / 13.2% (0%)
- 皮膚亀裂 13.2% (-) / 11.3% (-)
- 皮膚毒性 11.3% (3.8%) / 7.5% (1.9%)
- 手足症候群 11.3% (0%) / 9.4% (0%)
- 紅斑丘疹性発疹 5.7% (0%) / 5.7% (0%)
- 多毛症 1.9% (0%) / 5.7% (0%)
- 脱毛 0% (0%) / 3.8% (0%)
- 高血圧 0% (0%) / 1.9% (0%)
各プロトコル
適格基準
CodeBreaK 300試験³⁾の主な適格基準
- 18歳以上
- 少なくとも1レジメンの前治療歴あり
- フッ化ピリミジン系、 オキサリプラチン、 イリノテカンの前治療歴あり
- ECOG PS 0-2
- 好中球≧1,500/mm³
- ヘモグロビン≧9.0g/dL
- 血小板≧10万/mm³
- 肝機能 : AST/ALT≦2.5×ULN、 D-Bil≦1.0×ULN
- 腎機能 : eGFR (MDRD) ≧30mL/min/1.73 m²
用量レベル
有害事象発現時は以下のとおり減量する。 2段階減量後も忍容できない場合は投与を中止。
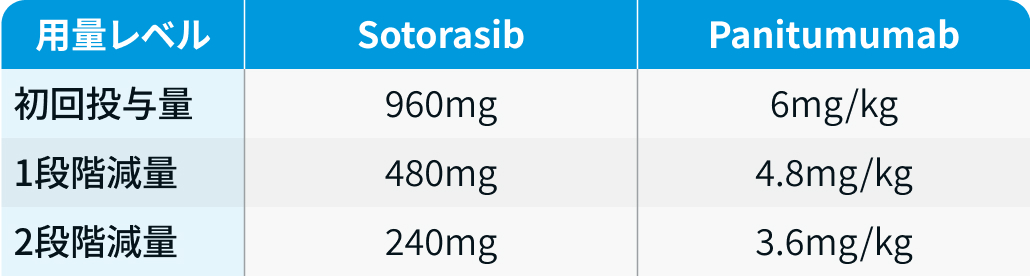
CodeBreaK 300試験³⁾のプロトコルを基に編集部作成
腎障害患者に対する用量調整
ソトラシブ : 尿中未変化体排泄率1.4%であり、 腎障害患者における用量調整は不要と考えられる。
ルマケラス®錠インタビューフォームを基に編集部が評価
パニツムマブ : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
有害事象発現時の減量・休薬・中止基準
CodeBreaK 300試験³⁾では、 ソトラシブを休薬・中止する場合はPmabも同様に休薬・中止した。 一方、 Pmabを休薬する場合、 ソトラシブは臨床的に安全と判断されれば継続可能とされた。
ソトラシブ :

ルマケラス®電子添文情報¹⁾を基に編集部作成
パニツムマブ :
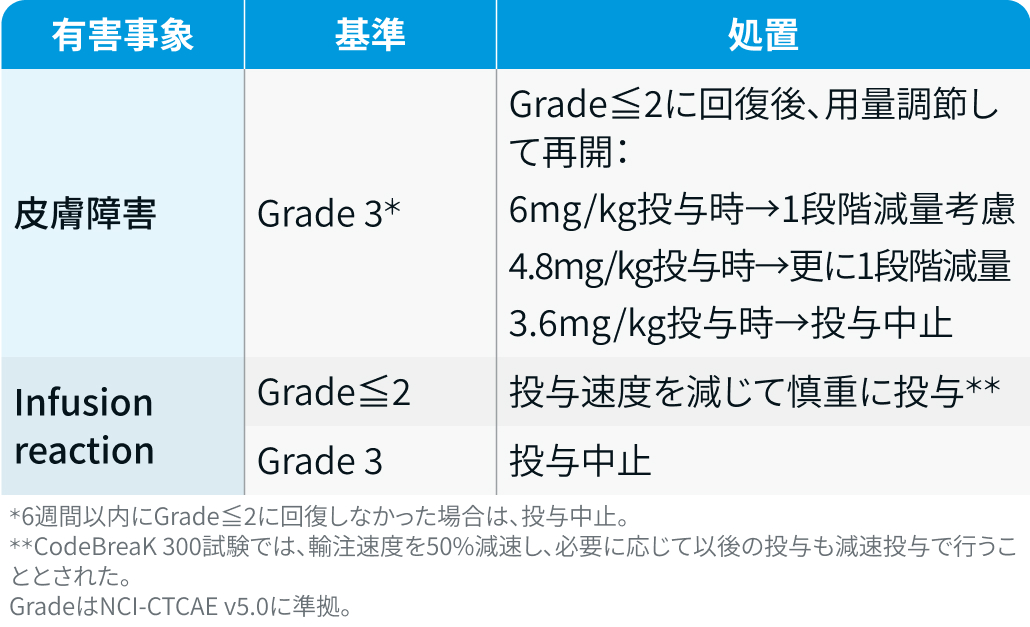
ベクティビックス®電子添文情報¹⁾を基に編集部作成
CodeBreaK 300試験³⁾では、 間質性肺疾患や重度過敏症反応の発現時はPmab中止とされた。
レジメンの特徴と注意点
作用機序の特徴
ソトラシブは大腸癌の約3~4%に認められるKRAS G12C変異を選択的かつ不可逆的に阻害し、 下流シグナル伝達を遮断する。 しかし大腸癌ではEGFR経路の再活性化により耐性が生じやすい。 そこでEGFR抗体パニツムマブを併用することで、 この再活性化を抑制し、 相乗的に抗腫瘍効果を発揮すると考えられている³⁾。
本レジメンの位置付け
本レジメンは、 KRAS G12C変異陽性でフッ化ピリミジン系・オキサリプラチン・イリノテカンの前治療歴を有する患者が適応となる。
レジメン適用時の注意事項
- ソトラシブ
肝障害 : 投与開始前及び投与中は定期的に肝機能検査を行う。
間質性肺疾患 : 発熱・咳嗽・呼吸困難などの初期症状確認と胸部X線検査を含め、 十分に観察する。
- パニツムマブ
Infusion reaction : 重度反応に備え、 緊急対応可能な準備を整えて開始する。 2回目以降に初めて重度反応が起こることもあるため、 投与中は毎回患者の状態に注意する。 投与中および終了後少なくとも1時間は観察期間を設け、 バイタルサインをモニターする。
電解質異常 : 低Mg血症、 低K血症、 低Ca血症が生じることがあるため、 投与前・投与中・投与後に血清Mg、 K、 Caをモニタリングする。
皮膚障害 : 必要に応じて皮膚科を受診するよう指導する。
RMP【重要な特定されたリスク】
ルマケラス®RMP : 医薬品リスク管理計画書
ソトラシブ :
- 肝機能障害
- 間質性肺疾患
出典
- アムジェン株式会社. ルマケラス錠120mg 電子添文 2025年9月改訂 第6版.
- 武田薬品工業株式会社. ベクティビックス点滴静注100mg/ベクティビックス点滴静注400mg 電子添文 2025年9月改訂 第2版.
- N Engl J Med. 2023;389(23):2125-2139.
- J Clin Oncol. 2025;43(19):2147-2154.
最終更新 : 2025年9月22日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
Sotorasib + Pmab
ルマケラス®は従来、 がん化学療法後に増悪したKRAS G12C変異陽性の切除不能な進行・再発の非小細胞肺癌に適応を有していたが、 2025年9月19日に 「がん化学療法後に増悪したKRAS G12C変異陽性の治癒切除不能な進行・再発の結腸・直腸癌」 が追加承認された。
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*アムジェン株式会社の外部サイトへ遷移します。
*武田薬品工業株式会社の外部サイトへ遷移します。
投与スケジュール
【1コース】28日間
【催吐性】 最小度
【FN発症】不明*
*CodeBreaK 300試験³⁾ではFN未報告

ソトラシブ : 960mgを1日1回経口投与
パニツムマブ (Pmab) : 2週毎に6mg/kgを60分以上かけて点滴静注
Key Data|臨床試験結果
📊 CodeBreaK 300試験
N Engl J Med. 2023;389(23):2125-2139.
治療歴のある化学療法抵抗性のKRAS G12C変異を有する転移性大腸癌患者160例を対象とした、 多施設共同・非盲検・第III相無作為化比較試験。 ソトラシブ960mg+Pmab群 (53例)、 ソトラシブ240mg+Pmab群 (53例)、 または標準治療群* (54例) に1:1:1の比率で無作為に割り付け、 主要評価項目はPFSとされた。
*トリフルリジン・チピラシルまたはレゴラフェニブ
【有効性】ソトラシブ+Pmab群 (vs 標準治療)
ソトラシブ960mg⁴⁾ :
- PFS中央値 5.7ヵ月 (vs 2.0ヵ月)
- HR 0.45 (95%CI 0.29–0.72)
- OS中央値 未到達 (vs 10.3ヵ月)
- HR 0.70 (95%CI 0.41–1.18)
- 奏効率 30.2% (vs 1.9%)
- 病勢コントロール率 71.7% (vs 46.3%)
- 奏効期間中央値 10.1ヵ月 (vs 未報告)
ソトラシブ240mg⁴⁾ :
- PFS中央値 4.0ヵ月 (vs 2.0ヵ月)
- HR 0.57 (95%CI 0.37–0.88)
- OS中央値 11.9ヵ月 (vs 10.3ヵ月)
- HR 0.83 (95%CI 0.49–1.39)
- 奏効率 7.5% (vs 1.9%)
- 病勢コントロール率 69.8% (vs 46.3%)
【安全性】主な有害事象 : 全Grade (Grade≧3)
ソトラシブ960mg群 / 240mg群⁴⁾
- 貧血 7.5% (3.8%) / 9.4% (1.9%)
- 血小板減少 1.9% (0%) / 3.8% (0%)
- 白血球減少 0% (0%) / 0% (0%)
- 好中球減少 0% (0%) / 0% (0%)
- 下痢 22.6% (3.8%) / 18.9% (5.7%)
- 悪心 11.3% (1.9%) / 22.6% (3.8%)
- 嘔吐 5.7% (0%) / 13.2% (0%)
- 便秘 3.8% (0%) / 7.5% (0%)
- 口内炎 7.5% (0%) / 9.4% (0%)
- 倦怠感 7.5% (0%) / 7.5% (0%)
- 粘膜炎 13.2% (0%) / 1.9% (0%)
- 無力症 7.5% (0%) / 5.7% (0%)
- 乾皮症 11.3% (0%) / 1.9% (0%)
- 全身倦怠感 0% (0%) / 3.8% (0%)
- 発熱 0% (0%) / 0% (0%)
- 毛包炎 17.0% (0%) / 18.9% (0%)
- 爪囲炎 11.3% (0%) / 9.4% (0%)
- 結膜炎 5.7% (0%) / 3.8% (0%)
- 体重減少 1.9% (0%) / 1.9% (0%)
- 好中球数減少 1.9% (0%) / 3.8% (0%)
- 低Mg血症 30.2% (7.5%) / 30.2% (11.3%)
- 食欲減退 7.5% (0%) / 5.7% (0%)
- 低Ca血症 5.7% (0%) / 3.8% (0%)
- 発疹 28.3% (5.7%) / 24.5% (5.7%)
- ざ瘡様皮膚炎 26.4% (17.0%) / 43.4% (5.7%)
- 皮膚乾燥 18.9% (0%) / 24.5% (0%)
- 掻痒 18.9% (0%) / 13.2% (0%)
- 皮膚亀裂 13.2% (-) / 11.3% (-)
- 皮膚毒性 11.3% (3.8%) / 7.5% (1.9%)
- 手足症候群 11.3% (0%) / 9.4% (0%)
- 紅斑丘疹性発疹 5.7% (0%) / 5.7% (0%)
- 多毛症 1.9% (0%) / 5.7% (0%)
- 脱毛 0% (0%) / 3.8% (0%)
- 高血圧 0% (0%) / 1.9% (0%)
各プロトコル
適格基準
CodeBreaK 300試験³⁾の主な適格基準
- 18歳以上
- 少なくとも1レジメンの前治療歴あり
- フッ化ピリミジン系、 オキサリプラチン、 イリノテカンの前治療歴あり
- ECOG PS 0-2
- 好中球≧1,500/mm³
- ヘモグロビン≧9.0g/dL
- 血小板≧10万/mm³
- 肝機能 : AST/ALT≦2.5×ULN、 D-Bil≦1.0×ULN
- 腎機能 : eGFR (MDRD) ≧30mL/min/1.73 m²
用量レベル
有害事象発現時は以下のとおり減量する。 2段階減量後も忍容できない場合は投与を中止。

CodeBreaK 300試験³⁾のプロトコルを基に編集部作成
腎障害患者に対する用量調整
ソトラシブ : 尿中未変化体排泄率1.4%であり、 腎障害患者における用量調整は不要と考えられる。
ルマケラス®錠インタビューフォームを基に編集部が評価
パニツムマブ : 抗体薬は多様な細胞でのエンドサイトーシスとリソソーム分解により消失するため、 一般に減量は不要と考えられる。
編集部の見解
有害事象発現時の減量・休薬・中止基準
CodeBreaK 300試験³⁾では、 ソトラシブを休薬・中止する場合はPmabも同様に休薬・中止した。 一方、 Pmabを休薬する場合、 ソトラシブは臨床的に安全と判断されれば継続可能とされた。
ソトラシブ :

ルマケラス®電子添文情報¹⁾を基に編集部作成
パニツムマブ :

ベクティビックス®電子添文情報¹⁾を基に編集部作成
CodeBreaK 300試験³⁾では、 間質性肺疾患や重度過敏症反応の発現時はPmab中止とされた。
レジメンの特徴と注意点
作用機序の特徴
ソトラシブは大腸癌の約3~4%に認められるKRAS G12C変異を選択的かつ不可逆的に阻害し、 下流シグナル伝達を遮断する。 しかし大腸癌ではEGFR経路の再活性化により耐性が生じやすい。 そこでEGFR抗体パニツムマブを併用することで、 この再活性化を抑制し、 相乗的に抗腫瘍効果を発揮すると考えられている³⁾。
本レジメンの位置付け
本レジメンは、 KRAS G12C変異陽性でフッ化ピリミジン系・オキサリプラチン・イリノテカンの前治療歴を有する患者が適応となる。
レジメン適用時の注意事項
- ソトラシブ
肝障害 : 投与開始前及び投与中は定期的に肝機能検査を行う。
間質性肺疾患 : 発熱・咳嗽・呼吸困難などの初期症状確認と胸部X線検査を含め、 十分に観察する。
- パニツムマブ
Infusion reaction : 重度反応に備え、 緊急対応可能な準備を整えて開始する。 2回目以降に初めて重度反応が起こることもあるため、 投与中は毎回患者の状態に注意する。 投与中および終了後少なくとも1時間は観察期間を設け、 バイタルサインをモニターする。
電解質異常 : 低Mg血症、 低K血症、 低Ca血症が生じることがあるため、 投与前・投与中・投与後に血清Mg、 K、 Caをモニタリングする。
皮膚障害 : 必要に応じて皮膚科を受診するよう指導する。
RMP【重要な特定されたリスク】
ルマケラス®RMP : 医薬品リスク管理計画書
ソトラシブ :
- 肝機能障害
- 間質性肺疾患
出典
- アムジェン株式会社. ルマケラス錠120mg 電子添文 2025年9月改訂 第6版.
- 武田薬品工業株式会社. ベクティビックス点滴静注100mg/ベクティビックス点滴静注400mg 電子添文 2025年9月改訂 第2版.
- N Engl J Med. 2023;389(23):2125-2139.
- J Clin Oncol. 2025;43(19):2147-2154.
最終更新 : 2025年9月22日
執筆 : HOKUTO編集部 がん専門・指導薬剤師
監修医師 : HOKUTO編集部 医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。