PTX:パクリタキセル(タキソール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg/m² 点滴 | 1~ | Day1,8,15,22,29,36 |
前投薬
| デキサメタゾンリン酸エステルナトリウム注射液 (8mg) +ラニチジン塩酸塩注射液 (50mg) or 注射用ファモチジン (20mg)+ジフェンヒドラミン塩酸塩錠 (50mg) |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソール® (添付文書)
用法用量
電子添文¹⁾の用法および用量
6週間連続投与+2週間の休薬
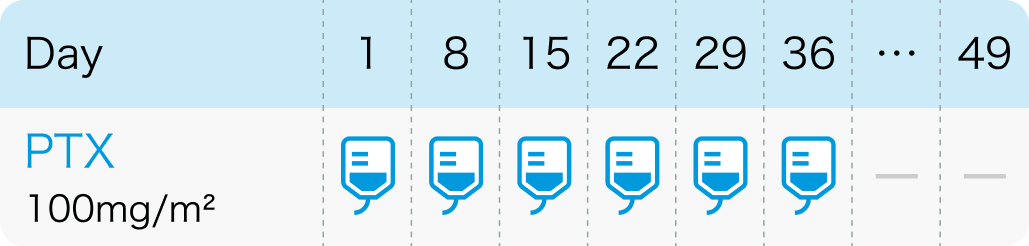
タキソール®電子添文 (2023年7月改訂 第2版) より作図
前投薬
電子添文¹⁾の前投薬
投与約30分前までに以下の投与を終了する
デキサメタゾンリン酸エステルナトリウム注射液 (8mg) +ラニチジン塩酸塩注射液 (50mg) or 注射用ファモチジン (20mg)+ジフェンヒドラミン塩酸塩錠 (50mg)
デキサメタゾンに関しては次回投与時までに過敏症状の発現がない、 もしくは臨床上問題のない場合は2週目の投与より半量に減量可。 以降の投与週も半量ずつ最低1mgまで減量可
タキソール®電子添文 (2023年7月改訂 第2版) より引用
投与開始基準
国内第II相試験²⁾のプロトコル

Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. より作図
減量基準
国内第II相試験²⁾のプロトコル
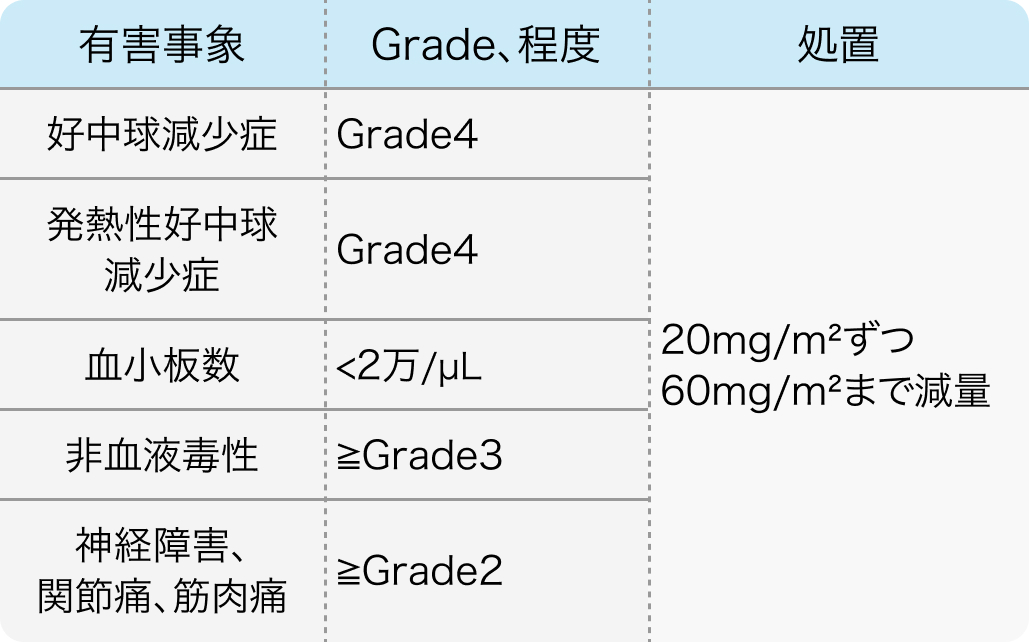
なお、 好中球減少症、 発熱性好中球減少症に関しては、 原文ではgrade>4の記載となっている
Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. より作図
主な有害事象
国内第II相試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 81.1% (45.3%)
- 好中球数減少症 79.2% (52.8%)
- 血小板減少症 11.3% (1.9%)
- 貧血 7.5% (3.8%)
- 発熱性好中球減少症 3.8% (3.8%)
- 倦怠感 71.7% (9.4%)
- 発熱 34.0% (0%)
- 悪心 43.4% (1.9%)
- 便秘 28.3% (7.5%)
- 下痢 28.3% (1.9%)
- 口内炎 24.5% (0%)
- 嘔吐 24.5% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 83.0% (0%)
- 末梢神経障害 81.1% (5.7 %)
Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. より引用
上手に使うためのワンポイント
- 本レジメンはFP+Nivo/Pemが不応・不耐の症例もしくは2次治療でのNivoもしくはPemが不応・不耐となった症例が対象となる。
- フッ化ピリミジンおよびプラチナに不応となった食道扁平上皮癌に対する2次治療としてのパクリタキセルとドセタキセルとを比較したOGSG1201試験³⁾ではパクリタキセル群でOS、 PFS、 ORRともに良好な成績であった。
- OGSG1201試験³⁾は第II相試験であるが、 アルコール不耐や末梢神経障害を有する症例などパクリタキセル不耐例でなければパクリタキセルが優先して検討される。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- パクリタキセルにはアルコールが含まれているためアルコール不耐例には投与を控え投与当日は車の運転を控えさせる。
- アレルギー反応が生じる可能性があるため抗アレルギー薬を投与する。
- パクリタキセルでは脱毛、 末梢神経障害が高頻度で出現するため患者にはあらかじめ伝えておく。 末梢神経障害は蓄積毒性であるため、 末梢神経障害の程度診察の度に確認し増悪すれば投与スケジュールや投与量の変更を検討する。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験
国内第II相試験²⁾
プラチナベースの化学療法を受けたことのある再発または進行食道癌患者53人を対象として、 パクリタキセル週1回投与の有効性と安全性を評価した第Ⅱ相試験。
Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72.
出典
- クリニジェン株式会社. タキソール®電子添文 (2023年7月改訂 第2版) [最終閲覧 : 2024/04/15]
- A phase II study of paclitaxel by weekly 1-h infusion for advanced or recurrent esophageal cancer in patients who had previously received platinum-based chemotherapy. Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. PMID: 20703479
- Randomized phase II study of docetaxel versus paclitaxel in patients with esophageal squamous cell carcinoma refractory to fluoropyrimidine- and platinum-based chemotherapy: OGSG1201. Eur J Cancer. 2021 Sep:154:307-315. PMID: 34311300
最終更新日 : 2024年4月15日
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
PTX
PTX:パクリタキセル(タキソール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg/m² 点滴 | 1~ | Day1,8,15,22,29,36 |
前投薬
| デキサメタゾンリン酸エステルナトリウム注射液 (8mg) +ラニチジン塩酸塩注射液 (50mg) or 注射用ファモチジン (20mg)+ジフェンヒドラミン塩酸塩錠 (50mg) |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
タキソール® (添付文書)
用法用量
電子添文¹⁾の用法および用量
6週間連続投与+2週間の休薬

タキソール®電子添文 (2023年7月改訂 第2版) より作図
前投薬
電子添文¹⁾の前投薬
投与約30分前までに以下の投与を終了する
デキサメタゾンリン酸エステルナトリウム注射液 (8mg) +ラニチジン塩酸塩注射液 (50mg) or 注射用ファモチジン (20mg)+ジフェンヒドラミン塩酸塩錠 (50mg)
デキサメタゾンに関しては次回投与時までに過敏症状の発現がない、 もしくは臨床上問題のない場合は2週目の投与より半量に減量可。 以降の投与週も半量ずつ最低1mgまで減量可
タキソール®電子添文 (2023年7月改訂 第2版) より引用
投与開始基準
国内第II相試験²⁾のプロトコル

Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. より作図
減量基準
国内第II相試験²⁾のプロトコル

なお、 好中球減少症、 発熱性好中球減少症に関しては、 原文ではgrade>4の記載となっている
Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. より作図
主な有害事象
国内第II相試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 白血球減少症 81.1% (45.3%)
- 好中球数減少症 79.2% (52.8%)
- 血小板減少症 11.3% (1.9%)
- 貧血 7.5% (3.8%)
- 発熱性好中球減少症 3.8% (3.8%)
- 倦怠感 71.7% (9.4%)
- 発熱 34.0% (0%)
- 悪心 43.4% (1.9%)
- 便秘 28.3% (7.5%)
- 下痢 28.3% (1.9%)
- 口内炎 24.5% (0%)
- 嘔吐 24.5% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 脱毛症 83.0% (0%)
- 末梢神経障害 81.1% (5.7 %)
Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. より引用
上手に使うためのワンポイント
- 本レジメンはFP+Nivo/Pemが不応・不耐の症例もしくは2次治療でのNivoもしくはPemが不応・不耐となった症例が対象となる。
- フッ化ピリミジンおよびプラチナに不応となった食道扁平上皮癌に対する2次治療としてのパクリタキセルとドセタキセルとを比較したOGSG1201試験³⁾ではパクリタキセル群でOS、 PFS、 ORRともに良好な成績であった。
- OGSG1201試験³⁾は第II相試験であるが、 アルコール不耐や末梢神経障害を有する症例などパクリタキセル不耐例でなければパクリタキセルが優先して検討される。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
特徴と注意点
- パクリタキセルにはアルコールが含まれているためアルコール不耐例には投与を控え投与当日は車の運転を控えさせる。
- アレルギー反応が生じる可能性があるため抗アレルギー薬を投与する。
- パクリタキセルでは脱毛、 末梢神経障害が高頻度で出現するため患者にはあらかじめ伝えておく。 末梢神経障害は蓄積毒性であるため、 末梢神経障害の程度診察の度に確認し増悪すれば投与スケジュールや投与量の変更を検討する。
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
関連する臨床試験
国内第II相試験²⁾
プラチナベースの化学療法を受けたことのある再発または進行食道癌患者53人を対象として、 パクリタキセル週1回投与の有効性と安全性を評価した第Ⅱ相試験。
Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72.
出典
- クリニジェン株式会社. タキソール®電子添文 (2023年7月改訂 第2版) [最終閲覧 : 2024/04/15]
- A phase II study of paclitaxel by weekly 1-h infusion for advanced or recurrent esophageal cancer in patients who had previously received platinum-based chemotherapy. Cancer Chemother Pharmacol. 2011 Jun;67(6):1265-72. PMID: 20703479
- Randomized phase II study of docetaxel versus paclitaxel in patients with esophageal squamous cell carcinoma refractory to fluoropyrimidine- and platinum-based chemotherapy: OGSG1201. Eur J Cancer. 2021 Sep:154:307-315. PMID: 34311300
最終更新日 : 2024年4月15日
執筆医 : 神奈川県立がんセンター消化器内科 古田 光寛先生
監修医師 : 神奈川県立がんセンター消化器内科部長 町田望先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
