本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗CTLA-4抗体 + 抗PD-1抗体の併用療法
*小野薬品工業株式会社の外部サイトへ遷移します
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
【催吐性】 最小度催吐性リスク
【FN発症】低リスク (<20%)
❶併用投与後、 Nivo単独2週間毎の場合

❷併用投与後、 Nivo単独4週間毎の場合

IPI 3mg/kg、 Nivo 80mg/bodyを3週毎に4回投与した後、 ❶Nivoのみ240mg/bodyを2週間毎または❷480mg/bodyを4週間毎に点滴静注
オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド (2024年8月作成)²⁾より引用
※併用時の投与方法
Nivo 80mgを30分以上かけ投与完了後、30分以上の間隔をおき、 IPI 3mg/kgを30分かけ投与
オプジーボの投与にあたっては、 インラインフィルター (0.2又は0.22μm) を使用すること
オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド (2024年8月作成)²⁾より引用
投与開始基準
CheckMate 067試験⁴⁾プロトコル
化学療法未治療の根治切除不能なⅢ期/Ⅳ期悪性黒色腫患者
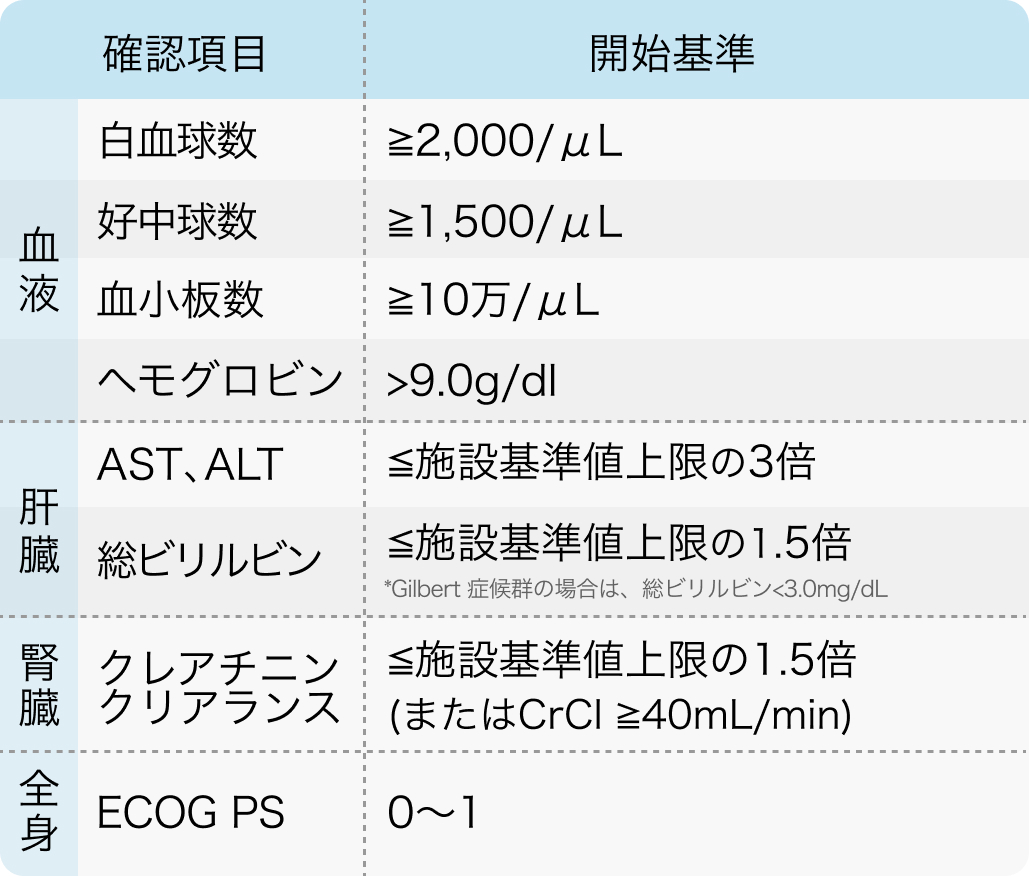
N Engl J Med. 2015 Jul 2;373(1):23-34⁴⁾より作図
休薬・中止基準
CheckMate 067試験⁴⁾⁵⁾のプロトコル
実際の副作用マネジメント
オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド¹⁾』を参照
主な有害事象
CheckMate 067試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 皮膚障害 66.1% (6.7%)
皮疹、尋常性白斑、そう痒症など
- 下痢 45.7% (9.6%)
- 疲労 38.3% (4.2%)
- 悪心 28.1% (2.2%)
- ALT増加 19.5% (8.6%)
- 食欲減退 19.2% (1.3%)
- 発熱 19.2% (0.6%)
- AST増加 16.9% (6.1%)
- 嘔吐 15.3% (2.2%)
- 体重減少 6.1% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 甲状腺機能低下症 17.6% (0.3%)
- 甲状腺機能亢進性 11.5% (1.0%)
- 大腸炎 12.8% (8.3%)
- 下垂体炎 7.3% (1.6%)
- 肺臓炎 7.0% (1.0%)
N Engl J Med. 2017 Oct 5;377(14):1345-1356⁴⁾より引用
エキスパートによるワンポイント
悪性黒色腫患における適応について
化学療法未治療及び既治療の根治切除不能なⅢ/Ⅳ期又は再発の悪性黒色腫患者に用いられる。
併用薬それぞれの作用機序に基づき、 過度の免疫反応による副作用が現れることがある。 それらの中には対応によっては重篤または死亡に至るものがあるため、 投与に際しては観察を十分に行い異常が認められた場合には発現した事象に応じた専門医と連携して適切な鑑別診断を行い、 副腎皮質ホルモン剤の投与等の適切な処置を行うことが必要である。
投与スケジュール
📅 IPI+Nivo併用療法期間
通常、 成人にはニボルマブとして、 1回80㎎とイピリムマブ3mg/kgを3週間間隔で4回点滴静注する。 このとき、 ニボルマブを30分以上かけて投与し、 投与完了後30分以上の間隔をおいてイピリムマブを30分かけて点滴静注する。
📅 Nivo単独療法期間
通常、 成人にはニボルマブとして、 1回240㎎を2週間間隔または1回480㎎を4週間間隔で30分以上かけて点滴静注する。 減量基準はなく、 ホルモン補充療法でコントロール可能な内分泌関連の免疫関連有害事象を除き、 Grade3以上またはGradeに関わらず致死的になり得る場合には中止する。
臨床試験の結果
📊 国際共同第III相試験 (CheckMate067)⁴⁻⁶⁾
対象は化学療法未治療の根治切除不能なⅢ/Ⅳ期の悪性黒色腫患者945例 (IPI + Nivo群 314例、 Nivo単独群 316例、 Ipi単独群 315例) で、 主要評価項目は全生存期間 (OS) と無増悪生存期間 (PFS) の2つ、 副次的評価項目は奏効率 (ORR)、 患者QOLなどであった。 CheckMate 067試験は悪性黒色腫を対象とした臨床試験の中で最も長期に経過観察がおこなわれている。
結果、 IPI + Nivo群/Nivo単独群はIpi単独群と比較してPFSとOSを有意に延長した。
▼OS中央値 [6.5年追跡調査]
● IPI + Nivo群 :72.1ヵ月 (95%CI 38.2ヵ月-NR)
● Nivo単独群 : 36.9ヵ月 (28.2-58.7ヵ月)
● Ipi単独群 : 19.9ヵ月 (16.8-24.6ヵ月)
J Clin Oncol. 2022 Jan 10;40(2):127-137⁶⁾よりデータ引用
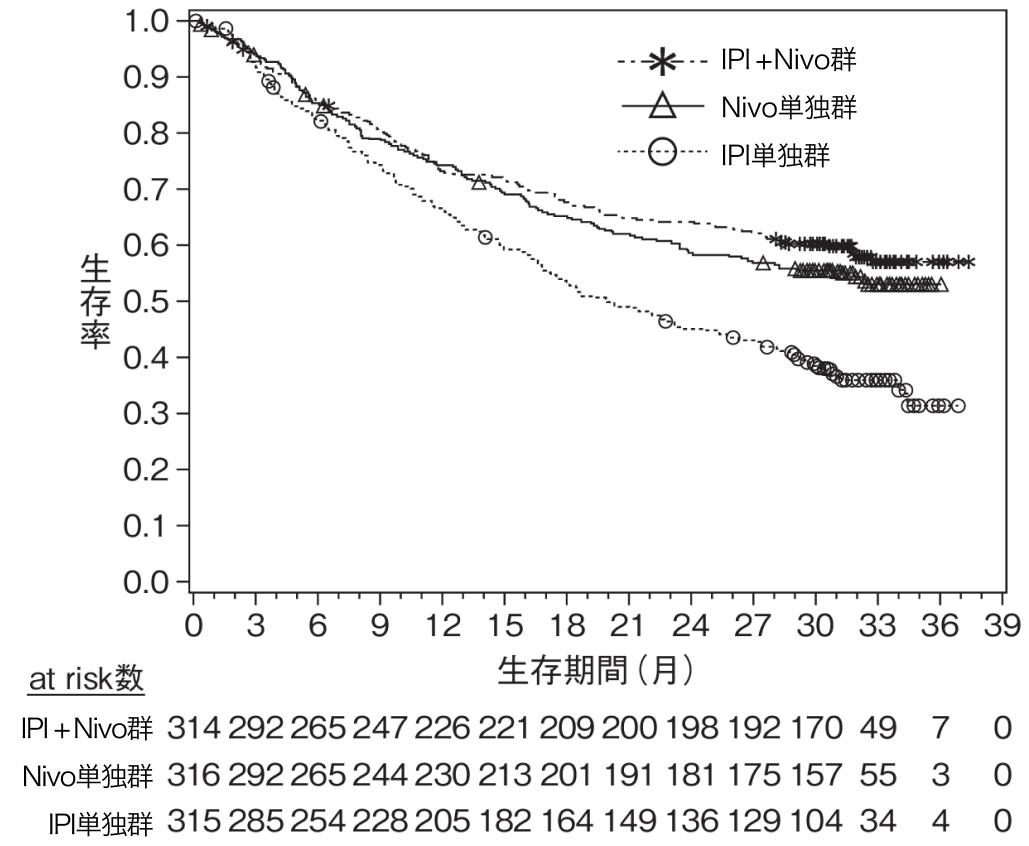
オプジーボ®電子添文 (2024年8月改訂 第20版)をもとに作図
▼PFS [6.5年追跡調査]
● IPI + Nivo群 : 34% (中央値11.5ヵ月)
● Nivo単独群 : 29% (6.9ヵ月)
● Ipi単独群 : 7% (2.9ヵ月)
J Clin Oncol. 2022 Jan 10;40(2):127-137⁶⁾よりデータ引用
▼ORR [6.5年追跡調査]
● IPI + Nivo群 : 58% (95%CI 53-64%)
● Nivo単独群 : 45% (39-51%)
● Ipi単独群 : 19% (15-24%)
J Clin Oncol. 2022 Jan 10;40(2):127-137⁶⁾よりデータ引用
📊 国内第II相試験⁷⁾
対象は化学療法未治療の根治切除不能なⅢ期/Ⅳ期の日本人悪性黒色腫患者30例であった。
結果、主要評価項目であるORRは以下のとおりであった。
● ORR 43.3% (95%CI 25.5-62.6%)
- CR 6.7% (0.8-22.1%)
- PR 36.7% (19.9-56.1%)
副作用とその対策
PD-1阻害薬とCTLA-4阻害薬の併用は、 各単剤投与と比較して内分泌障害、 肺臓炎、 皮疹、 下痢等のirAEリスクがより高まるため毒性管理に注意を要する。 CheckMate 067試験において、 各群でのGrade 3、4の有害事象の発現率は以下のとおりであった⁴⁾
● IPI + Nivo群 : 59%
● Nivo単独群 : 21%
● Ipi単独群 : 28%
また、 Grade3以上の有害事象が起こるまでの期間の中央値は以下のとおりで、 Nivo単剤に比べてIPI + Nivo群で期間短縮がみられた⁴⁾。
● IPI + Nivo群 : 6.3週
● Nivo単独群 : 46.1週
● Ipi単独群 : 4.7週
国内試験ではGrade3、 4の有害事象の起こる率は77%とCheckMate 067試験⁴⁻⁶⁾よりも高率で肝機能低下が最も注意すべき副作用であった。
実際の副作用マネジメントについては、 オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド¹⁾』を参照すること。
監修 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2023年10月改訂第12版) [最終閲覧 : 2024/6/17]
- 小野薬品工業株式会社. オプジーボ®/ヤーボイ®適正使用ガイド (2024年8月作成) [最終閲覧 : 2024/12/18]
- 小野薬品工業株式会社. ヤーボイ®電子添文 (2024年8月改訂第20版) [最終閲覧 : 2024/12/18]
- Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med. 2017 Oct 5;377(14):1345-1356. PMID: 28889792
- Efficacy and safety of nivolumab in combination with ipilimumab in Japanese patients with advanced melanoma: An open-label, single-arm, multicentre phase II study. Eur J Cancer. 2018 Dec:105:114-126. PMID: 30447539
- Long-Term Outcomes With Nivolumab Plus Ipilimumab or Nivolumab Alone Versus Ipilimumab in Patients With Advanced Melanoma. Clin Oncol. 2022 Jan 10;40(2):127-137. PMID: 34818112
- Efficacy and safety of nivolumab in combination with ipilimumab in Japanese patients with advanced melanoma: An open-label, single-arm, multicentre phase II study. Eur J Cancer. 2018 Dec:105:114-126. PMID: 30447539
最終更新日 : 2024年12月18日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
IPI + Nivo
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
抗CTLA-4抗体 + 抗PD-1抗体の併用療法
*小野薬品工業株式会社の外部サイトへ遷移します
*小野薬品工業株式会社の外部サイトへ遷移します
用法用量
【催吐性】 最小度催吐性リスク
【FN発症】低リスク (<20%)
❶併用投与後、 Nivo単独2週間毎の場合

❷併用投与後、 Nivo単独4週間毎の場合

IPI 3mg/kg、 Nivo 80mg/bodyを3週毎に4回投与した後、 ❶Nivoのみ240mg/bodyを2週間毎または❷480mg/bodyを4週間毎に点滴静注
オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド (2024年8月作成)²⁾より引用
※併用時の投与方法
Nivo 80mgを30分以上かけ投与完了後、30分以上の間隔をおき、 IPI 3mg/kgを30分かけ投与
オプジーボの投与にあたっては、 インラインフィルター (0.2又は0.22μm) を使用すること
オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド (2024年8月作成)²⁾より引用
投与開始基準
CheckMate 067試験⁴⁾プロトコル
化学療法未治療の根治切除不能なⅢ期/Ⅳ期悪性黒色腫患者

N Engl J Med. 2015 Jul 2;373(1):23-34⁴⁾より作図
休薬・中止基準
CheckMate 067試験⁴⁾⁵⁾のプロトコル
実際の副作用マネジメント
オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド¹⁾』を参照
主な有害事象
CheckMate 067試験²⁾
主な有害事象 (カッコ内はGrade3~4)
- 皮膚障害 66.1% (6.7%)
皮疹、尋常性白斑、そう痒症など
- 下痢 45.7% (9.6%)
- 疲労 38.3% (4.2%)
- 悪心 28.1% (2.2%)
- ALT増加 19.5% (8.6%)
- 食欲減退 19.2% (1.3%)
- 発熱 19.2% (0.6%)
- AST増加 16.9% (6.1%)
- 嘔吐 15.3% (2.2%)
- 体重減少 6.1% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 甲状腺機能低下症 17.6% (0.3%)
- 甲状腺機能亢進性 11.5% (1.0%)
- 大腸炎 12.8% (8.3%)
- 下垂体炎 7.3% (1.6%)
- 肺臓炎 7.0% (1.0%)
N Engl J Med. 2017 Oct 5;377(14):1345-1356⁴⁾より引用
エキスパートによるワンポイント
悪性黒色腫患における適応について
化学療法未治療及び既治療の根治切除不能なⅢ/Ⅳ期又は再発の悪性黒色腫患者に用いられる。
併用薬それぞれの作用機序に基づき、 過度の免疫反応による副作用が現れることがある。 それらの中には対応によっては重篤または死亡に至るものがあるため、 投与に際しては観察を十分に行い異常が認められた場合には発現した事象に応じた専門医と連携して適切な鑑別診断を行い、 副腎皮質ホルモン剤の投与等の適切な処置を行うことが必要である。
投与スケジュール
📅 IPI+Nivo併用療法期間
通常、 成人にはニボルマブとして、 1回80㎎とイピリムマブ3mg/kgを3週間間隔で4回点滴静注する。 このとき、 ニボルマブを30分以上かけて投与し、 投与完了後30分以上の間隔をおいてイピリムマブを30分かけて点滴静注する。
📅 Nivo単独療法期間
通常、 成人にはニボルマブとして、 1回240㎎を2週間間隔または1回480㎎を4週間間隔で30分以上かけて点滴静注する。 減量基準はなく、 ホルモン補充療法でコントロール可能な内分泌関連の免疫関連有害事象を除き、 Grade3以上またはGradeに関わらず致死的になり得る場合には中止する。
臨床試験の結果
📊 国際共同第III相試験 (CheckMate067)⁴⁻⁶⁾
対象は化学療法未治療の根治切除不能なⅢ/Ⅳ期の悪性黒色腫患者945例 (IPI + Nivo群 314例、 Nivo単独群 316例、 Ipi単独群 315例) で、 主要評価項目は全生存期間 (OS) と無増悪生存期間 (PFS) の2つ、 副次的評価項目は奏効率 (ORR)、 患者QOLなどであった。 CheckMate 067試験は悪性黒色腫を対象とした臨床試験の中で最も長期に経過観察がおこなわれている。
結果、 IPI + Nivo群/Nivo単独群はIpi単独群と比較してPFSとOSを有意に延長した。
▼OS中央値 [6.5年追跡調査]
● IPI + Nivo群 :72.1ヵ月 (95%CI 38.2ヵ月-NR)
● Nivo単独群 : 36.9ヵ月 (28.2-58.7ヵ月)
● Ipi単独群 : 19.9ヵ月 (16.8-24.6ヵ月)
J Clin Oncol. 2022 Jan 10;40(2):127-137⁶⁾よりデータ引用

オプジーボ®電子添文 (2024年8月改訂 第20版)をもとに作図
▼PFS [6.5年追跡調査]
● IPI + Nivo群 : 34% (中央値11.5ヵ月)
● Nivo単独群 : 29% (6.9ヵ月)
● Ipi単独群 : 7% (2.9ヵ月)
J Clin Oncol. 2022 Jan 10;40(2):127-137⁶⁾よりデータ引用
▼ORR [6.5年追跡調査]
● IPI + Nivo群 : 58% (95%CI 53-64%)
● Nivo単独群 : 45% (39-51%)
● Ipi単独群 : 19% (15-24%)
J Clin Oncol. 2022 Jan 10;40(2):127-137⁶⁾よりデータ引用
📊 国内第II相試験⁷⁾
対象は化学療法未治療の根治切除不能なⅢ期/Ⅳ期の日本人悪性黒色腫患者30例であった。
結果、主要評価項目であるORRは以下のとおりであった。
● ORR 43.3% (95%CI 25.5-62.6%)
- CR 6.7% (0.8-22.1%)
- PR 36.7% (19.9-56.1%)
副作用とその対策
PD-1阻害薬とCTLA-4阻害薬の併用は、 各単剤投与と比較して内分泌障害、 肺臓炎、 皮疹、 下痢等のirAEリスクがより高まるため毒性管理に注意を要する。 CheckMate 067試験において、 各群でのGrade 3、4の有害事象の発現率は以下のとおりであった⁴⁾
● IPI + Nivo群 : 59%
● Nivo単独群 : 21%
● Ipi単独群 : 28%
また、 Grade3以上の有害事象が起こるまでの期間の中央値は以下のとおりで、 Nivo単剤に比べてIPI + Nivo群で期間短縮がみられた⁴⁾。
● IPI + Nivo群 : 6.3週
● Nivo単独群 : 46.1週
● Ipi単独群 : 4.7週
国内試験ではGrade3、 4の有害事象の起こる率は77%とCheckMate 067試験⁴⁻⁶⁾よりも高率で肝機能低下が最も注意すべき副作用であった。
実際の副作用マネジメントについては、 オプジーボ (ヤーボイ又は他の抗悪性腫瘍剤併用療法)・ヤーボイ適正使用ガイド¹⁾』を参照すること。
監修 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
出典
- 小野薬品工業株式会社. オプジーボ®電子添文 (2023年10月改訂第12版) [最終閲覧 : 2024/6/17]
- 小野薬品工業株式会社. オプジーボ®/ヤーボイ®適正使用ガイド (2024年8月作成) [最終閲覧 : 2024/12/18]
- 小野薬品工業株式会社. ヤーボイ®電子添文 (2024年8月改訂第20版) [最終閲覧 : 2024/12/18]
- Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med. 2017 Oct 5;377(14):1345-1356. PMID: 28889792
- Efficacy and safety of nivolumab in combination with ipilimumab in Japanese patients with advanced melanoma: An open-label, single-arm, multicentre phase II study. Eur J Cancer. 2018 Dec:105:114-126. PMID: 30447539
- Long-Term Outcomes With Nivolumab Plus Ipilimumab or Nivolumab Alone Versus Ipilimumab in Patients With Advanced Melanoma. Clin Oncol. 2022 Jan 10;40(2):127-137. PMID: 34818112
- Efficacy and safety of nivolumab in combination with ipilimumab in Japanese patients with advanced melanoma: An open-label, single-arm, multicentre phase II study. Eur J Cancer. 2018 Dec:105:114-126. PMID: 30447539
最終更新日 : 2024年12月18日
監修医師 : 国立がん研究センター中央病院皮膚腫瘍科長 山崎直也先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。