GEM:Gemcitabine(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,000mg/m² 点滴 | 1~ (3週間間隔の投与時のみ) | Day1,8 |
CDDP:Cisplatin(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 25mg/m² 点滴 | 1~ (3週間間隔の投与時のみ) | Day1,8 |
デュルバルマブ:Durvalumab(イミフィンジ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,500mg/回 点滴 | 1~ | Day1 |
その他
| GEM+CDDPをGC療法と呼ぶ。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
*日本化薬の外部サイトへ遷移します
*アストラゼネカ株式会社の外部サイトへ遷移します
用法用量
TOPAZ-1試験⁷⁾のプロトコル
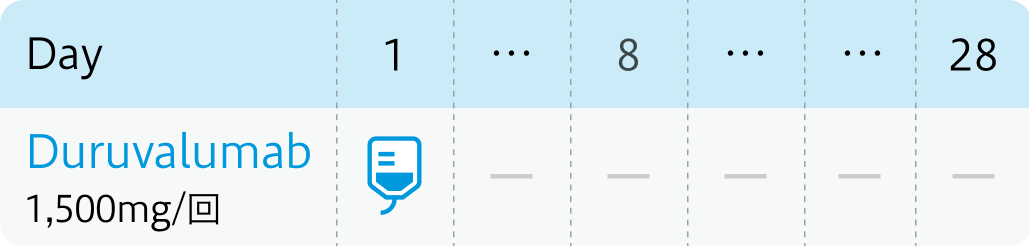
① 3週間を1コースとして、 デュルバルマブ1500mgを第1日目に、 シスプラチン (25mg/m²) とゲムシタビン (1000mg/m²) を第1、 8日目に最大8コース投与後、 ② デュルバルマブ1500mgを4週間間隔で投与。
①1コース3週間 (最大8コース投与)

体重30kg以下 : デュルバルマブの1回投与量は20mg/kg
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より作図
②デュルバルマブ単剤を4週間ごとに投与
体重30kg以下 : デュルバルマブの1回投与量は20mg/kg
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より作図
投与開始基準
TOPAZ-1試験⁷⁾のプロトコル
18歳以上で初期診断時に切除不能又は転移性となった胆道癌患者で、以下などを満たす場合
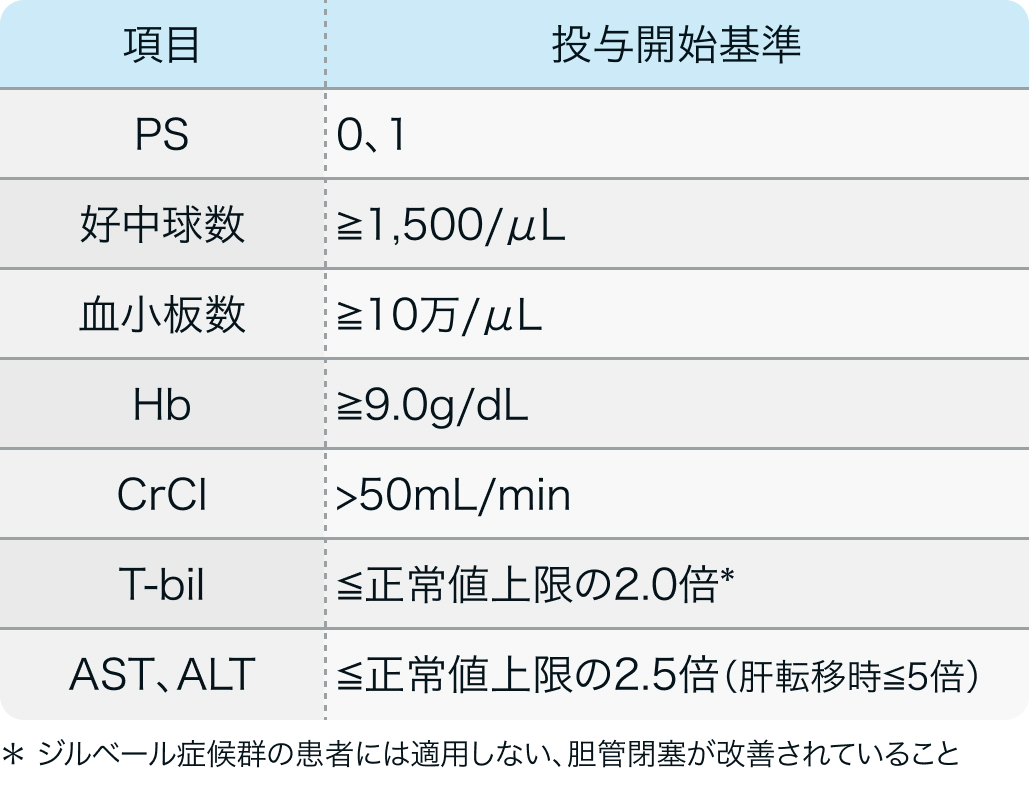
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より作図
休薬・中止基準
デュルバルマブ電子添文⁵⁾の基準
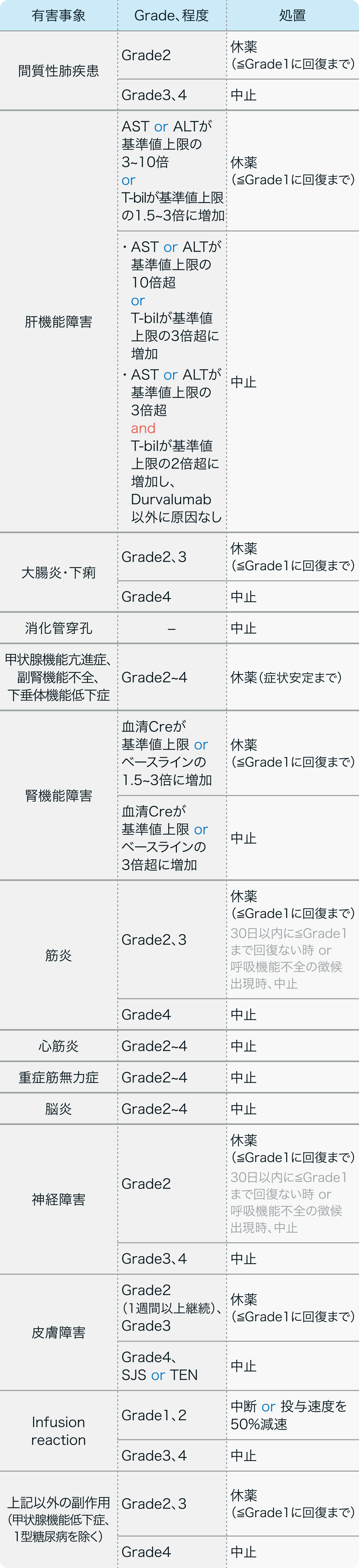
イミフィンジ®電子添文 (2023年11月改訂 第6版)⁵⁾より作図
主な有害事象
TOPAZ-1試験⁷⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 48.2% (23.7%)
- 好中球減少症 31.7% (20.1%)
- 好中球数減少 26.9% (21.0%)
- 血小板数減少 20.7% (9.8%)
- 血小板減少症 12.7% (4.7%)
- 白血球数減少 10.9% (4.4%)
- 白血球減少症 5.9% (2.4 %)
- 悪心 40.2% (1.5%)
- 便秘 32.0% (0.6%)
- 倦怠感 26.9% (3.3%)
- 食欲減退 25.7% (2.1%)
- 発熱 20.1% (1.5%)
- 嘔吐 18.3% (1.5%)
- 下痢 16.9% (1.2%)
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より引用
特徴と注意点
TOPAZ-1試験⁷⁾の概要
胆道癌における免疫チェックポイント阻害薬の有効性を示した初めての試験である。
主要評価項目である全生存期間、 副次評価項目である無増悪生存期間、 奏効割合等、 全ての評価項目においてGC療法に対する優越性が証明された。
治療開始後8サイクルまでGC+デュルバルマブ療法を行い、 以降はデュルバルマブのみを4週毎に投与することとしていた。 実際の臨床の現場でも同様にデュルバルマブ単独投与とするか、 ゲムシタビン+デュルバルマブで継続するか、 今後、 一般臨床における使用の増加により有効性や有害事象も含めデータの蓄積が期待される。
PD-L1の発現強度における有効性の差はなく、 高発現・低発現に関わらず有効であった。
TOPAZ-1試験⁷⁾の有害事象等
有害事象はGC療法と同等であり、 免疫チェックポイント阻害薬による増加はなかった。
執筆 : 北海道大学病院 腫瘍センター 助教 川本 泰之先生
関連する臨床試験|TOPAZ-1試験⁷⁾
切除不能な局所進行・転移性の胆道腺癌 (肝内・肝外胆管癌、 胆嚢癌を含む) 患者において、 抗PD-L1抗体デュルバルマブと化学療法 (ゲムシタビン+シスプラチン;GC療法) の併用療法の効果を、 プラセボと化学療法の併用療法を対照に検証した第Ⅲ相二重盲検ランダム化比較試験TOPAZ-1の結果より、 全生存期間 (OS) の有意な改善が示された。
OS中央値
- デュルバルマブ群 : 12.8ヵ月
(95%CI 11.1-14.0ヵ月)
- プラセボ群 : 11.5ヵ月
(95%CI 10.1-12.5ヵ月)
HR 0.80 (95%CI 0.66-0.97)、 p=0.021
OS率 (12ヵ月時、 18ヵ月時、 24ヵ月時)
- デュルバルマブ群 : 54.1%、 35.1%、 24.9%
- プラセボ群 : 48.0%、 25.6%、 10.4%
OSのサブグループ解析
- PD-L1腫瘍面積陽性 (TAP) スコアが1%以上の患者において、 デュルバルマブ群とプラセボ群のOSのHRは0.79 (95%CI 0.61-1.00) であった。
- 同様に、 TAPスコアが1%未満の患者では、 HRは0.86 (95%CI 0.60-1.23) であった。
PFS中央値
- デュルバルマブ群 : 7.2ヵ月
(95%CI 6.7-7.4ヵ月)
- プラセボ群 : 5.7ヵ月
(95%CI 5.6-6.7ヵ月)
HR 0.75 (95%CI 0.63-0.89)、 p=0.001
ORR
- デュルバルマブ群 : 26.7%
- プラセボ群 : 18.7%
オッズ比 1.60 (95%CI 1.11-2.31)
病勢コントロール率
- デュルバルマブ群 : 85.3%
- プラセボ群 : 82.6%
出典
- 日本イーライリリー. ジェムザール®電子添文 (2021年8月改訂 第1版) [最終閲覧 : 2024/03/26]
- 日本イーライリリー. ジェムザール®適正使用ガイド (2021年10月作成) [最終閲覧 : 2024/03/26]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/03/27]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/03/27]
- アストラゼネカ株式会社. イミフィンジ®電子添文 (2023年11月改訂 第6版) [最終閲覧 : 2024/03/26]
- アストラゼネカ株式会社. イミフィンジ®適正使用ガイド (2023年11月作成) [最終閲覧 : 2024/03/26]
- Durvalumab plus Gemcitabine and Cisplatin in Advanced Biliary Tract Cancer. NEJM Evid. 2022 Aug;1(8):EVIDoa2200015. PMID: 38319896
最終更新日 : 2024年5月21日
執筆医 : 北海道大学病院 腫瘍センター 助教 川本 泰之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
GCD (GEM+CDDP+Durvalumab)
GEM:Gemcitabine(ジェムザール®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,000mg/m² 点滴 | 1~ (3週間間隔の投与時のみ) | Day1,8 |
CDDP:Cisplatin(ランダ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 25mg/m² 点滴 | 1~ (3週間間隔の投与時のみ) | Day1,8 |
デュルバルマブ:Durvalumab(イミフィンジ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,500mg/回 点滴 | 1~ | Day1 |
その他
| GEM+CDDPをGC療法と呼ぶ。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*日本イーライリリーの外部サイトへ遷移します
*日本化薬の外部サイトへ遷移します
*アストラゼネカ株式会社の外部サイトへ遷移します
用法用量
TOPAZ-1試験⁷⁾のプロトコル
① 3週間を1コースとして、 デュルバルマブ1500mgを第1日目に、 シスプラチン (25mg/m²) とゲムシタビン (1000mg/m²) を第1、 8日目に最大8コース投与後、 ② デュルバルマブ1500mgを4週間間隔で投与。
①1コース3週間 (最大8コース投与)

体重30kg以下 : デュルバルマブの1回投与量は20mg/kg
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より作図
②デュルバルマブ単剤を4週間ごとに投与

体重30kg以下 : デュルバルマブの1回投与量は20mg/kg
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より作図
投与開始基準
TOPAZ-1試験⁷⁾のプロトコル
18歳以上で初期診断時に切除不能又は転移性となった胆道癌患者で、以下などを満たす場合

NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より作図
休薬・中止基準
デュルバルマブ電子添文⁵⁾の基準

イミフィンジ®電子添文 (2023年11月改訂 第6版)⁵⁾より作図
主な有害事象
TOPAZ-1試験⁷⁾
主な有害事象 (カッコ内はGrade3~4)
- 貧血 48.2% (23.7%)
- 好中球減少症 31.7% (20.1%)
- 好中球数減少 26.9% (21.0%)
- 血小板数減少 20.7% (9.8%)
- 血小板減少症 12.7% (4.7%)
- 白血球数減少 10.9% (4.4%)
- 白血球減少症 5.9% (2.4 %)
- 悪心 40.2% (1.5%)
- 便秘 32.0% (0.6%)
- 倦怠感 26.9% (3.3%)
- 食欲減退 25.7% (2.1%)
- 発熱 20.1% (1.5%)
- 嘔吐 18.3% (1.5%)
- 下痢 16.9% (1.2%)
NEJM Evid. 2022 Aug;1(8):EVIDoa2200015⁷⁾より引用
特徴と注意点
TOPAZ-1試験⁷⁾の概要
胆道癌における免疫チェックポイント阻害薬の有効性を示した初めての試験である。
主要評価項目である全生存期間、 副次評価項目である無増悪生存期間、 奏効割合等、 全ての評価項目においてGC療法に対する優越性が証明された。
治療開始後8サイクルまでGC+デュルバルマブ療法を行い、 以降はデュルバルマブのみを4週毎に投与することとしていた。 実際の臨床の現場でも同様にデュルバルマブ単独投与とするか、 ゲムシタビン+デュルバルマブで継続するか、 今後、 一般臨床における使用の増加により有効性や有害事象も含めデータの蓄積が期待される。
PD-L1の発現強度における有効性の差はなく、 高発現・低発現に関わらず有効であった。
TOPAZ-1試験⁷⁾の有害事象等
有害事象はGC療法と同等であり、 免疫チェックポイント阻害薬による増加はなかった。
執筆 : 北海道大学病院 腫瘍センター 助教 川本 泰之先生
関連する臨床試験|TOPAZ-1試験⁷⁾
切除不能な局所進行・転移性の胆道腺癌 (肝内・肝外胆管癌、 胆嚢癌を含む) 患者において、 抗PD-L1抗体デュルバルマブと化学療法 (ゲムシタビン+シスプラチン;GC療法) の併用療法の効果を、 プラセボと化学療法の併用療法を対照に検証した第Ⅲ相二重盲検ランダム化比較試験TOPAZ-1の結果より、 全生存期間 (OS) の有意な改善が示された。
OS中央値
- デュルバルマブ群 : 12.8ヵ月
(95%CI 11.1-14.0ヵ月)
- プラセボ群 : 11.5ヵ月
(95%CI 10.1-12.5ヵ月)
HR 0.80 (95%CI 0.66-0.97)、 p=0.021
OS率 (12ヵ月時、 18ヵ月時、 24ヵ月時)
- デュルバルマブ群 : 54.1%、 35.1%、 24.9%
- プラセボ群 : 48.0%、 25.6%、 10.4%
OSのサブグループ解析
- PD-L1腫瘍面積陽性 (TAP) スコアが1%以上の患者において、 デュルバルマブ群とプラセボ群のOSのHRは0.79 (95%CI 0.61-1.00) であった。
- 同様に、 TAPスコアが1%未満の患者では、 HRは0.86 (95%CI 0.60-1.23) であった。
PFS中央値
- デュルバルマブ群 : 7.2ヵ月
(95%CI 6.7-7.4ヵ月)
- プラセボ群 : 5.7ヵ月
(95%CI 5.6-6.7ヵ月)
HR 0.75 (95%CI 0.63-0.89)、 p=0.001
ORR
- デュルバルマブ群 : 26.7%
- プラセボ群 : 18.7%
オッズ比 1.60 (95%CI 1.11-2.31)
病勢コントロール率
- デュルバルマブ群 : 85.3%
- プラセボ群 : 82.6%
出典
- 日本イーライリリー. ジェムザール®電子添文 (2021年8月改訂 第1版) [最終閲覧 : 2024/03/26]
- 日本イーライリリー. ジェムザール®適正使用ガイド (2021年10月作成) [最終閲覧 : 2024/03/26]
- 日本化薬. ランダ®電子添文 (2021年4月改訂 第1版) [最終閲覧 : 2024/03/27]
- 日本化薬. ランダ®安全性情報 (2021年6月作成) [最終閲覧 : 2024/03/27]
- アストラゼネカ株式会社. イミフィンジ®電子添文 (2023年11月改訂 第6版) [最終閲覧 : 2024/03/26]
- アストラゼネカ株式会社. イミフィンジ®適正使用ガイド (2023年11月作成) [最終閲覧 : 2024/03/26]
- Durvalumab plus Gemcitabine and Cisplatin in Advanced Biliary Tract Cancer. NEJM Evid. 2022 Aug;1(8):EVIDoa2200015. PMID: 38319896
最終更新日 : 2024年5月21日
執筆医 : 北海道大学病院 腫瘍センター 助教 川本 泰之先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
