Ropeginterferon alfa-2b:ロペグインターフェロンα-2b(ベスレミ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100µg皮下注 | 1 | 2週毎 |
その他
| 開始用量は1回100µg (他の細胞減少療法併用中は1回50µg) を2週に1回皮下投与. |
| 50µgずつ増量し、 1回最大投与量は500µg. |
| 既存治療が効果不十分又は不適当な場合に用いる. |
| 他のインターフェロン製剤で間質性肺炎の発現が報告されているため小柴胡湯とは併用禁忌. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ロペグインターフェロンアルファ-2b (遺伝子組換え) キット
*ファーマエッセンシアジャパン株式会社の外部サイトへ遷移
主な有害事象
PROUD-PV and CONTINUATION-PV試験¹⁾
- 血小板減少 (Grade1-2 21%、 Grade3 2%)
- 白血球減少 (Grade1-2 18%、 Grade3 2%)
- 貧血 (Grade1-2 13%、 Grade3 1%)
- 倦怠感 (Grade1-2 13%、 Grade3 0%)
- γ-GTP増加 (Grade1-2 16%、 Grade3 7%、 Grade4 1%)
- 頭痛 (Grade1-2 12%、 Grade3 0%)
- 眩暈 (Grade1-2 11%、 Grade3 0%)
- ALT増加 (Grade1-2 13%、 Grade3 4%)
- 関節痛 (Grade1-2 12%、 Grade3 1%)
- AST増加 (Grade1-2 10%、 Grade3 2%)
特徴と注意点
適応と作用機序
適応 : 真性多血症 (既存治療が効果不十分又は不適当な場合に限る)
部位選択的にポリエチレングリコールをインターフェロンα-2bに結合させた遺伝子組換えインターフェロンα-2b製剤であり、 部位選択的モノペグ化により単一の異性体を含有する。
JAK2 V617F変異陽性造血幹細胞に作用し、 長期再構築能の低下を介してJAK2 V617F変異を枯渇させると考えられている。
治療戦略²⁾
高血圧、 脂質異常症、 肥満、 糖尿病などの血栓症のリスクを有する場合はこれらの治療を行う。
低リスク群 (60歳未満 かつ血栓症既往なし)
①瀉血+低用量アスピリン*の投与
高リスク群
①瀉血療法、 ②低用量アスピリン*に加え、
③細胞減少療法**
*PVに対しては低用量アスピリンは国内未承認
**ヒドロキシカルバミド、 抗癌剤、 インターフェロン、 分子標的薬 (JAK阻害薬) を使い、 血液細胞数を減少させる治療法
細胞減少療法について
第一選択薬はヒドロキシウレア (HU)
HU長期投与による二次発がんリスクも完全に否定されないため、 40歳未満の若年者に、 ロペグインターフェロンαを考慮してもよい。
HU不耐容・抵抗性の場合はルキソリチニブまたはロペグインターフェロンαを考慮してもよい。
参考 : 国内第Ⅱ相試験 (A19-201)の定義
標準的な治療が困難な真性多血症患者を対象とした、 国内第Ⅱ相試験 (A19-201試験) における 「標準的な治療が困難」 の定義は以下のとおり
- 長期の治療が想定される若年患者
- 低リスクだが、 疾患に関連する症状及び徴候により細胞減少療法が推奨される患者
- ヒドロキシカルバミドの治療歴 (<3年) があり、 欧州白血病ネット (ELN) 基準に基づくヒドロキシカルバミドに不耐容の患者。
なお、 症候性脾腫を有する患者及びELN基準に基づきヒドロキシカルバミドに治療抵抗性の患者は除外された。
NCCN guideline Ver1.2024³⁾ におけるロペグインターフェロンα-2bの位置づけ
細胞減量療法の1つとしてヒドロキシウレア、 ペグインターフェロンα-2aとロペグインターフェロンα-2bが併記されている。 >>最新版を確認
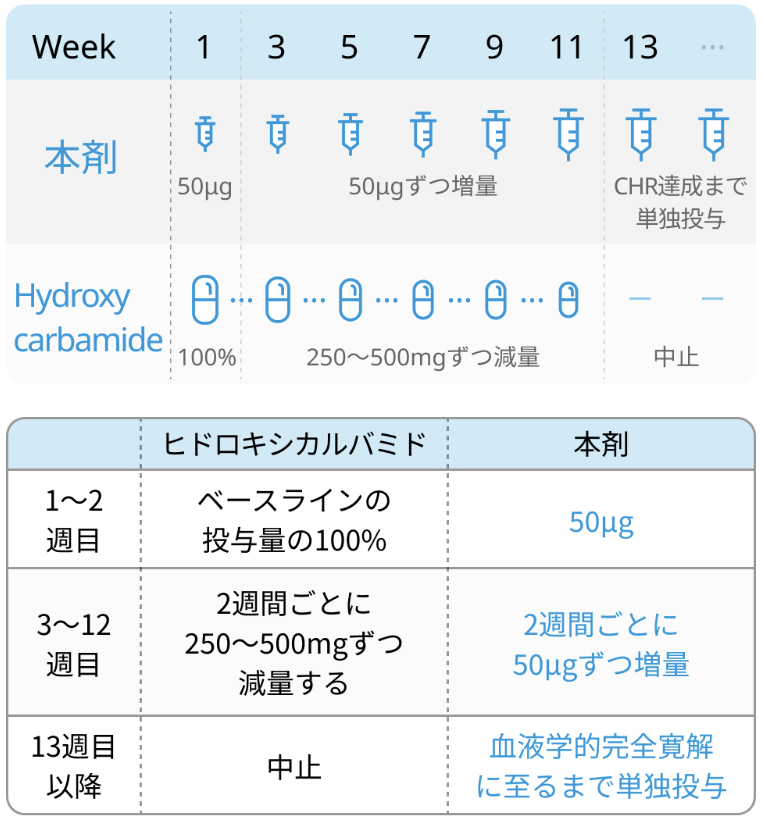
ヒドロキシカルバミド (ハイドレア®) からの切り替え方法例
ヒドロキシカルバミドを含む細胞減少療法剤を投与中の症例は、 ロペグインターフェロンα-2bの開始用量を50μgとして、 併用にて開始。
開始2週目以降、 ロペグインターフェロンα-2bの用量を50μgずつ増量し、 同時にヒドロキシカルバミド等を減量 (ヒドロキシカルバミドの場合250-500mgずつ) し、 投与13週までに中止。
ヒドロキシカルバミドからの切り替え方法例
用法・用量
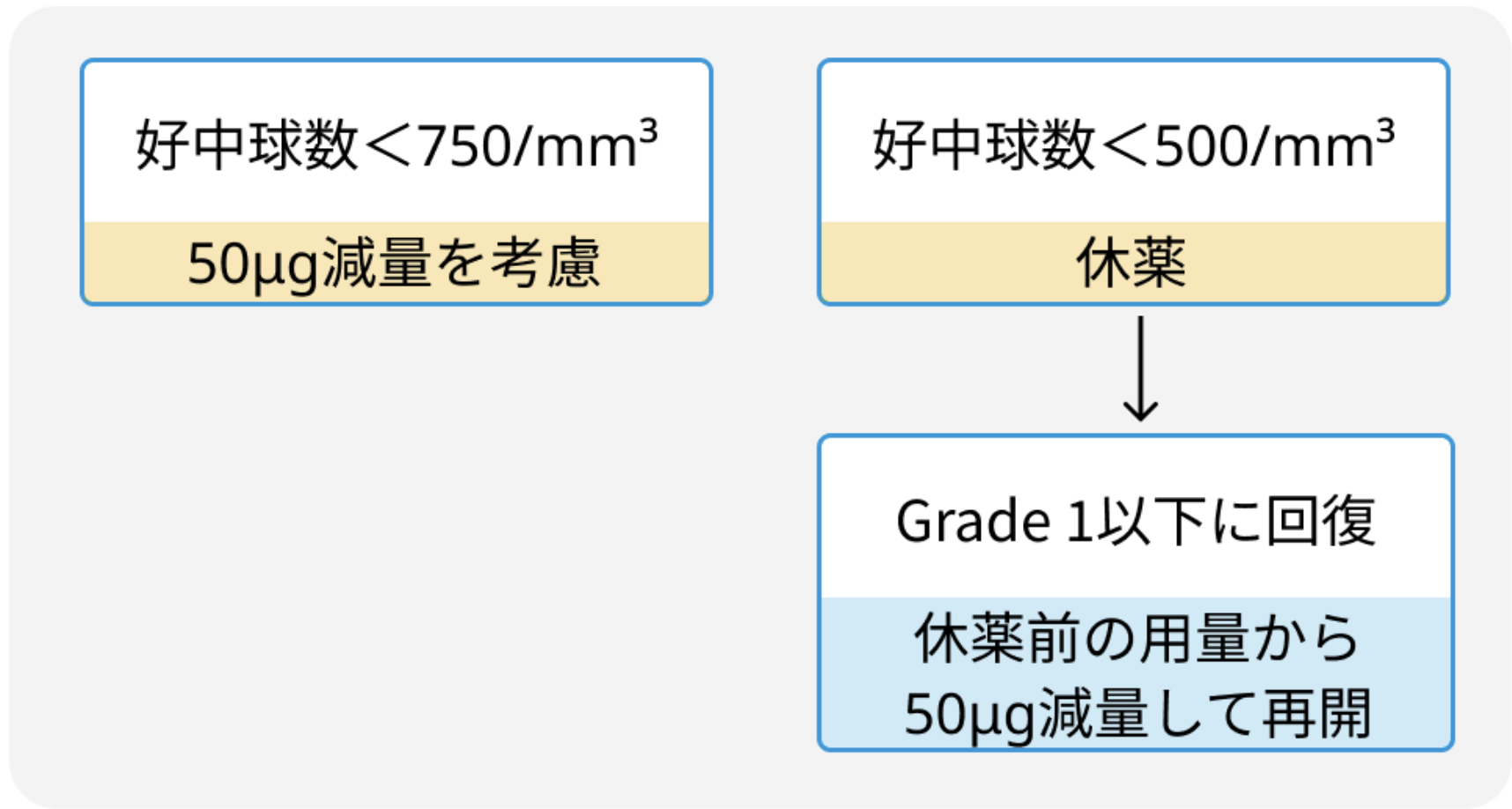
開始用量は1回100µg (他の細胞減少療法併用中は1回50µg) を2週に1回皮下投与. 50µgずつ増量し、 1回最大投与量は500µg. 有害事象に応じた用量調節は以下の通り。
好中球減少
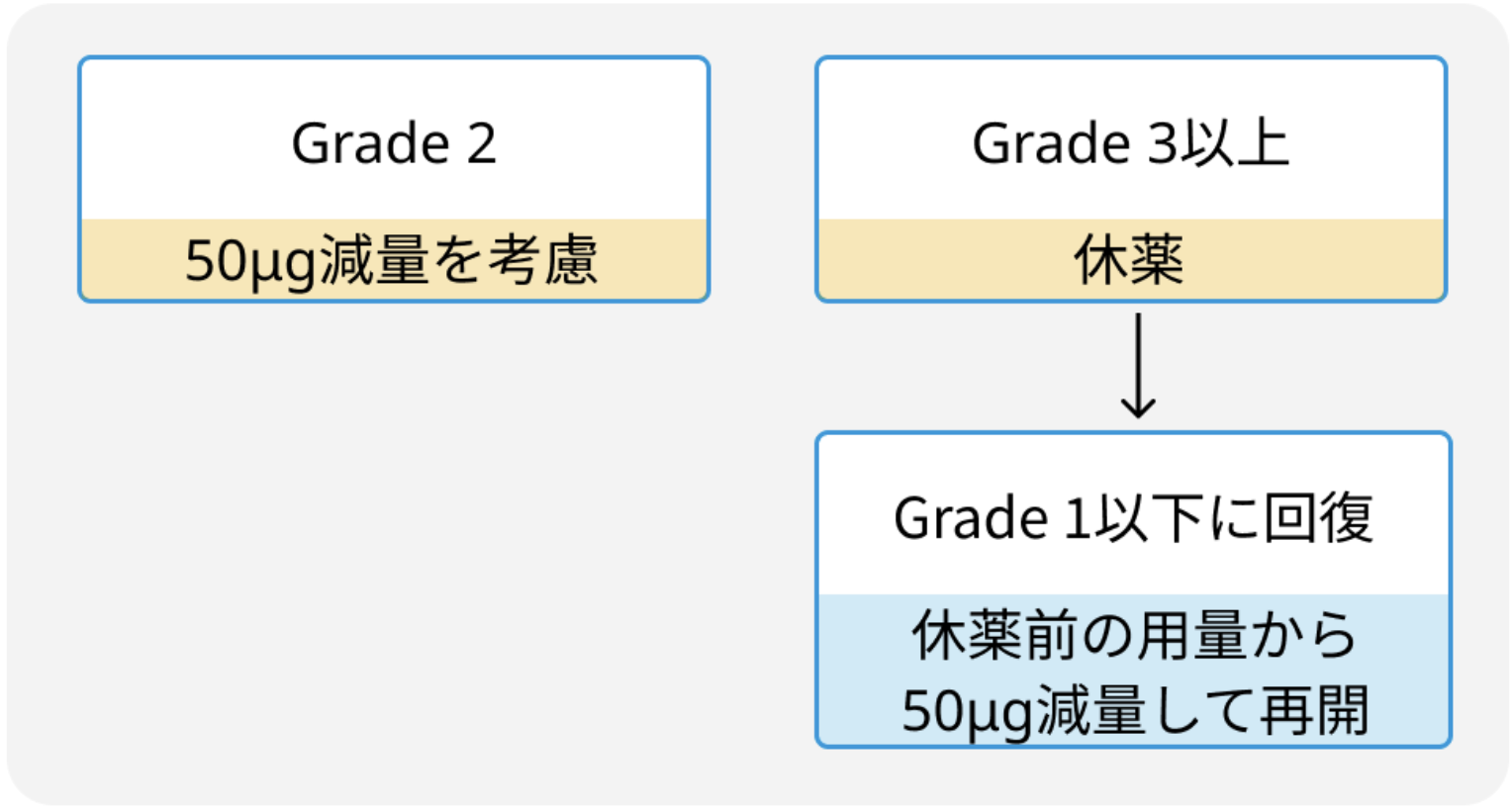
好中球減少以外の副作用
2024年6月より 「自己注射」 も選択肢に
投薬期間制限解除および在宅自己注射指導管理料の対象薬剤となり、 在宅自己注射が保険適用になった。 主治医により適用が妥当と判断された患者さんでは、 事前に十分な説明とトレーニングを受けた上で、 自己注射を選択できる。
臨床試験
CONTINUATION-PV試験¹⁾、 5年時追跡⁴⁾
IQR : Interquartile range、 CHR : Complete hematological response、 LOCF : Last Observation Carried Forward
概要
- 多施設共同非盲検第III相試験 (PROUD-PV試験及びPEN-PV試験の延長試験).
- 対象 : PROUD-PV試験に組み入れられ、 試験を完了した真性多血症患者.
- 介入 : ロペグインターフェロンα-2b群 (PROUD-PV試験又はPEN-PV試験で決定した最適な疾患奏効が得られる個別用量を継続) vs. 対象群 (医師の裁量で決定された標準的一時治療).
- PROUD-PV試験 : ロペグインターフェロンα-2b群とヒドロキシウレア群による無作為化比較試験. ロペグインターフェロンα-2bは1回100µg (ヒドロキシウレアから切替時は50µg) から開始し、 至適用量まで増量した. 試験期間12ヵ月.
結果
- ロペグインターフェロンα-2bの平均用量 : 425µg (IQR 250-500).
- 36ヵ月時の疾患奏効率 (CHR及び膵臓サイズ正常化) : ロペグインターフェロンα-2b群 42% vs. 対象群 30% (p=0.16).
- 36ヵ月時の疾患奏効率 (CHR及び疾患負荷の改善) : ロペグインターフェロンα-2b群 53% vs. 対象群 38% (RR 1.42、 95%CI 1.01-2.00、 p=0.044).
- 36ヵ月時の疾患奏効率 (CHR) : ロペグインターフェロンα-2b群 71% vs. 対象群 51% (RR 1.38、 95%CI 1.07-1.79、 p=0.012).
- 36ヵ月時の分子遺伝学的奏効率 : ロペグインターフェロンα-2b群 66% vs. 対象群 27% (RR 2.31、 95%CI 1.56-3.42、 p<0.0001).
- 36ヵ月時のJAK2 V61F変異アレルバーデン値 : ロペグインターフェロンα-2b群 19.7% (SD 23.4) vs. 対象群 39.3% (SD 25.91).
- 36ヵ月時のJAK2 V61F変異アレルバーデン減少絶対値 : ロペグインターフェロンα-2b群 -22.9±24.79% vs. 対象群 -3.5±21.37% (95%CI -24.19- -13.58、 p<0.0001).
- 5年時の疾患奏効率 (CHR及び膵臓サイズ正常化) : ロペグインターフェロンα-2b群 55.8% vs. 対象群 44.0% (RR 1.30、 95%CI 0.95-1.77、 p=0.0974).
- LOCF法調整による5年時の疾患奏効率 (CHR及び膵臓サイズ正常化) : ロペグインターフェロンα-2b群 72.6% vs. 対象群 52.6% (RR 1.43、 95%CI 1.12-1.81、 p=0.004).
- 5年時の分子遺伝学的奏効率 : ロペグインターフェロンα-2b群 69.1% vs. 対象群 21.6% (RR 3.04、 95%CI 1.96-4.71、 p<0.0001).
- 5年時のJAK2 V61F変異アレルバーデン値 : ロペグインターフェロンα-2b群 8.5% vs. 対象群 44.4% (p<0.0001).
- 5年時のJAK2 V61F変異アレルバーデン値10%以下 : ロペグインターフェロンα-2b群 54.3%.
- 5年時のJAK2 V61F変異アレルバーデン値1%以下 : ロペグインターフェロンα-2b群 19.6%.
安全性
CONTINUATION-PV試験5年時追跡試験⁴⁾より引用.
- 中止に至った副作用 : ロペグインターフェロンα-2b群 10.2% vs. 対象群 3.1%.
- 病勢進行 (骨髄線維症及び白血病への移行) : ロペグインターフェロンα-2b群 0.8% vs. 対象群 3.1%.
- いずれかの新生物 : ロペグインターフェロンα-2b群 9.4% vs. 対象群 11.8%.
- 基底細胞がん及び悪性黒色腫 : ロペグインターフェロンα-2b群 0.0% vs. 対象群 2.4%.
- 主要な血栓塞栓性有害事象 : ロペグインターフェロンα-2b群 3.1% vs. 対象群 3.9%.
国内第Ⅱ相臨床試験 (A19-201試験)⁵⁾
概要
- 非盲検、 多施設共同、 単群
- 対象 : 現在の標準治療適応困難な成人日本人PV患者29例.
- 目的 : ロペグインターフェロンα-2bの安全性及び有効性を検証する.
- HU治療に不耐容な患者 (抵抗性は除く)、 又は細胞減少療法による治療歴のない患者 (累積HU治療期間<3年).
- 主要評価項目 : 瀉血を要しない持続的完全血液学的奏効 (durable CHR).
durable CHR: durable complete hematologic response
結果
- Durable CHR達成率 : 8/29例 (27.6%) (*36、 52週時ともに).
- 奏効率 : 12週時 3.4%、 24週時 34.5%、 36週時 31.0%、 52週時 51.7%.
- 治療前のJAK2 V617F変異アレルバーデン値 : 平均値 72.2%、 中央値 81.8% (範囲 23.6-98.3%).
- 52週時のJAK2 V617F変異アレルバーデン値 : 平均値 54.2% (ベースラインからの平均変化量 : -19.2%)
- 分子遺伝学的奏効率 : 42.3% (95%CI 23.4-63.1%).
- 52週時のHCT、 WBC、 PLTの目標達成率は、 それぞれ81.5%、 92.6%、 88.9%.
目標値 : HCT<45%、 WBC<1万/µL、 PLT<40万/µL
- 主な有害事象 : 脱毛症 (55.2%)、 疲労 (27.6%)、 インフルエンザ様疾患 (27.6%).
出典
- Lancet Haematol. 2020;7(3):e196-e208.
- 日本血液学会. 造血器腫瘍診療ガイドライン第3.1版 (2024年版) 金原出版
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Myeloproliferative Neoplasms Version 1.2024 —December 21, 2023
- Leukemia. 2022;36(5):1408-1411.
- Int J Hematol. 2022;116(2):215-227.
最終更新 : 2025年5月20日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
Ropeginterferon α-2b
Ropeginterferon alfa-2b:ロペグインターフェロンα-2b(ベスレミ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100µg皮下注 | 1 | 2週毎 |
その他
| 開始用量は1回100µg (他の細胞減少療法併用中は1回50µg) を2週に1回皮下投与. |
| 50µgずつ増量し、 1回最大投与量は500µg. |
| 既存治療が効果不十分又は不適当な場合に用いる. |
| 他のインターフェロン製剤で間質性肺炎の発現が報告されているため小柴胡湯とは併用禁忌. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ロペグインターフェロンアルファ-2b (遺伝子組換え) キット
*ファーマエッセンシアジャパン株式会社の外部サイトへ遷移
主な有害事象
PROUD-PV and CONTINUATION-PV試験¹⁾
- 血小板減少 (Grade1-2 21%、 Grade3 2%)
- 白血球減少 (Grade1-2 18%、 Grade3 2%)
- 貧血 (Grade1-2 13%、 Grade3 1%)
- 倦怠感 (Grade1-2 13%、 Grade3 0%)
- γ-GTP増加 (Grade1-2 16%、 Grade3 7%、 Grade4 1%)
- 頭痛 (Grade1-2 12%、 Grade3 0%)
- 眩暈 (Grade1-2 11%、 Grade3 0%)
- ALT増加 (Grade1-2 13%、 Grade3 4%)
- 関節痛 (Grade1-2 12%、 Grade3 1%)
- AST増加 (Grade1-2 10%、 Grade3 2%)
特徴と注意点
適応と作用機序
適応 : 真性多血症 (既存治療が効果不十分又は不適当な場合に限る)
部位選択的にポリエチレングリコールをインターフェロンα-2bに結合させた遺伝子組換えインターフェロンα-2b製剤であり、 部位選択的モノペグ化により単一の異性体を含有する。
JAK2 V617F変異陽性造血幹細胞に作用し、 長期再構築能の低下を介してJAK2 V617F変異を枯渇させると考えられている。
治療戦略²⁾
高血圧、 脂質異常症、 肥満、 糖尿病などの血栓症のリスクを有する場合はこれらの治療を行う。
低リスク群 (60歳未満 かつ血栓症既往なし)
①瀉血+低用量アスピリン*の投与
高リスク群
①瀉血療法、 ②低用量アスピリン*に加え、
③細胞減少療法**
*PVに対しては低用量アスピリンは国内未承認
**ヒドロキシカルバミド、 抗癌剤、 インターフェロン、 分子標的薬 (JAK阻害薬) を使い、 血液細胞数を減少させる治療法
細胞減少療法について
第一選択薬はヒドロキシウレア (HU)
HU長期投与による二次発がんリスクも完全に否定されないため、 40歳未満の若年者に、 ロペグインターフェロンαを考慮してもよい。
HU不耐容・抵抗性の場合はルキソリチニブまたはロペグインターフェロンαを考慮してもよい。
参考 : 国内第Ⅱ相試験 (A19-201)の定義
標準的な治療が困難な真性多血症患者を対象とした、 国内第Ⅱ相試験 (A19-201試験) における 「標準的な治療が困難」 の定義は以下のとおり
- 長期の治療が想定される若年患者
- 低リスクだが、 疾患に関連する症状及び徴候により細胞減少療法が推奨される患者
- ヒドロキシカルバミドの治療歴 (<3年) があり、 欧州白血病ネット (ELN) 基準に基づくヒドロキシカルバミドに不耐容の患者。
なお、 症候性脾腫を有する患者及びELN基準に基づきヒドロキシカルバミドに治療抵抗性の患者は除外された。
NCCN guideline Ver1.2024³⁾ におけるロペグインターフェロンα-2bの位置づけ
細胞減量療法の1つとしてヒドロキシウレア、 ペグインターフェロンα-2aとロペグインターフェロンα-2bが併記されている。 >>最新版を確認
ヒドロキシカルバミド (ハイドレア®) からの切り替え方法例
ヒドロキシカルバミドを含む細胞減少療法剤を投与中の症例は、 ロペグインターフェロンα-2bの開始用量を50μgとして、 併用にて開始。
開始2週目以降、 ロペグインターフェロンα-2bの用量を50μgずつ増量し、 同時にヒドロキシカルバミド等を減量 (ヒドロキシカルバミドの場合250-500mgずつ) し、 投与13週までに中止。
ヒドロキシカルバミドからの切り替え方法例

用法・用量
開始用量は1回100µg (他の細胞減少療法併用中は1回50µg) を2週に1回皮下投与. 50µgずつ増量し、 1回最大投与量は500µg. 有害事象に応じた用量調節は以下の通り。
好中球減少

好中球減少以外の副作用

2024年6月より 「自己注射」 も選択肢に
投薬期間制限解除および在宅自己注射指導管理料の対象薬剤となり、 在宅自己注射が保険適用になった。 主治医により適用が妥当と判断された患者さんでは、 事前に十分な説明とトレーニングを受けた上で、 自己注射を選択できる。
臨床試験
CONTINUATION-PV試験¹⁾、 5年時追跡⁴⁾
IQR : Interquartile range、 CHR : Complete hematological response、 LOCF : Last Observation Carried Forward
概要
- 多施設共同非盲検第III相試験 (PROUD-PV試験及びPEN-PV試験の延長試験).
- 対象 : PROUD-PV試験に組み入れられ、 試験を完了した真性多血症患者.
- 介入 : ロペグインターフェロンα-2b群 (PROUD-PV試験又はPEN-PV試験で決定した最適な疾患奏効が得られる個別用量を継続) vs. 対象群 (医師の裁量で決定された標準的一時治療).
- PROUD-PV試験 : ロペグインターフェロンα-2b群とヒドロキシウレア群による無作為化比較試験. ロペグインターフェロンα-2bは1回100µg (ヒドロキシウレアから切替時は50µg) から開始し、 至適用量まで増量した. 試験期間12ヵ月.
結果
- ロペグインターフェロンα-2bの平均用量 : 425µg (IQR 250-500).
- 36ヵ月時の疾患奏効率 (CHR及び膵臓サイズ正常化) : ロペグインターフェロンα-2b群 42% vs. 対象群 30% (p=0.16).
- 36ヵ月時の疾患奏効率 (CHR及び疾患負荷の改善) : ロペグインターフェロンα-2b群 53% vs. 対象群 38% (RR 1.42、 95%CI 1.01-2.00、 p=0.044).
- 36ヵ月時の疾患奏効率 (CHR) : ロペグインターフェロンα-2b群 71% vs. 対象群 51% (RR 1.38、 95%CI 1.07-1.79、 p=0.012).
- 36ヵ月時の分子遺伝学的奏効率 : ロペグインターフェロンα-2b群 66% vs. 対象群 27% (RR 2.31、 95%CI 1.56-3.42、 p<0.0001).
- 36ヵ月時のJAK2 V61F変異アレルバーデン値 : ロペグインターフェロンα-2b群 19.7% (SD 23.4) vs. 対象群 39.3% (SD 25.91).
- 36ヵ月時のJAK2 V61F変異アレルバーデン減少絶対値 : ロペグインターフェロンα-2b群 -22.9±24.79% vs. 対象群 -3.5±21.37% (95%CI -24.19- -13.58、 p<0.0001).
- 5年時の疾患奏効率 (CHR及び膵臓サイズ正常化) : ロペグインターフェロンα-2b群 55.8% vs. 対象群 44.0% (RR 1.30、 95%CI 0.95-1.77、 p=0.0974).
- LOCF法調整による5年時の疾患奏効率 (CHR及び膵臓サイズ正常化) : ロペグインターフェロンα-2b群 72.6% vs. 対象群 52.6% (RR 1.43、 95%CI 1.12-1.81、 p=0.004).
- 5年時の分子遺伝学的奏効率 : ロペグインターフェロンα-2b群 69.1% vs. 対象群 21.6% (RR 3.04、 95%CI 1.96-4.71、 p<0.0001).
- 5年時のJAK2 V61F変異アレルバーデン値 : ロペグインターフェロンα-2b群 8.5% vs. 対象群 44.4% (p<0.0001).
- 5年時のJAK2 V61F変異アレルバーデン値10%以下 : ロペグインターフェロンα-2b群 54.3%.
- 5年時のJAK2 V61F変異アレルバーデン値1%以下 : ロペグインターフェロンα-2b群 19.6%.
安全性
CONTINUATION-PV試験5年時追跡試験⁴⁾より引用.
- 中止に至った副作用 : ロペグインターフェロンα-2b群 10.2% vs. 対象群 3.1%.
- 病勢進行 (骨髄線維症及び白血病への移行) : ロペグインターフェロンα-2b群 0.8% vs. 対象群 3.1%.
- いずれかの新生物 : ロペグインターフェロンα-2b群 9.4% vs. 対象群 11.8%.
- 基底細胞がん及び悪性黒色腫 : ロペグインターフェロンα-2b群 0.0% vs. 対象群 2.4%.
- 主要な血栓塞栓性有害事象 : ロペグインターフェロンα-2b群 3.1% vs. 対象群 3.9%.
国内第Ⅱ相臨床試験 (A19-201試験)⁵⁾
概要
- 非盲検、 多施設共同、 単群
- 対象 : 現在の標準治療適応困難な成人日本人PV患者29例.
- 目的 : ロペグインターフェロンα-2bの安全性及び有効性を検証する.
- HU治療に不耐容な患者 (抵抗性は除く)、 又は細胞減少療法による治療歴のない患者 (累積HU治療期間<3年).
- 主要評価項目 : 瀉血を要しない持続的完全血液学的奏効 (durable CHR).
durable CHR: durable complete hematologic response
結果
- Durable CHR達成率 : 8/29例 (27.6%) (*36、 52週時ともに).
- 奏効率 : 12週時 3.4%、 24週時 34.5%、 36週時 31.0%、 52週時 51.7%.
- 治療前のJAK2 V617F変異アレルバーデン値 : 平均値 72.2%、 中央値 81.8% (範囲 23.6-98.3%).
- 52週時のJAK2 V617F変異アレルバーデン値 : 平均値 54.2% (ベースラインからの平均変化量 : -19.2%)
- 分子遺伝学的奏効率 : 42.3% (95%CI 23.4-63.1%).
- 52週時のHCT、 WBC、 PLTの目標達成率は、 それぞれ81.5%、 92.6%、 88.9%.
目標値 : HCT<45%、 WBC<1万/µL、 PLT<40万/µL
- 主な有害事象 : 脱毛症 (55.2%)、 疲労 (27.6%)、 インフルエンザ様疾患 (27.6%).
出典
- Lancet Haematol. 2020;7(3):e196-e208.
- 日本血液学会. 造血器腫瘍診療ガイドライン第3.1版 (2024年版) 金原出版
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Myeloproliferative Neoplasms Version 1.2024 —December 21, 2023
- Leukemia. 2022;36(5):1408-1411.
- Int J Hematol. 2022;116(2):215-227.
最終更新 : 2025年5月20日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
