本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
PARP阻害薬 タラゾパリブトシル酸塩
*ファイザー株式会社の外部サイトへ遷移します
投与スケジュール
がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌
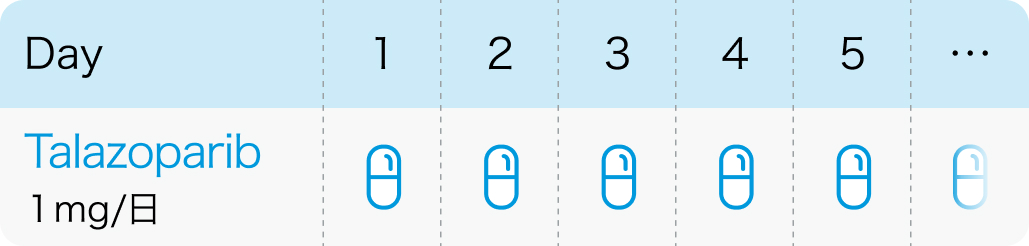
タラゾパリブとして1日1回1mgを経口投与
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
※乳癌の適応は0.25mg、1mgカプセルのみ
0.1mgカプセルはBRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌のみ適応
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
Key Data|臨床試験結果
EMBRACA試験
N Engl J Med. 2018;379(8):753-763.
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者431例を対象に、 タラゾパリブ1mgを1日1回連続経口投与と標準治療群*の有効性を検討することを目的とした、 無作為化非盲検並行群間 海外第Ⅲ相試験²⁾
*カペシタビン、 エリブリン、 ゲムシタビン又はビノレル
以下はN Engl J Med. 2018 Aug 23;379(8):753-763.より引用
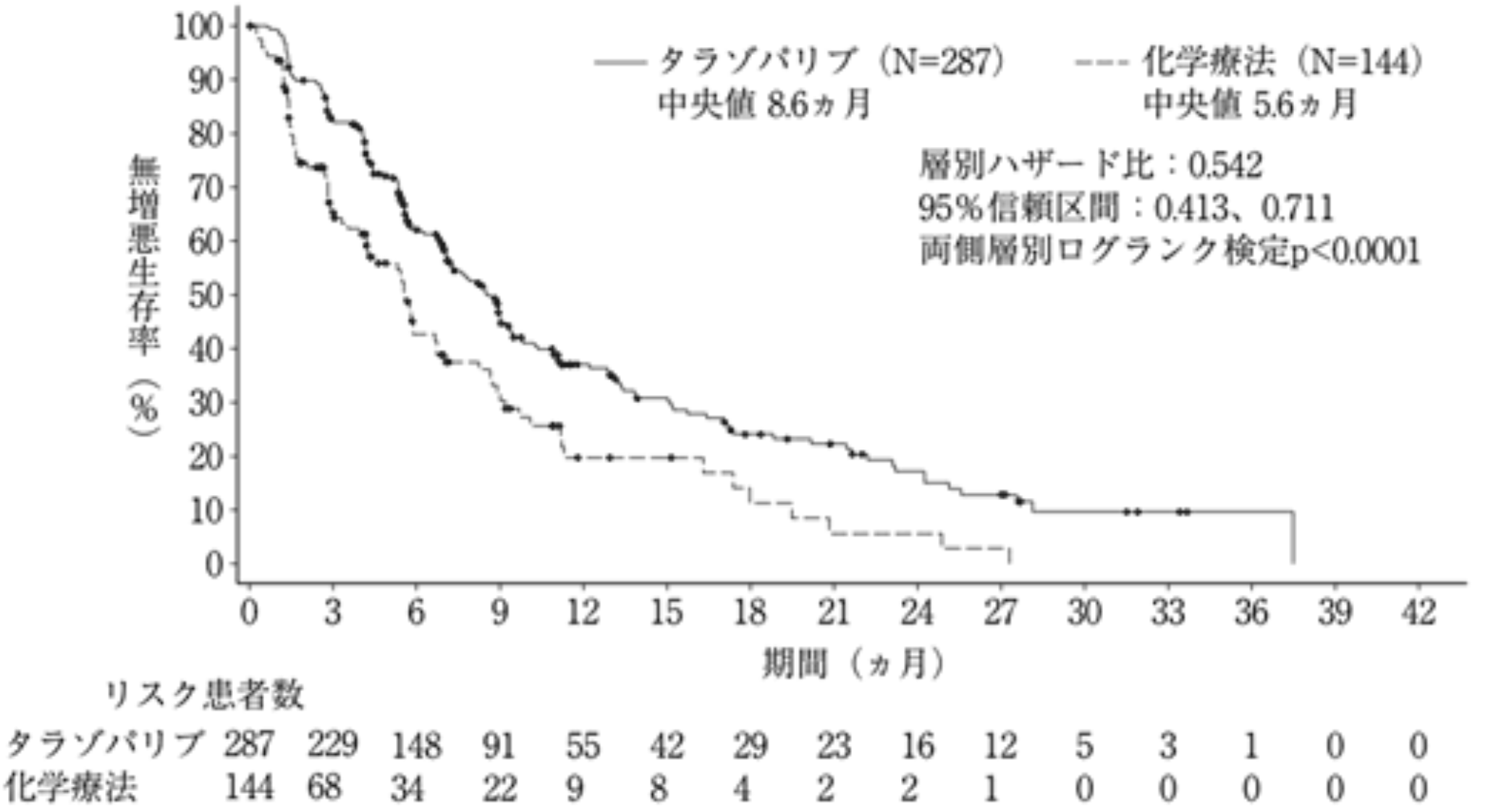
- mPFS : 8.6ヵ月
標準治療群 5.6ヵ月、 HR 0.542, p<0.0001
- ORR : 62.6%
標準治療群 27.2%、OR 4.99、 p<0.001
- mOS 22.3ヵ月
標準治療群 19.5ヵ月、 HR 0.76、 p=0.105
サブグループ解析では、 ホルモン受容体陽性例でより良好な成績が認められた(HR 0.47[同 0.32-0.70] )。 一方で、 OSはオラパリブと同様、 両群で有意差を認めなかった (中央値 19.3ヵ月 vs 19.5ヵ月、 HR 0.848 [同 0.670-1.073]、 p=0.17)。
盲検下独立中央評価による無増悪生存期間のKaplan-Meier曲線 (全解析対象集団)
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
主な有害事象 (カッコ内はGrade3~4)
- 貧血 39.2%*
- 好中球数減少 21.0%*
- 血小板数減少 14.7%*
- 白血球数減少 6.6%*
- リンパ球数減少 3.1%*
- 発熱性好中球減少症 0.3%*
*Grade3、 4のみのデータ
- 倦怠感 50.3% (1.7%)
- 悪心 48.6% (0.3%)
- 嘔吐 24.8% (2.4%)
- 下痢 22.0% (0.7%)
- 便秘 22.0% (0.3%)
- 食欲減退 21.3% (0.3%)
注意すべき有害事象
- 脱毛症 25.2% (0%)
- 手掌・足底発赤知覚不全症候群 1.4% (0.3%)
各プロトコル
投与開始基準
EMBRACA試験³⁾のプロトコールより引用
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者
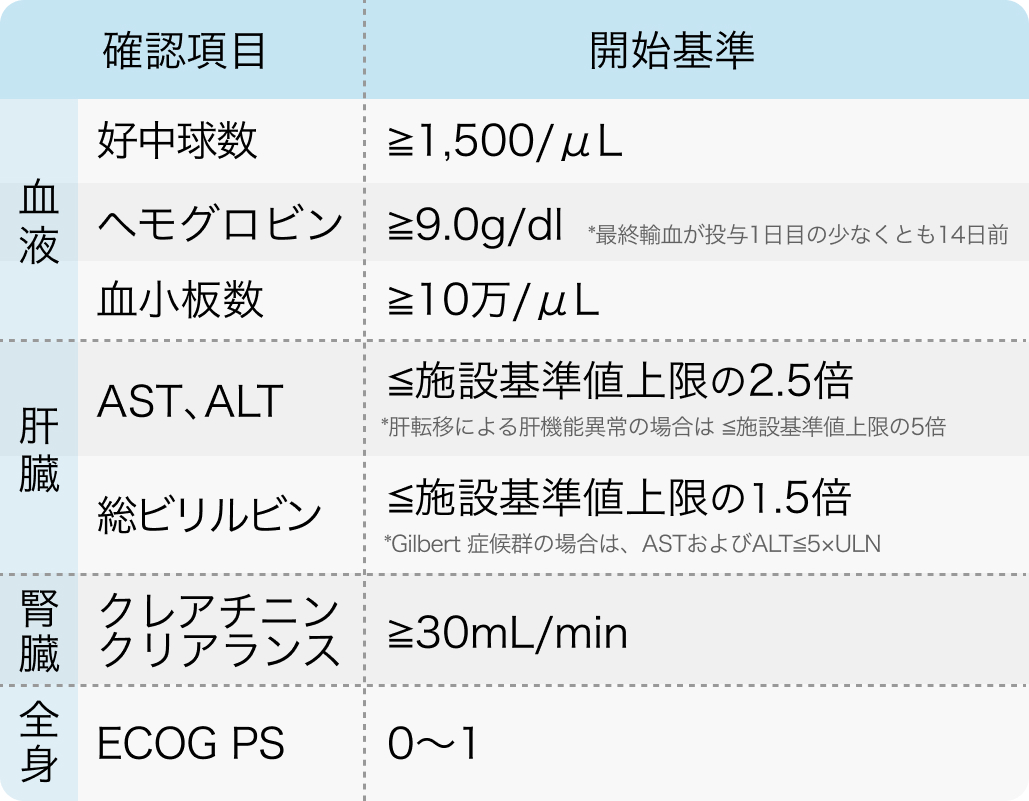
N Engl J Med. 2018 Aug 23;379(8):753-763.³⁾より作表
減量・休薬・中止基準
以下は電子添文より引用
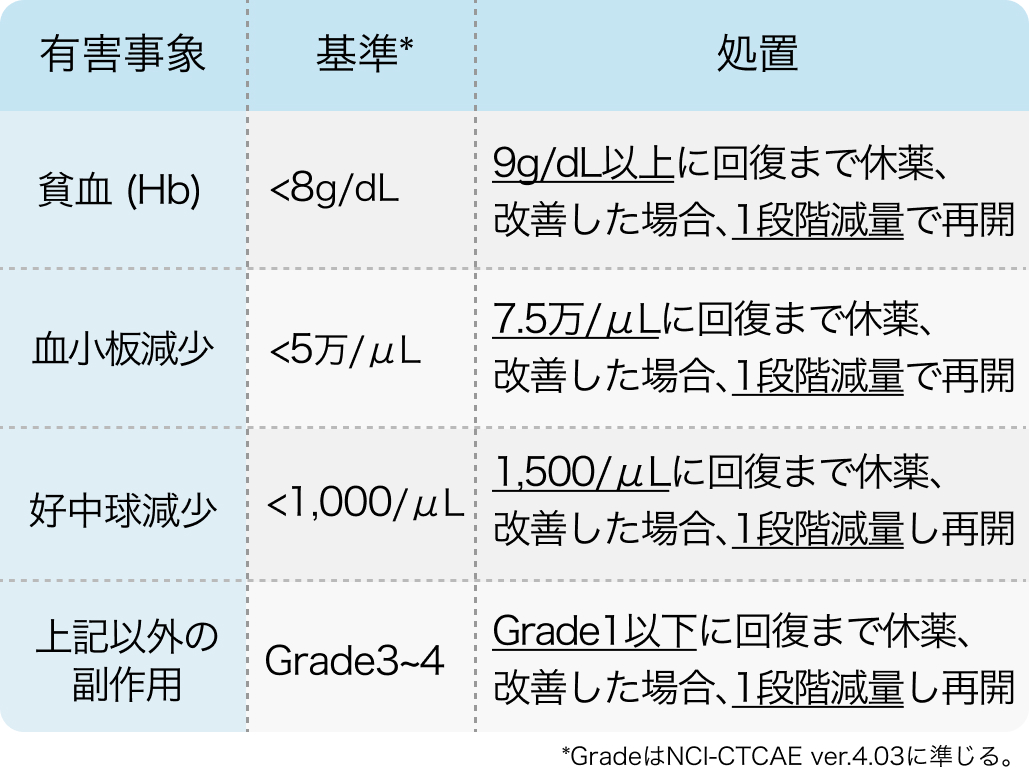
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
減量レベル
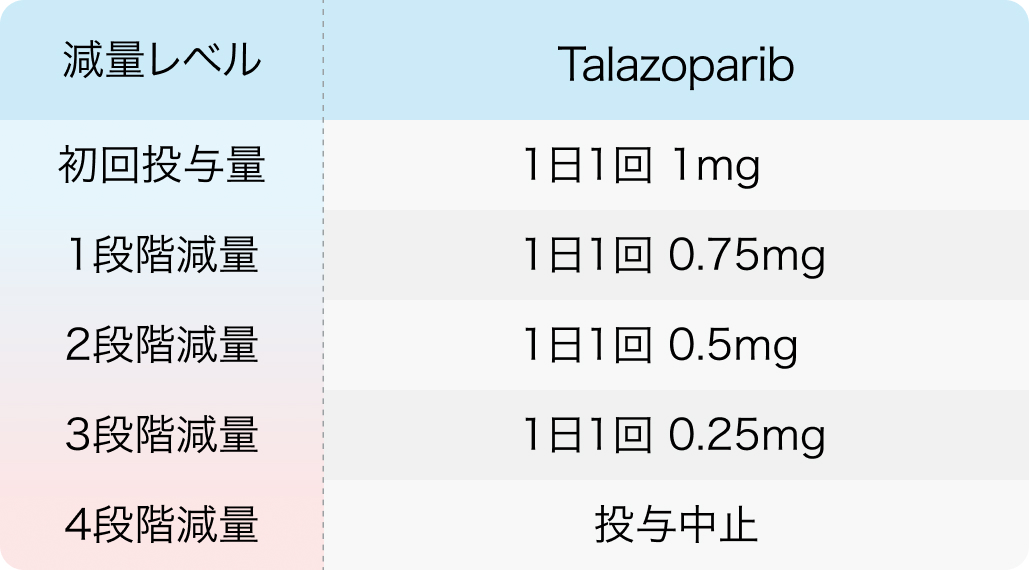
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
腎障害患者に対する用量調整¹⁾
- eGFR 60~30mL/min/1.73m² : 0.75mg/日
- eGFR<30mL/min/1.73m² : 原則投与は避け、 やむを得ず投与する際は血中濃度上昇による副作用に留意し、 慎重に観察する
レジメンの特徴と注意点
本レジメンは、 生殖細胞系列のBRCA遺伝子変異陽性かつHER2陰性で、 アントラサイクリン系またはタキサン系抗悪性腫瘍剤 (禁忌でない場合) の治療歴を有する手術不能または再発乳がんに適用される。
薬剤師からのワンポイントアドバイス
NTT東日本関東病院薬剤部 兼平暖先生
本剤は単剤で使用するが、 卵巣機能抑制を目的とした性腺刺激ホルモン放出ホルモン (GnRHアゴニスト等) との併用は許容される。 また、 前立腺癌での使用とは用量が異なるため、 乳がんへの適用時には用量設定に留意する必要がある。
主な有害事象は骨髄抑制であり、 特に貧血 (Grade≧3) は40.2%に発現し、 発現までの中央値は83日 (13~961日) であった。 貧血の評価にあたっては、 正球性かつ網赤血球の上昇を伴わない場合には内因性エリスロポエチン (EPO) 欠乏の可能性を考慮し、 血中EPO測定を検討する。 大球性 (MCV >115 fL) の場合には、 ビタミンB₁₂や葉酸の欠乏を除外する必要がある。
レジメン適用時の注意事項¹⁾
骨髄抑制 : 定期的に血液検査を行い、 患者の状態を十分に観察。
RMP【重要な特定されたリスク】
ダトロウェイ® 医薬品リスク管理計画書 (RMP)
- 骨髄抑制
- 間質性肺疾患
- 血栓塞栓症
コンパニオン診断薬の情報⁵⁾
本レジメンを適用する場合、 生殖細胞系列のBRCA遺伝子変異陽性を確認する必要がある。 適応判定に利用可能なコンパニオン診断薬は以下のとおり。
BRCA1/2遺伝子変異
- BRACAnalysis診断システム
参考文献
1) ファイザー株式会社. ターゼナ® 電子添文 (2024年1月作成 第1版)
2) ファイザー株式会社. ターゼナ® 適正使用ガイド 乳癌 (2024年4月作成 第2版)
3) N Engl J Med. 2018;379(8):753-763.
最終更新日 : 2025年6月30日
監修医師 : HOKUTO編集部監修医師
Talazoparib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
PARP阻害薬 タラゾパリブトシル酸塩
*ファイザー株式会社の外部サイトへ遷移します
投与スケジュール
がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌

タラゾパリブとして1日1回1mgを経口投与
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
※乳癌の適応は0.25mg、1mgカプセルのみ
0.1mgカプセルはBRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌のみ適応
ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
Key Data|臨床試験結果
EMBRACA試験
N Engl J Med. 2018;379(8):753-763.
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者431例を対象に、 タラゾパリブ1mgを1日1回連続経口投与と標準治療群*の有効性を検討することを目的とした、 無作為化非盲検並行群間 海外第Ⅲ相試験²⁾
*カペシタビン、 エリブリン、 ゲムシタビン又はビノレル
以下はN Engl J Med. 2018 Aug 23;379(8):753-763.より引用
- mPFS : 8.6ヵ月
標準治療群 5.6ヵ月、 HR 0.542, p<0.0001
- ORR : 62.6%
標準治療群 27.2%、OR 4.99、 p<0.001
- mOS 22.3ヵ月
標準治療群 19.5ヵ月、 HR 0.76、 p=0.105
サブグループ解析では、 ホルモン受容体陽性例でより良好な成績が認められた(HR 0.47[同 0.32-0.70] )。 一方で、 OSはオラパリブと同様、 両群で有意差を認めなかった (中央値 19.3ヵ月 vs 19.5ヵ月、 HR 0.848 [同 0.670-1.073]、 p=0.17)。
盲検下独立中央評価による無増悪生存期間のKaplan-Meier曲線 (全解析対象集団)

ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より引用
主な有害事象 (カッコ内はGrade3~4)
- 貧血 39.2%*
- 好中球数減少 21.0%*
- 血小板数減少 14.7%*
- 白血球数減少 6.6%*
- リンパ球数減少 3.1%*
- 発熱性好中球減少症 0.3%*
*Grade3、 4のみのデータ
- 倦怠感 50.3% (1.7%)
- 悪心 48.6% (0.3%)
- 嘔吐 24.8% (2.4%)
- 下痢 22.0% (0.7%)
- 便秘 22.0% (0.3%)
- 食欲減退 21.3% (0.3%)
注意すべき有害事象
- 脱毛症 25.2% (0%)
- 手掌・足底発赤知覚不全症候群 1.4% (0.3%)
各プロトコル
投与開始基準
EMBRACA試験³⁾のプロトコールより引用
生殖細胞系列のBRCA遺伝子変異 (病的変異又は病的変異疑い) 陽性かつHER2陰性であり、 アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤 (禁忌でない場合) による治療歴を有する手術不能又は再発乳癌患者

N Engl J Med. 2018 Aug 23;379(8):753-763.³⁾より作表
減量・休薬・中止基準
以下は電子添文より引用

ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
減量レベル

ターゼナ® 電子添文 2024年1月作成 (第1版)¹⁾より作表
腎障害患者に対する用量調整¹⁾
- eGFR 60~30mL/min/1.73m² : 0.75mg/日
- eGFR<30mL/min/1.73m² : 原則投与は避け、 やむを得ず投与する際は血中濃度上昇による副作用に留意し、 慎重に観察する
レジメンの特徴と注意点
本レジメンは、 生殖細胞系列のBRCA遺伝子変異陽性かつHER2陰性で、 アントラサイクリン系またはタキサン系抗悪性腫瘍剤 (禁忌でない場合) の治療歴を有する手術不能または再発乳がんに適用される。
薬剤師からのワンポイントアドバイス
NTT東日本関東病院薬剤部 兼平暖先生
本剤は単剤で使用するが、 卵巣機能抑制を目的とした性腺刺激ホルモン放出ホルモン (GnRHアゴニスト等) との併用は許容される。 また、 前立腺癌での使用とは用量が異なるため、 乳がんへの適用時には用量設定に留意する必要がある。
主な有害事象は骨髄抑制であり、 特に貧血 (Grade≧3) は40.2%に発現し、 発現までの中央値は83日 (13~961日) であった。 貧血の評価にあたっては、 正球性かつ網赤血球の上昇を伴わない場合には内因性エリスロポエチン (EPO) 欠乏の可能性を考慮し、 血中EPO測定を検討する。 大球性 (MCV >115 fL) の場合には、 ビタミンB₁₂や葉酸の欠乏を除外する必要がある。
レジメン適用時の注意事項¹⁾
骨髄抑制 : 定期的に血液検査を行い、 患者の状態を十分に観察。
RMP【重要な特定されたリスク】
ダトロウェイ® 医薬品リスク管理計画書 (RMP)
- 骨髄抑制
- 間質性肺疾患
- 血栓塞栓症
コンパニオン診断薬の情報⁵⁾
本レジメンを適用する場合、 生殖細胞系列のBRCA遺伝子変異陽性を確認する必要がある。 適応判定に利用可能なコンパニオン診断薬は以下のとおり。
BRCA1/2遺伝子変異
- BRACAnalysis診断システム
参考文献
1) ファイザー株式会社. ターゼナ® 電子添文 (2024年1月作成 第1版)
2) ファイザー株式会社. ターゼナ® 適正使用ガイド 乳癌 (2024年4月作成 第2版)
3) N Engl J Med. 2018;379(8):753-763.
最終更新日 : 2025年6月30日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。