進行・再発の進展型SCLCを対象に2024年12月27日正式承認、 2025年4月16日薬価収載 (10mg 132万6,870円/1日 9万4,776円)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
イムデトラ®点滴静注 (タルラタマブ)
DLL3・CD3二重特異性T細胞誘導抗体 タルラタマブ
*アムジェン株式会社の外部サイトへ遷移します
投与スケジュール
添付文書¹⁾、 DeLLphi-301/304試験³⁾⁴⁾
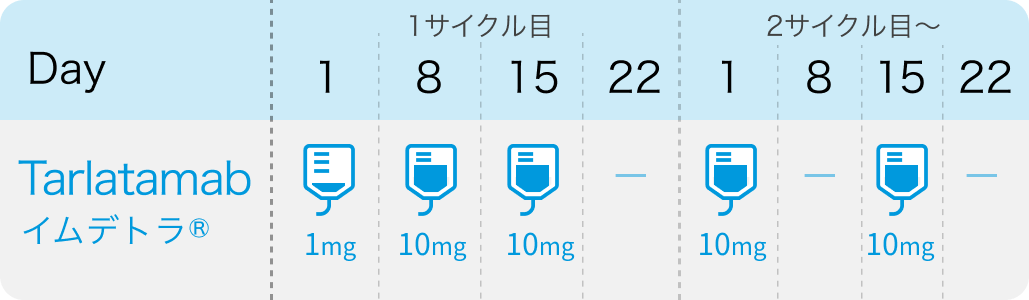
1サイクル28日間で、 1サイクル目のDay1に1mgを、 その後Day8とDay15に10mgを、 2サイクル目以降は病勢進行または許容できない毒性が認められるまで2週間ごと (Day1とDay15) に1時間かけて静脈投与する
添付文書¹⁾、 DeLLphi-301/304試験³⁾⁴⁾より引用
KeyData|臨床試験結果
3次治療を対象とした第2相DeLLphi-301試験の結果に基づく正式承認。 その後、2次治療を対象とした第3相DeLLphi‑304試験の結果も報告され、 ガイドライン2025年で推奨変更となった*。
*イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)では、2次治療の推奨についての記載はない点に注意
DeLLphi-304試験³⁾|2次治療
N Engl J Med. 2025;393(4):349-61.
第3相無作為化オープンラベル試験。 プラチナ製剤併用療法 (±抗PD-L1抗体) 後に病勢進行した進展型SCLCを対象に、 タルラタマブ10mg を2週間毎に投与群 254例と医師選択化学療法群 [トポテカン、 ルルビネクテジン、 アムルビシン] 255例を比較した。 主要評価項目は全生存期間 (OS)であった。
有効性 vs医師選択化学療法
- mOS : 13.6ヵ月 vs 8.3ヵ月
HR 0.60 (95%CI 0.47–0.77)
- mPFS : 4.2ヵ月 vs 3.2–3.7ヵ月
HR 0.72 (95%CI 0.59–0.88)
- ORR : 35% vs 20%
- mDOR : 6.9ヵ月 vs 5.5ヵ月
- 12ヵ月DOR率 41% vs 13%
安全性 特に頻度が高かった有害事象
- CRS : 50–60% (大部分Grade 1–2で3は1%)
- ICANS : 低頻度・主にGrade 1–2
- グレード3以上のTRAEs : 27% vs 62%
- AEによる中止 : 3–5% vs 12%
- グレード3以上の全TEAE : 54% vs 80%
*イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)では、2次治療の推奨についての記載はない点に注意
DeLLphi-301試験⁴⁾|3次治療
N Engl J Med. 2023;389(22):2063-75.
第2相非盲検多施設共同多コホート試験。 プラチナ製剤併用療法を含む2レジメン以上の治療歴があるSCLCを対象にタルラタマブ10mgを2週ごとに投与した99例の結果詳細は、 2023年10月に開催されたESMOで発表され、 同時にNEJM誌に掲載された。 主要有効性評価項目は、 RECIST 1.1に基づく全奏効率 (ORR) と、 盲検独立中央判定による奏効期間 (DOR) であった。
有効性
- ORR : 40% (95%CI 31~51%)
- mDOR : 9.7ヵ月 (95%CI 2.7~20.7ヵ月超)
- mOS : 14.3ヵ月
安全性|特に頻度が高かった有害事象
- CRS : 51%*
- 食欲不振 : 29%
- 発熱 : 35%
*主に初回投与後に生じ、 大部分がGrade1-2であった。 Grade 3 のサイトカイン放出症候群の発現頻度は、1%であった。
各プロトコル
減量・休薬・中止基準
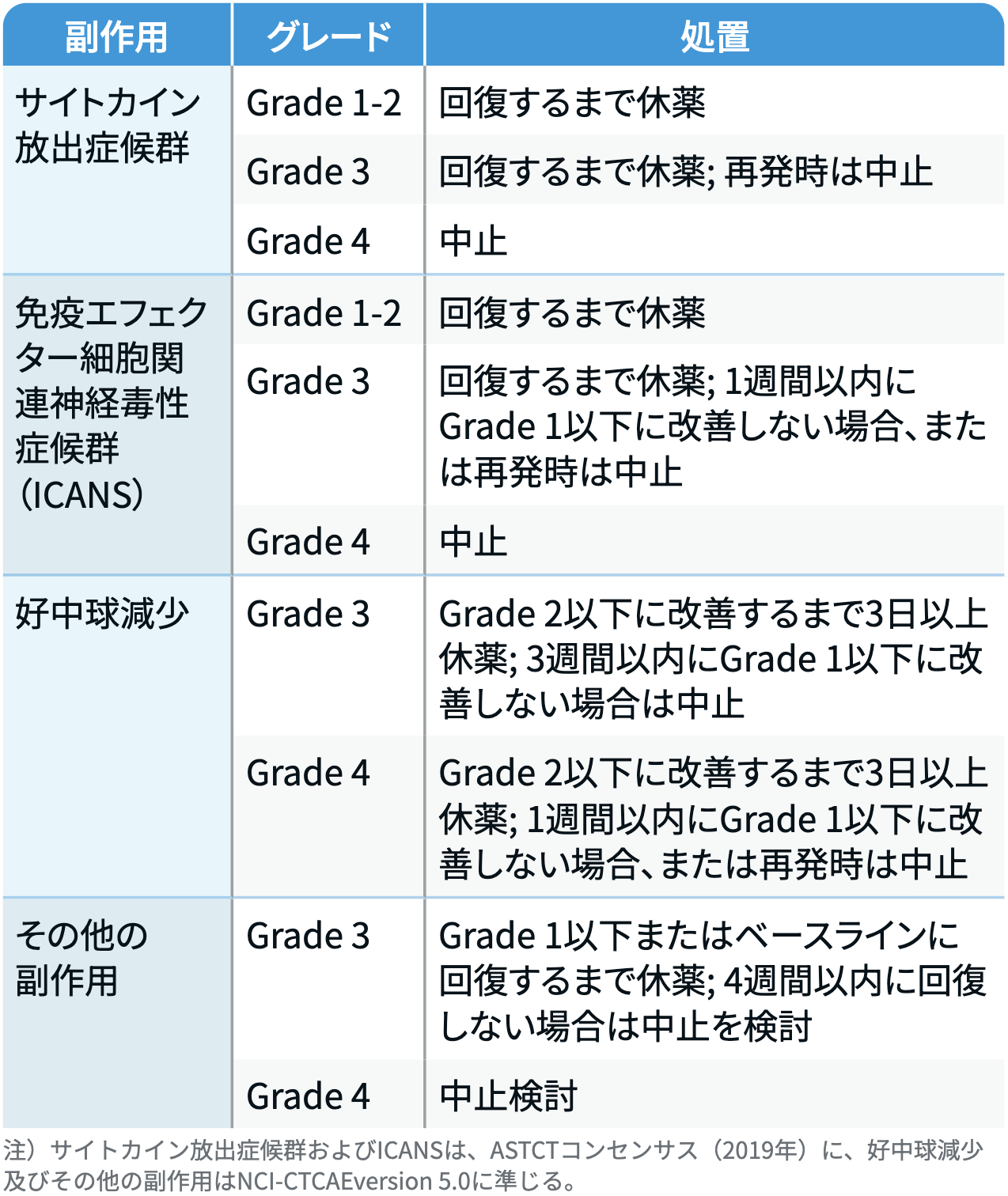
イムデトラ®点滴静注 添付文書¹⁾より引用
休薬後の再開用量
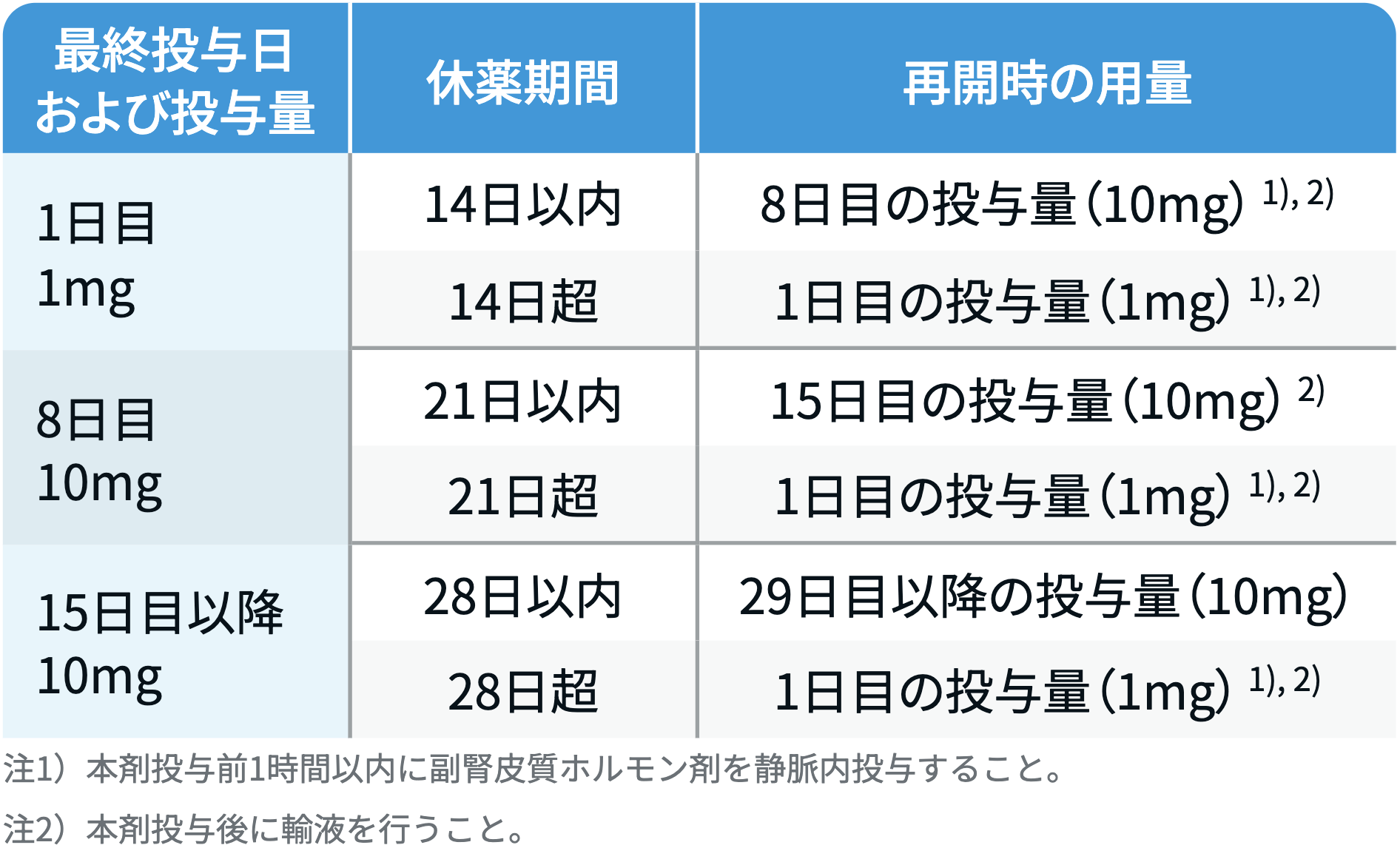
イムデトラ®点滴静注 添付文書¹⁾より引用
特徴と注意点
作用機序について
SCLC患者の約85~96%の腫瘍細胞表面に発現しているとされるデルタ様リガンド3 (DLL3) と、 免疫系のT細胞の表面に発現するCD3の両方に結合するよう設計された二重特異性抗体である(BiTE®)。 T細胞とSCLC細胞との間に複合体を形成し、 これによりT細胞を活性化させて腫瘍細胞を溶解させる。
副作用について (ICANS、 CRS)
初回投与後および増量時に、 免疫エフェクター細胞関連神経毒性症候群 (ICANS) や サイトカイン放出症候群 (CRS) などの免疫関連AEが高頻度に出現するため、 最適使用推進ガイドライン等を参考に『厳密な副作用モニタリングと管理が可能な環境』で行うという点が非常に重要。
CRSは投与後1ヵ月以内がほとんどである。 投与中止にならないよう、 早期の介入が必要。
参考: ICANS重症度判定基準 >>計算する
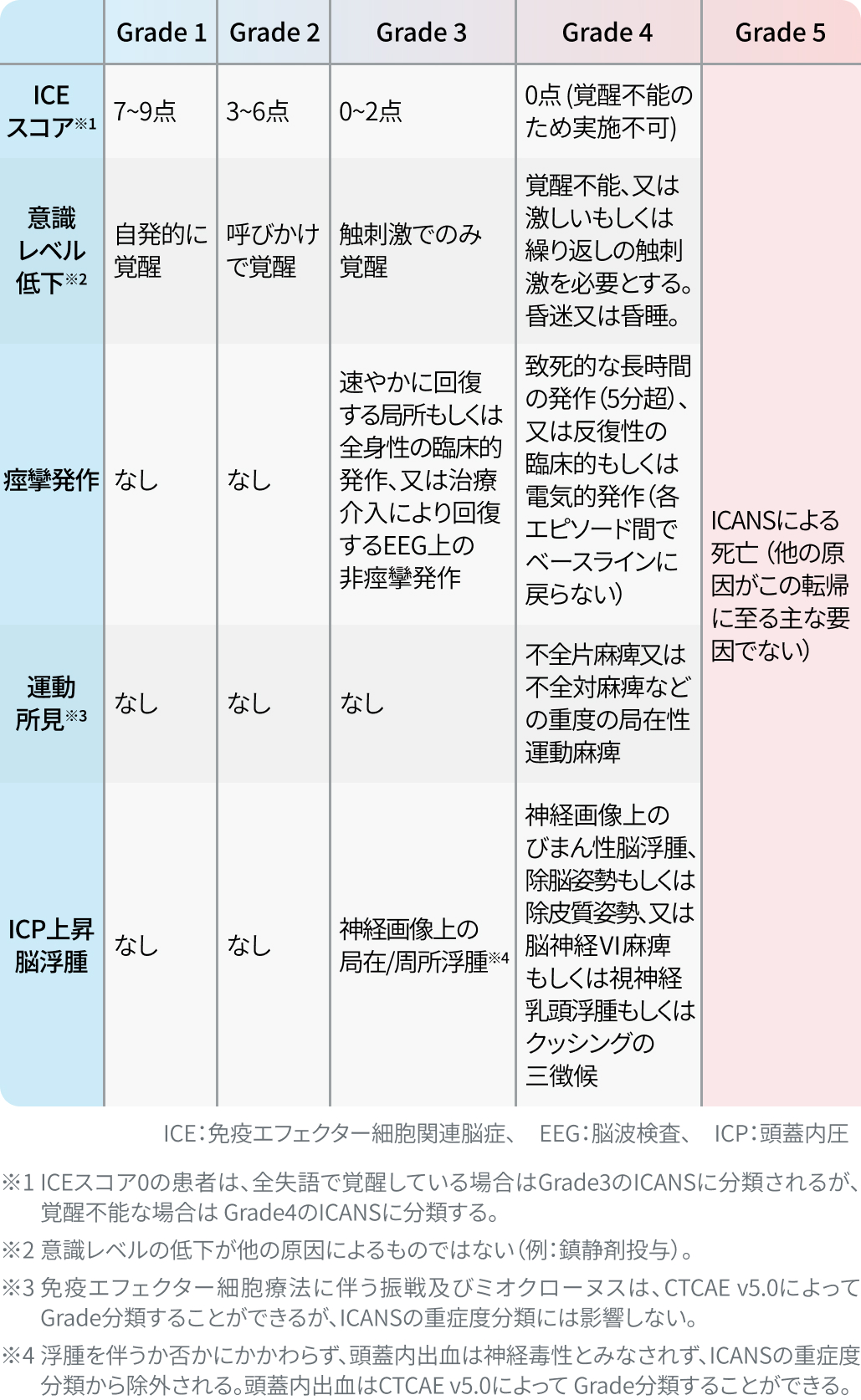
参考: ICEスコア >>計算する

Biol Blood Marrow Transplant. 2019 ;25(4):625-38.より引用
本邦での申請状況について
タルラタマブは、 2024年2月9日付で厚生労働省より希少疾病用医薬品の指定を受け、 2024年5月15日に進行・再発の進展型SCLCを対象に承認申請され、 2024年12月27日正式承認となった。
肺癌診療ガイドライン2025の推奨⁵⁾
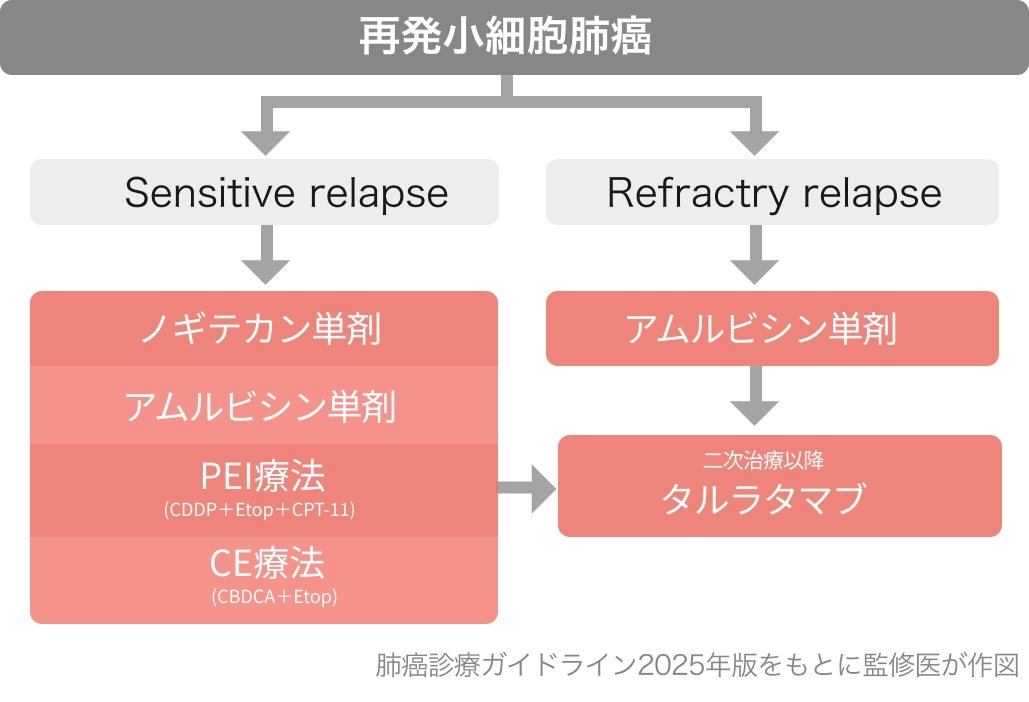
DeLLphi-304試験³⁾, DeLLphi-301試験⁴⁾の結果をもとに、 全身状態良好 PS (0-1) の再発小細胞肺癌に対して、 2次治療以降に行うよう強く推奨されている [1B]。
*「sensitive relapse」は初回薬物療法が奏効し、 かつ初回治療終了後から再発までの期間が長い場合 (60~90日以上が多い)、「refractory relapse」はそれ以外の場合と定義されることが多い。 前者の方が、 再発時の薬物療法の効果が高い。
イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)では、2次治療の推奨についての記載はない点に注意
出典
1) アムジェン株式会社. イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)
2) アムジェン株式会社. イムデトラ点滴静注用 適正使用ガイド (2025年4月作成)
4) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月28日
監修医師 : HOKUTO編集部監修医師
Tarlatamab
進行・再発の進展型SCLCを対象に2024年12月27日正式承認、 2025年4月16日薬価収載 (10mg 132万6,870円/1日 9万4,776円)
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
イムデトラ®点滴静注 (タルラタマブ)
DLL3・CD3二重特異性T細胞誘導抗体 タルラタマブ
*アムジェン株式会社の外部サイトへ遷移します
投与スケジュール
添付文書¹⁾、 DeLLphi-301/304試験³⁾⁴⁾

1サイクル28日間で、 1サイクル目のDay1に1mgを、 その後Day8とDay15に10mgを、 2サイクル目以降は病勢進行または許容できない毒性が認められるまで2週間ごと (Day1とDay15) に1時間かけて静脈投与する
添付文書¹⁾、 DeLLphi-301/304試験³⁾⁴⁾より引用
KeyData|臨床試験結果
3次治療を対象とした第2相DeLLphi-301試験の結果に基づく正式承認。 その後、2次治療を対象とした第3相DeLLphi‑304試験の結果も報告され、 ガイドライン2025年で推奨変更となった*。
*イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)では、2次治療の推奨についての記載はない点に注意
DeLLphi-304試験³⁾|2次治療
N Engl J Med. 2025;393(4):349-61.
第3相無作為化オープンラベル試験。 プラチナ製剤併用療法 (±抗PD-L1抗体) 後に病勢進行した進展型SCLCを対象に、 タルラタマブ10mg を2週間毎に投与群 254例と医師選択化学療法群 [トポテカン、 ルルビネクテジン、 アムルビシン] 255例を比較した。 主要評価項目は全生存期間 (OS)であった。
有効性 vs医師選択化学療法
- mOS : 13.6ヵ月 vs 8.3ヵ月
HR 0.60 (95%CI 0.47–0.77)
- mPFS : 4.2ヵ月 vs 3.2–3.7ヵ月
HR 0.72 (95%CI 0.59–0.88)
- ORR : 35% vs 20%
- mDOR : 6.9ヵ月 vs 5.5ヵ月
- 12ヵ月DOR率 41% vs 13%
安全性 特に頻度が高かった有害事象
- CRS : 50–60% (大部分Grade 1–2で3は1%)
- ICANS : 低頻度・主にGrade 1–2
- グレード3以上のTRAEs : 27% vs 62%
- AEによる中止 : 3–5% vs 12%
- グレード3以上の全TEAE : 54% vs 80%
*イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)では、2次治療の推奨についての記載はない点に注意
DeLLphi-301試験⁴⁾|3次治療
N Engl J Med. 2023;389(22):2063-75.
第2相非盲検多施設共同多コホート試験。 プラチナ製剤併用療法を含む2レジメン以上の治療歴があるSCLCを対象にタルラタマブ10mgを2週ごとに投与した99例の結果詳細は、 2023年10月に開催されたESMOで発表され、 同時にNEJM誌に掲載された。 主要有効性評価項目は、 RECIST 1.1に基づく全奏効率 (ORR) と、 盲検独立中央判定による奏効期間 (DOR) であった。
有効性
- ORR : 40% (95%CI 31~51%)
- mDOR : 9.7ヵ月 (95%CI 2.7~20.7ヵ月超)
- mOS : 14.3ヵ月
安全性|特に頻度が高かった有害事象
- CRS : 51%*
- 食欲不振 : 29%
- 発熱 : 35%
*主に初回投与後に生じ、 大部分がGrade1-2であった。 Grade 3 のサイトカイン放出症候群の発現頻度は、1%であった。
各プロトコル
減量・休薬・中止基準

イムデトラ®点滴静注 添付文書¹⁾より引用
休薬後の再開用量

イムデトラ®点滴静注 添付文書¹⁾より引用
特徴と注意点
作用機序について
SCLC患者の約85~96%の腫瘍細胞表面に発現しているとされるデルタ様リガンド3 (DLL3) と、 免疫系のT細胞の表面に発現するCD3の両方に結合するよう設計された二重特異性抗体である(BiTE®)。 T細胞とSCLC細胞との間に複合体を形成し、 これによりT細胞を活性化させて腫瘍細胞を溶解させる。
副作用について (ICANS、 CRS)
初回投与後および増量時に、 免疫エフェクター細胞関連神経毒性症候群 (ICANS) や サイトカイン放出症候群 (CRS) などの免疫関連AEが高頻度に出現するため、 最適使用推進ガイドライン等を参考に『厳密な副作用モニタリングと管理が可能な環境』で行うという点が非常に重要。
CRSは投与後1ヵ月以内がほとんどである。 投与中止にならないよう、 早期の介入が必要。
参考: ICANS重症度判定基準 >>計算する

参考: ICEスコア >>計算する

Biol Blood Marrow Transplant. 2019 ;25(4):625-38.より引用
本邦での申請状況について
タルラタマブは、 2024年2月9日付で厚生労働省より希少疾病用医薬品の指定を受け、 2024年5月15日に進行・再発の進展型SCLCを対象に承認申請され、 2024年12月27日正式承認となった。
肺癌診療ガイドライン2025の推奨⁵⁾

DeLLphi-304試験³⁾, DeLLphi-301試験⁴⁾の結果をもとに、 全身状態良好 PS (0-1) の再発小細胞肺癌に対して、 2次治療以降に行うよう強く推奨されている [1B]。
*「sensitive relapse」は初回薬物療法が奏効し、 かつ初回治療終了後から再発までの期間が長い場合 (60~90日以上が多い)、「refractory relapse」はそれ以外の場合と定義されることが多い。 前者の方が、 再発時の薬物療法の効果が高い。
イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)では、2次治療の推奨についての記載はない点に注意
出典
1) アムジェン株式会社. イムデトラ点滴静注用 添付文書 (2025年9月改訂 第4版)
2) アムジェン株式会社. イムデトラ点滴静注用 適正使用ガイド (2025年4月作成)
4) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月28日
監修医師 : HOKUTO編集部監修医師
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。