本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ユーエフティ® (テガフール・ウラシルカプセル)
*大鵬薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与 (1~2年間内服²⁾)
【催吐性】 軽度催吐性
【FN発症】低リスク*
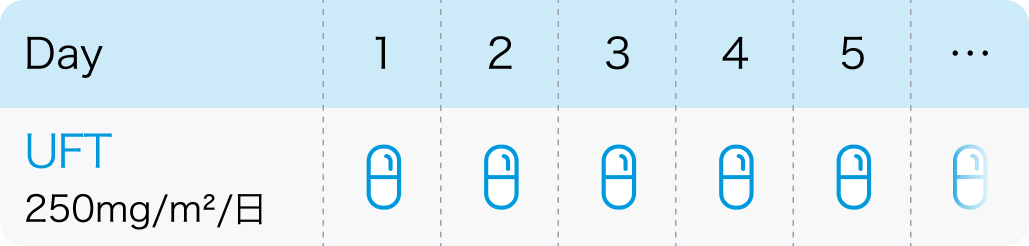
肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版 非小細胞肺癌の周術期薬物療法 を基に作図
*ピボタル試験¹⁾では報告されていないため低リスクとした。
KeyData|臨床試験結果
📊 国内第III相試験¹⁾
完全切除された病理病期I期 (T1-2N0M0)*の肺腺癌患者**を対象に、 経過観察に対するテガフール・ウラシル (UFT) 経口投与2年間の有効性・安全性を検証した無作為化第Ⅲ相比較試験 (各群約490例)
*本試験はTNM分類第6版以前に実施されたものであり、 腫瘍径によるT分類はT1 (3 cm未満) およびT2 (3 cm以上) のみで区分されていた点に留意が必要である。
**主な適格基準 : 45-75歳、 PS0-2など。
【有効性】UFT療法群の結果
- 服薬遵守率は、 1年時点で74%、 2年時点で61%であった。
- 5年OS率は88%であり、 観察群に対し3%の上乗せ効果を示した。
- 腫瘍径別の5年OS率は、 IA期 (T≦3cm) では上乗せ効果は確認されず (89% vs 90%)、 一方、 IB期 (T>3cm) では11%の上乗せ効果が認められた (85% vs 74%)。
【安全性】主な有害事象 (括弧内はGrade 3~4)
- 白血球数減少 3% (0%)
- 血小板減少 <1% (0%)
- 貧血 <2% (0%)
- ビリルビン上昇 <2% (0%)
- AST上昇 <9% (<1%)
- ALT上昇 8% (0%)
- ALP上昇 <3% (0%)
- 食欲不振 18% (1%)
- 悪心嘔吐 14% (1%)
- 下痢 <4% (<1%)
- 脱毛 <1%
副作用発現時の用量調節基準
本試験では、 重症度評価にCTCAEではなくWHO重症度分類が用いられている点に留意が必要である。
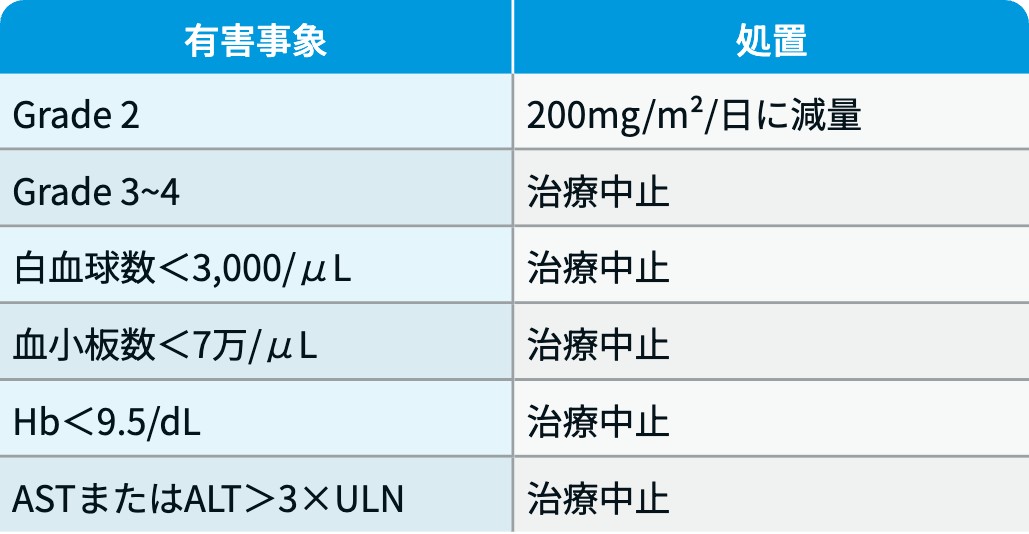
国内第III相試験²⁾のプロトコルより引用
特徴と注意点
UFT療法の有効性は、 主に肺腺癌において示されている。 非腺癌では検討症例が限られており、 薬物療法の安全性を十分に考慮したうえで、 慎重に適用する必要がある²⁾。
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引きやHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
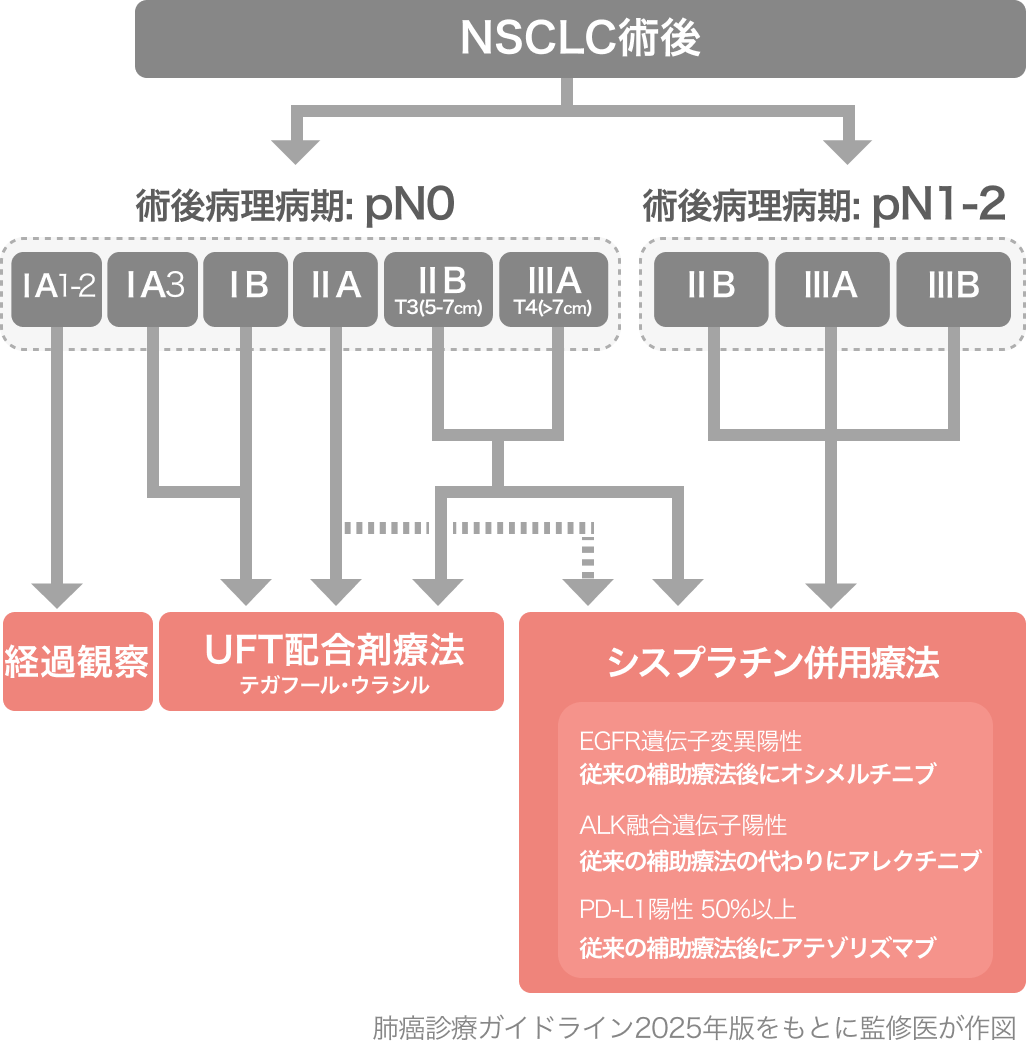
肺癌診療ガイドライン2025の記載²⁾
病変全体径>2cmの術後病理病期ⅠA3-ⅢA期 (N0)(第9版)* 完全切除、 腺癌症例に対して、 テガフール・ウラシル配合剤療法を行うよう強く推奨する。 [1A]
*T3 (invasion satellite or nodule) とT4 (invasion or ipsilateral lung nodules) は除く。
肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版 非小細胞肺癌の周術期薬物療法より引用
病変全体径>2cmの術後病理病期ⅠA3-ⅢA期 (N0)(第9版)* 完全切除、 非腺癌症例に対してテガフール・ウラシル配合剤療法を行うよう弱く推奨する。 [2C]
*T3 (invasion satellite or nodule) とT4 (invasion or ipsilateral lung nodules) は除く。
肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版 非小細胞肺癌の周術期薬物療法より引用
出典
- A randomized trial of adjuvant chemotherapy with uracil-tegafur for adenocarcinoma of the lung. N Engl J Med. 2004;350(17):1713-21. PMID: 15102997
- 肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版
最終更新日 : 2026年3月3日
HOKUTO編集部医師監修
UFT
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
ユーエフティ® (テガフール・ウラシルカプセル)
*大鵬薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
【1コース】連日内服投与 (1~2年間内服²⁾)
【催吐性】 軽度催吐性
【FN発症】低リスク*

肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版 非小細胞肺癌の周術期薬物療法 を基に作図
*ピボタル試験¹⁾では報告されていないため低リスクとした。
KeyData|臨床試験結果
📊 国内第III相試験¹⁾
完全切除された病理病期I期 (T1-2N0M0)*の肺腺癌患者**を対象に、 経過観察に対するテガフール・ウラシル (UFT) 経口投与2年間の有効性・安全性を検証した無作為化第Ⅲ相比較試験 (各群約490例)
*本試験はTNM分類第6版以前に実施されたものであり、 腫瘍径によるT分類はT1 (3 cm未満) およびT2 (3 cm以上) のみで区分されていた点に留意が必要である。
**主な適格基準 : 45-75歳、 PS0-2など。
【有効性】UFT療法群の結果
- 服薬遵守率は、 1年時点で74%、 2年時点で61%であった。
- 5年OS率は88%であり、 観察群に対し3%の上乗せ効果を示した。
- 腫瘍径別の5年OS率は、 IA期 (T≦3cm) では上乗せ効果は確認されず (89% vs 90%)、 一方、 IB期 (T>3cm) では11%の上乗せ効果が認められた (85% vs 74%)。
【安全性】主な有害事象 (括弧内はGrade 3~4)
- 白血球数減少 3% (0%)
- 血小板減少 <1% (0%)
- 貧血 <2% (0%)
- ビリルビン上昇 <2% (0%)
- AST上昇 <9% (<1%)
- ALT上昇 8% (0%)
- ALP上昇 <3% (0%)
- 食欲不振 18% (1%)
- 悪心嘔吐 14% (1%)
- 下痢 <4% (<1%)
- 脱毛 <1%
副作用発現時の用量調節基準
本試験では、 重症度評価にCTCAEではなくWHO重症度分類が用いられている点に留意が必要である。

国内第III相試験²⁾のプロトコルより引用
特徴と注意点
UFT療法の有効性は、 主に肺腺癌において示されている。 非腺癌では検討症例が限られており、 薬物療法の安全性を十分に考慮したうえで、 慎重に適用する必要がある²⁾。
遺伝子パネル検査・コンパニオン診断
日本肺癌学会の各種手引きやHOKUTO編集部のまとめコンテンツを参照ください。
肺癌遺伝子パネル検査・コンパニオン診断薬一覧ページへ遷移
肺癌診療ガイドライン2025の記載²⁾
病変全体径>2cmの術後病理病期ⅠA3-ⅢA期 (N0)(第9版)* 完全切除、 腺癌症例に対して、 テガフール・ウラシル配合剤療法を行うよう強く推奨する。 [1A]
*T3 (invasion satellite or nodule) とT4 (invasion or ipsilateral lung nodules) は除く。
肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版 非小細胞肺癌の周術期薬物療法より引用
病変全体径>2cmの術後病理病期ⅠA3-ⅢA期 (N0)(第9版)* 完全切除、 非腺癌症例に対してテガフール・ウラシル配合剤療法を行うよう弱く推奨する。 [2C]
*T3 (invasion satellite or nodule) とT4 (invasion or ipsilateral lung nodules) は除く。
肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版 非小細胞肺癌の周術期薬物療法より引用

出典
- A randomized trial of adjuvant chemotherapy with uracil-tegafur for adenocarcinoma of the lung. N Engl J Med. 2004;350(17):1713-21. PMID: 15102997
- 肺癌診療ガイドライン-胸膜中皮腫・胸腺腫瘍含む- 2025年版
最終更新日 : 2026年3月3日
HOKUTO編集部医師監修
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。