2024年3月27日に他の抗悪性腫瘍剤との併用において「非小細胞肺癌における術前補助療法」に新たに適応が追加された
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
オプジーボ®点滴静注 (ニボルマブ)
抗PD-1抗体 ニボルマブ注射液
*小野薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
非小細胞肺癌における術前補助療法
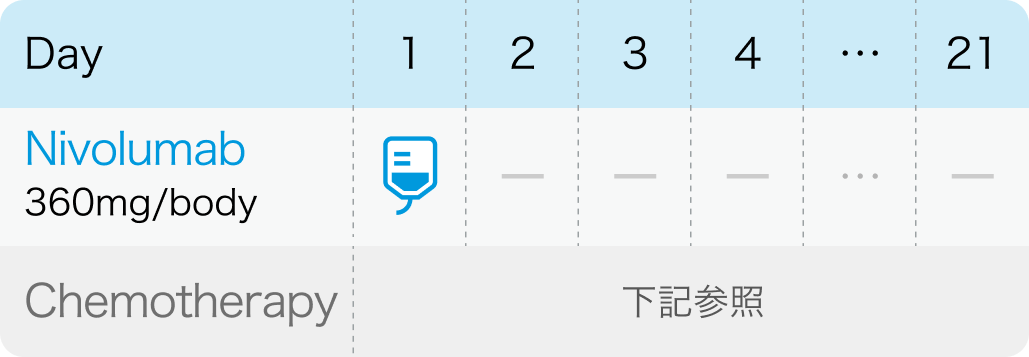
他の抗悪性腫瘍剤との併用において、 通常、 成人にはニボルマブ1回360mgを3週間間隔で点滴静注する。 ただし、 投与回数は3回までとする。
オプジーボ®電子添文¹⁾より引用
扁平上皮癌における併用化学療法 (いずれか)
Nivolumab+GEM+CDDP療法
ゲムシタビン1,000または1,250mg/m²をDay1、8に、 シスプラチン75mg/m²をDay1に3週間間隔で最大3回点滴静注
Nivolumab+PTX+CBDCA療法
パクリタキセル175または200mg/m²、 カルボプラチンAUC5または6をDay1に3週間間隔で最大3回点滴静注
非扁平上皮癌における併用化学療法 (いずれか)
Nivolumab+PEM+CDDP療法
ペメトレキセド500mg/m²、シスプラチン75mg/m²をDay1に3週間間隔で最大3回点滴静注
Nivolumab+PTX+CBDCA療法
パクリタキセル175または200mg/m²、 カルボプラチンAUC5または6をDay1に3週間間隔で最大3回点滴静注
なお、 シスプラチンに対する忍容性がないと判断された場合には、 シスプラチンをカルボプラチン1回AUC5若しくは6 (mg/mL・min) に変更可能とされた。
併用投与時においては、 本剤を最初に投与し、 化学療法は本剤の投与終了から約30分の間隔をおいて投与を開始した。
KeyData|臨床試験結果
📊CheckMate816試験³⁾⁴⁾
既知のEGFR遺伝子変異*/ALK融合遺伝子を認めない臨床病期IB (≧4cm)、 II又はIIIAのNSCLC術前患者358例 (日本人患者68例を含む) を対象に、 化学療法を対照として、 Nivo+化学療法併用の有効性及び安全性を検討した国際共同第III相試験 (Nivo+化学療法併用群179例、 化学療法群179例)
EGFR遺伝子変異検査は、当初登録において必須ではなかったが、 陰性確認が望ましいとされた
【有効性結果】mEFS (主要評価項目)
- Nivo+化学療法併用群 : 31.57ヵ月
- 化学療法群 : 20.80ヵ月
HR 0.63 (97.38%CI 0.43~0.91)、 p=0.0052
サブ解析① 臨床病期によりEFSリスク軽減の程度が異なる
- ⅠB-Ⅱ期 (第7版) : HR 0.87 (95%CI 0.48-1.56)
- ⅢA期 (第7版) : HR 0.54 (95%CI 0.37-0.80)
サブ解析② PD-L1高発現の方がEFSリスク軽減が得られた
- PD-L1<1% : HR 0.85 (95%CI 0.54-1.32)
- PD-L1 1~49% : HR 0.58 (95%CI 0.30-1.12)
- PD-L1 ≧50% : HR 0.24 (95%CI 0.10-0.61)
【有効性結果】pCR (主要評価項目)
- Nivo+化学療法併用群 : 24.0%
- 化学療法群 : 2.2%
HR 13.9 (97.38%CI 3.5-55.8)、 p<0.001
【有効性結果】OSの更新された報告⁴⁾
Nivo+化学療法併用群で延長する傾向
HR 0.71, 98.36%CI 0.47-1.07
【安全性結果】主な副作用
評価対象176例中147例 (83.5%) に副作用あり
- 悪心58例 (33.0%)
- 貧血41例 (23.3%)
- 便秘37例 (21.0%)
- 食欲減退30例 (17.0%)
- 好中球減少症30例 (17.0%)
- 好中球数減少26例 (14.8%)
- 倦怠感25例 (14.2%)
- 発疹23例 (13.1%)
- 疲労22例 (12.5%)
レジメンの特徴と注意点
KEYNOTE-671試験との違い
術前補助療法のみの使用 かつ3コースである点が、 KEYNOTE-671試験の術前・術後ペムブロリズマブと異なる (術前の併用療法 : 最大4コース → 術後の単剤投与 : 9ヵ月)
肺癌診療ガイドライン 2025⁵⁾
CheckMate816試験³⁾の結果を基に、 2025年版より以下の推奨となっている。
臨床病期Ⅱ-ⅢB期 (第9版)*、 EGFR遺伝子変異/ALK融合遺伝子陰性もしくは不明例に対して,術前にプラチナ製剤併用療法とニボルマブを併用した治療を行うよう弱く推奨する。 [2B]
*T4 (invasion or ipsilateral lung nodules) N2M0/ⅢB期,N3は除く 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版より引用
出典
1) 小野薬品工業株式会社. オプジーボ®電子添文 (2025年9月改訂 第26版) [最終閲覧 : 2025/11/14]
2) 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2025年8月) [最終閲覧 : 2025/11/14]
5) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月14日
監修 : HOKUTO編集部監修医
Nivolumab + chemotherapy
2024年3月27日に他の抗悪性腫瘍剤との併用において「非小細胞肺癌における術前補助療法」に新たに適応が追加された
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
オプジーボ®点滴静注 (ニボルマブ)
抗PD-1抗体 ニボルマブ注射液
*小野薬品工業株式会社の外部サイトへ遷移します
投与スケジュール
非小細胞肺癌における術前補助療法

他の抗悪性腫瘍剤との併用において、 通常、 成人にはニボルマブ1回360mgを3週間間隔で点滴静注する。 ただし、 投与回数は3回までとする。
オプジーボ®電子添文¹⁾より引用
扁平上皮癌における併用化学療法 (いずれか)
Nivolumab+GEM+CDDP療法
ゲムシタビン1,000または1,250mg/m²をDay1、8に、 シスプラチン75mg/m²をDay1に3週間間隔で最大3回点滴静注
Nivolumab+PTX+CBDCA療法
パクリタキセル175または200mg/m²、 カルボプラチンAUC5または6をDay1に3週間間隔で最大3回点滴静注
非扁平上皮癌における併用化学療法 (いずれか)
Nivolumab+PEM+CDDP療法
ペメトレキセド500mg/m²、シスプラチン75mg/m²をDay1に3週間間隔で最大3回点滴静注
Nivolumab+PTX+CBDCA療法
パクリタキセル175または200mg/m²、 カルボプラチンAUC5または6をDay1に3週間間隔で最大3回点滴静注
なお、 シスプラチンに対する忍容性がないと判断された場合には、 シスプラチンをカルボプラチン1回AUC5若しくは6 (mg/mL・min) に変更可能とされた。
併用投与時においては、 本剤を最初に投与し、 化学療法は本剤の投与終了から約30分の間隔をおいて投与を開始した。
KeyData|臨床試験結果
📊CheckMate816試験³⁾⁴⁾
既知のEGFR遺伝子変異*/ALK融合遺伝子を認めない臨床病期IB (≧4cm)、 II又はIIIAのNSCLC術前患者358例 (日本人患者68例を含む) を対象に、 化学療法を対照として、 Nivo+化学療法併用の有効性及び安全性を検討した国際共同第III相試験 (Nivo+化学療法併用群179例、 化学療法群179例)
EGFR遺伝子変異検査は、当初登録において必須ではなかったが、 陰性確認が望ましいとされた
【有効性結果】mEFS (主要評価項目)
- Nivo+化学療法併用群 : 31.57ヵ月
- 化学療法群 : 20.80ヵ月
HR 0.63 (97.38%CI 0.43~0.91)、 p=0.0052
サブ解析① 臨床病期によりEFSリスク軽減の程度が異なる
- ⅠB-Ⅱ期 (第7版) : HR 0.87 (95%CI 0.48-1.56)
- ⅢA期 (第7版) : HR 0.54 (95%CI 0.37-0.80)
サブ解析② PD-L1高発現の方がEFSリスク軽減が得られた
- PD-L1<1% : HR 0.85 (95%CI 0.54-1.32)
- PD-L1 1~49% : HR 0.58 (95%CI 0.30-1.12)
- PD-L1 ≧50% : HR 0.24 (95%CI 0.10-0.61)
【有効性結果】pCR (主要評価項目)
- Nivo+化学療法併用群 : 24.0%
- 化学療法群 : 2.2%
HR 13.9 (97.38%CI 3.5-55.8)、 p<0.001
【有効性結果】OSの更新された報告⁴⁾
Nivo+化学療法併用群で延長する傾向
HR 0.71, 98.36%CI 0.47-1.07
【安全性結果】主な副作用
評価対象176例中147例 (83.5%) に副作用あり
- 悪心58例 (33.0%)
- 貧血41例 (23.3%)
- 便秘37例 (21.0%)
- 食欲減退30例 (17.0%)
- 好中球減少症30例 (17.0%)
- 好中球数減少26例 (14.8%)
- 倦怠感25例 (14.2%)
- 発疹23例 (13.1%)
- 疲労22例 (12.5%)
レジメンの特徴と注意点
KEYNOTE-671試験との違い
術前補助療法のみの使用 かつ3コースである点が、 KEYNOTE-671試験の術前・術後ペムブロリズマブと異なる (術前の併用療法 : 最大4コース → 術後の単剤投与 : 9ヵ月)
肺癌診療ガイドライン 2025⁵⁾
CheckMate816試験³⁾の結果を基に、 2025年版より以下の推奨となっている。
臨床病期Ⅱ-ⅢB期 (第9版)*、 EGFR遺伝子変異/ALK融合遺伝子陰性もしくは不明例に対して,術前にプラチナ製剤併用療法とニボルマブを併用した治療を行うよう弱く推奨する。 [2B]
*T4 (invasion or ipsilateral lung nodules) N2M0/ⅢB期,N3は除く 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版より引用
出典
1) 小野薬品工業株式会社. オプジーボ®電子添文 (2025年9月改訂 第26版) [最終閲覧 : 2025/11/14]
2) 小野薬品工業株式会社. オプジーボ®適正使用ガイド (2025年8月) [最終閲覧 : 2025/11/14]
5) 日本肺癌学会. 肺癌診療ガイドライン-胸膜中皮腫・ 胸腺腫瘍含む-2025年版
最終更新日 : 2025年11月14日
監修 : HOKUTO編集部監修医
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。