治療スケジュール
概要
監修医師
Quizartinib:キザルチニブ(ヴァンフリタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 35.4mg 経口 | 地固め療法 | day 6-19 |
AraC:シタラビン(キロサイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 3,000mg/m²/回×2 | 地固め療法 | day 1、3、5 |
| <60歳以上の場合>1,500mg/m²/回×2 | 地固め療法 | day 1、3、5 |
Quizartinib:キザルチニブ(ヴァンフリタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 26.5mg 経口 | 維持療法 | day 1-14 |
| 53mg 経口 | 維持療法 | day 15- |
その他
| 地固め療法は最大4コースまで |
| 地固め療法としてシタラビンとの併用においてキザルチニブとして1日1回35.4mgを2週間経口投与 |
| 維持療法はキザルチニブとして1日1回26.5mgを2週間経口投与したのち1日1回53mgを経口投与 |
| QTcF値が450msecを超えている場合はキザルチニブの投与を開始しない |
| 維持療法期にキザルチニブ投与開始から2週間後にQTcF値が450msecを超えた場合はキザルチニブの増量は行わない |
| 維持療法としてキザルチニブを3年を超えて投与した場合の有効性及び安全性は確立していない |
| 強いCYP3A4阻害薬と併用する場合は減量基準を参考にキザルチニブを減量する |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
QuANTUM-First試験¹⁾より引用
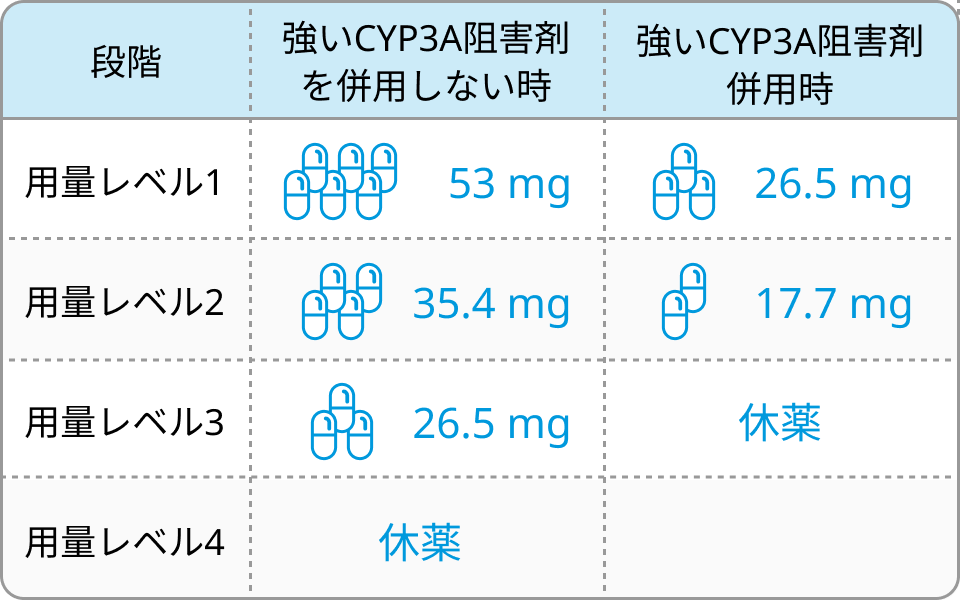
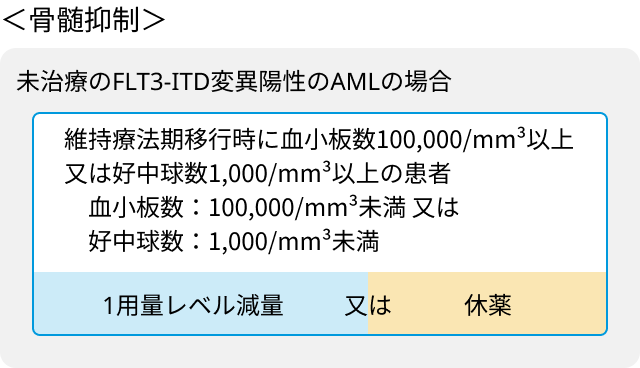
骨髄抑制
- 発熱性好中球減少症 (44%、 ≧Grade3 43%)
- 好中球減少 (20%、 ≧Grade3 18%)
- 血小板減少 (11%、 ≧Grade3 8%)
- 貧血 (11%、 ≧Grade3 6%)
主な有害事象
- 食欲不振 (42%、 ≧Grade3 5%)
- 下痢 (37%、 ≧Grade3 4%)
- 低カリウム血症 (35%、 ≧Grade3 19%)
- 嘔気 (34%、 ≧Grade3 2%)
- 頭痛 (28%、 ≧Grade3 0%)
- 皮疹 (26%、 ≧Grade3 3%)
- 嘔吐 (25%、 ≧Grade3 0%)
- 口内炎 (22%、 ≧Grade3 5%)
- 便秘 (21%、 ≧Grade3 <1%)
その他重要な有害事象
- QT延長 (14%、 ≧Grade3 3%)
特徴と注意点 作成中
- コンパニオン診断薬である「リューコストラットCDx FLT3変異検査」により、FLT3-ITD変異が確認された患者に投与する.
- コンパニオン診断薬に関する情報は、「医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報」²⁾ を参照する.
- キザルチニブは受容体型チロシンキナーゼであるFLT3に対する阻害作用を有する低分子化合物である. ITD変異を有するFLT3に結合し、 FLT3を介したシグナル伝達を阻害することにより、 FLT3-ITD変異を有する腫瘍の増殖を抑制すると考えられている.
- 強力な寛解導入療法の適応とならない未治療のFLT3-ITD変異陽性の急性骨髄性白血病におけるキザルチニブの有効性及び安全性は確立していない.
- 心電図検査および電解質検査を行う.
- 強いCYP阻害剤併用時は減量・休薬基準に従い減量する.
- QT延長を参照する.
- キザルチニブ投与中は週1回を目安に必要に応じて心電図検査を実施する.
- QT間隔はFridericia補正式を用いたQTcF値を用いる.
- QTcF間隔延長時は減量・休薬基準を参考.
- 電解質異常がある場合は補正を行う.
減量・休薬基準
減量段階
※地固め療法では「用量レベル1は使用しない」ことに留意.
QT延長による減量・休薬基準

非血液毒性による減量・休薬基準

骨髄抑制による減量・休薬基準 (維持療法移行時)
関連する臨床試験の結果
QuANTUM-First試験¹⁾
概要
- 国際共同ランダム化二重盲検第III相試験
- 対象:未治療の FLT3-ITD変異陽性のAML患者539例
- 介入群:寛解導入療法+キザルチニブ35.4mg (day8-21)→地固め療法+キザルチニブ35.4mg (day6-19) 及び/又は 同種造血幹細胞移植→維持療法 (キザルチニブ26.5mg 2週間服用後 53mg)
- 対照群:寛解導入療法+プラセボ→地固め療法+プラセボ 及び/又は 同種造血幹細胞移植→維持療法 (プラセボ)
※寛解導入療法 = AraC100mg/m²/day又は*200mg/m²/day 7日間持続点滴+DNR*60mg/m²/day又はIDA12mg/m²/day 3日間. *本邦で一般に用いられる用法用量と異なる.
※地固め療法 = AraC*3,000mg/m² 12時間ごと計6回、 1、 3、 5日目. *60歳以上の場合はAraC1,500mg/m²に減量.
- 寛解導入療法は1コース28日間、 血球回復までの期間を考慮し最大28日間とし、 非寛解の場合は2コースまで施行可.
- 地固め療法は1コース28日間、 血球回復までの期間を考慮し最大28日間とし、 最大4コースまで施行.
- 維持療法はキザルチニブ26.5mgを2週間服用後、 QTcF値<450msecの場合、 53mgを最大36コースまで施行.
結果
- 追跡期間中央値:39.2ヵ月.
- OS中央値:介入群 31.9ヵ月 (21.0-NE) vs 対象群 15.1ヵ月 (13.2-26.2)、 HR 0.78 (95%CI 0.62-0.97)、 p=0.032.
- Relapse-free survival中央値:介入群 39.3ヵ月 (39.9-NE) vs 対象群 13.6ヵ月 (9.7-23.7) 、 HR 0.61 (95%CI 0.44-0.85).
- CR率:介入群 54.9% (95%CI 48.7-60.9) vs 対象群 55.4% (95%CI 49.2-61.4).
- CRi率:介入群 16.8% (95%CI 12.5-21.8) vs 対象群 9.6% (95%CI 6.4-13.7).
OS:Overal survival、 HR:Hazard ratio、 NE:not estimable、 CR:Complete remission、 CRi:Complete remission with imcomplere neutrophil
参考文献
最終更新:2023年8月30日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
HDAC (high-dose AraC) + Quizartinib
大量シタラビン+キザルチニブ(FLT3-ITD変異陽性例) *維持療法含む
2023年10月29日更新
Quizartinib:キザルチニブ(ヴァンフリタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 35.4mg 経口 | 地固め療法 | day 6-19 |
AraC:シタラビン(キロサイド®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 3,000mg/m²/回×2 | 地固め療法 | day 1、3、5 |
| <60歳以上の場合>1,500mg/m²/回×2 | 地固め療法 | day 1、3、5 |
Quizartinib:キザルチニブ(ヴァンフリタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 26.5mg 経口 | 維持療法 | day 1-14 |
| 53mg 経口 | 維持療法 | day 15- |
その他
| 地固め療法は最大4コースまで |
| 地固め療法としてシタラビンとの併用においてキザルチニブとして1日1回35.4mgを2週間経口投与 |
| 維持療法はキザルチニブとして1日1回26.5mgを2週間経口投与したのち1日1回53mgを経口投与 |
| QTcF値が450msecを超えている場合はキザルチニブの投与を開始しない |
| 維持療法期にキザルチニブ投与開始から2週間後にQTcF値が450msecを超えた場合はキザルチニブの増量は行わない |
| 維持療法としてキザルチニブを3年を超えて投与した場合の有効性及び安全性は確立していない |
| 強いCYP3A4阻害薬と併用する場合は減量基準を参考にキザルチニブを減量する |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
QuANTUM-First試験¹⁾より引用
骨髄抑制
- 発熱性好中球減少症 (44%、 ≧Grade3 43%)
- 好中球減少 (20%、 ≧Grade3 18%)
- 血小板減少 (11%、 ≧Grade3 8%)
- 貧血 (11%、 ≧Grade3 6%)
主な有害事象
- 食欲不振 (42%、 ≧Grade3 5%)
- 下痢 (37%、 ≧Grade3 4%)
- 低カリウム血症 (35%、 ≧Grade3 19%)
- 嘔気 (34%、 ≧Grade3 2%)
- 頭痛 (28%、 ≧Grade3 0%)
- 皮疹 (26%、 ≧Grade3 3%)
- 嘔吐 (25%、 ≧Grade3 0%)
- 口内炎 (22%、 ≧Grade3 5%)
- 便秘 (21%、 ≧Grade3 <1%)
その他重要な有害事象
- QT延長 (14%、 ≧Grade3 3%)
特徴と注意点 作成中
- コンパニオン診断薬である「リューコストラットCDx FLT3変異検査」により、FLT3-ITD変異が確認された患者に投与する.
- コンパニオン診断薬に関する情報は、「医薬品医療機器総合機構 (PMDA)のコンパニオン診断薬等の情報」²⁾ を参照する.
- キザルチニブは受容体型チロシンキナーゼであるFLT3に対する阻害作用を有する低分子化合物である. ITD変異を有するFLT3に結合し、 FLT3を介したシグナル伝達を阻害することにより、 FLT3-ITD変異を有する腫瘍の増殖を抑制すると考えられている.
- 強力な寛解導入療法の適応とならない未治療のFLT3-ITD変異陽性の急性骨髄性白血病におけるキザルチニブの有効性及び安全性は確立していない.
- 心電図検査および電解質検査を行う.
- 強いCYP阻害剤併用時は減量・休薬基準に従い減量する.
- QT延長を参照する.
- キザルチニブ投与中は週1回を目安に必要に応じて心電図検査を実施する.
- QT間隔はFridericia補正式を用いたQTcF値を用いる.
- QTcF間隔延長時は減量・休薬基準を参考.
- 電解質異常がある場合は補正を行う.
減量・休薬基準
減量段階
※地固め療法では「用量レベル1は使用しない」ことに留意.

QT延長による減量・休薬基準

非血液毒性による減量・休薬基準

骨髄抑制による減量・休薬基準 (維持療法移行時)

関連する臨床試験の結果
QuANTUM-First試験¹⁾
概要
- 国際共同ランダム化二重盲検第III相試験
- 対象:未治療の FLT3-ITD変異陽性のAML患者539例
- 介入群:寛解導入療法+キザルチニブ35.4mg (day8-21)→地固め療法+キザルチニブ35.4mg (day6-19) 及び/又は 同種造血幹細胞移植→維持療法 (キザルチニブ26.5mg 2週間服用後 53mg)
- 対照群:寛解導入療法+プラセボ→地固め療法+プラセボ 及び/又は 同種造血幹細胞移植→維持療法 (プラセボ)
※寛解導入療法 = AraC100mg/m²/day又は*200mg/m²/day 7日間持続点滴+DNR*60mg/m²/day又はIDA12mg/m²/day 3日間. *本邦で一般に用いられる用法用量と異なる.
※地固め療法 = AraC*3,000mg/m² 12時間ごと計6回、 1、 3、 5日目. *60歳以上の場合はAraC1,500mg/m²に減量.
- 寛解導入療法は1コース28日間、 血球回復までの期間を考慮し最大28日間とし、 非寛解の場合は2コースまで施行可.
- 地固め療法は1コース28日間、 血球回復までの期間を考慮し最大28日間とし、 最大4コースまで施行.
- 維持療法はキザルチニブ26.5mgを2週間服用後、 QTcF値<450msecの場合、 53mgを最大36コースまで施行.
結果
- 追跡期間中央値:39.2ヵ月.
- OS中央値:介入群 31.9ヵ月 (21.0-NE) vs 対象群 15.1ヵ月 (13.2-26.2)、 HR 0.78 (95%CI 0.62-0.97)、 p=0.032.
- Relapse-free survival中央値:介入群 39.3ヵ月 (39.9-NE) vs 対象群 13.6ヵ月 (9.7-23.7) 、 HR 0.61 (95%CI 0.44-0.85).
- CR率:介入群 54.9% (95%CI 48.7-60.9) vs 対象群 55.4% (95%CI 49.2-61.4).
- CRi率:介入群 16.8% (95%CI 12.5-21.8) vs 対象群 9.6% (95%CI 6.4-13.7).
OS:Overal survival、 HR:Hazard ratio、 NE:not estimable、 CR:Complete remission、 CRi:Complete remission with imcomplere neutrophil
参考文献
最終更新:2023年8月30日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
