Epcoritamab:エプコリタマブ(エプキンリ®)
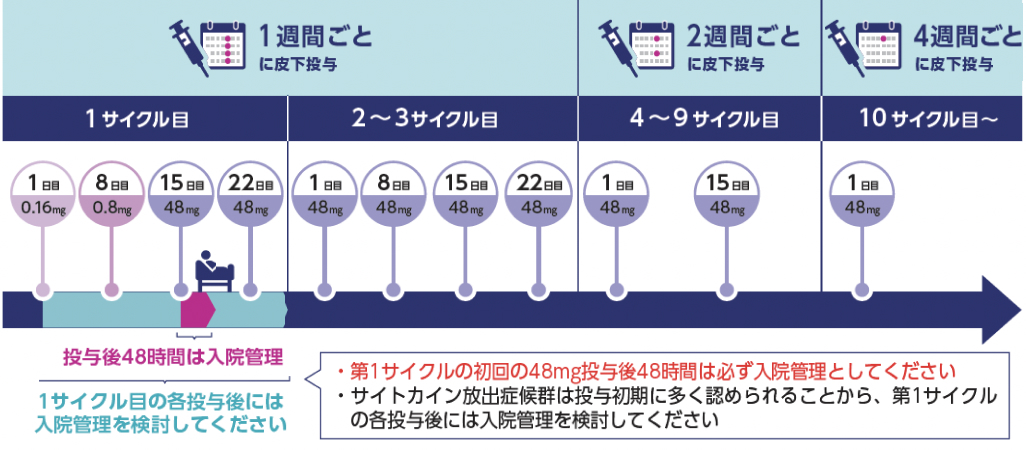
| 投与量 | コース | 投与日 |
|---|---|---|
| 0.16mg 皮下投与 | 1 | day 1 |
| 0.8mg 皮下投与 | 1 | day 8 |
| 48mg 皮下投与 | 1 | day 15、 22 |
| 48mg 皮下投与 | 2、 3 | day 1、 8、 15、 22 |
| 48mg 皮下投与 | 4-9 | day 1、 15 |
| 48mg 皮下投与 | 10- | day 1 |
前投薬
| 1サイクル目 (day 1、8、15、22):副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤 (30-120分前). |
| 1サイクル目のepcoritamab投与後1、 2、 3日目:副腎皮質ホルモン剤. |
| 2サイクル目以降:前回投与時にGrade2以上のCRSを認めた場合、 1サイクル目と同様の副腎皮質ホルモン剤を使用する. |
| より詳細なCRS軽減のための薬剤投与は概要欄参照. |
| CRS:cytokine release syndrome (サイトカイン放出症候群) |
その他
| CRSの緊急時に備えてトシリズマブを速やかに使用できるよう準備する. |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「アッヴィ製薬株式会社」 の外部サイトへ遷移します
*アッヴィ、ジェンマブの共同販売
主な有害事象
EPCORE-NHL-1試験 (GCT3013-01試験)¹⁾ より引用.
骨髄抑制
- 好中球減少症 (≧Grade3 14.6%)
- 貧血 (≧Grade3 10.2%)
- 血小板減少症 (≧Grade3 5.7%)
主な有害事象
- サイトカイン放出症候群 (49.7%、 ≧Grade3 2.5%)
- 発熱 (23.6%、 ≧Grade3 0.0%)
- 倦怠感 (22.9%、 ≧Grade3 1.9%)
- 下痢 (20.4%、 ≧Grade3 0.0%)
- 悪心 (19.7%、 ≧Grade3 1.3%)
- 注射部位反応 (19.7%、 ≧Grade3 0.0%)
- 腹痛 (14.0%、 ≧Grade3 1.9%)
- 頭痛 (13.4%、 ≧Grade3 0.6%)
- 便秘 (12.7%、 ≧Grade3 0.0%)
- 食欲減退 (12.4%、 ≧Grade3 0.6%)
- 嘔吐 (12.1%、 ≧Grade3 0.6%)
- 末梢浮腫 (10.8%、 ≧Grade3 0.0%)
- 背部痛 (10.2%、 ≧Grade3 0.6%)
その他重要な有害事象
- サイトカイン放出症候群 (49.7%、 ≧Grade3 2.5%)
- 免疫エフェクター細胞関連神経毒性症候群 (6.4%、 ≧Grade3 0.6%)
- Clinical-腫瘍崩壊症候群 (1.3%、 ≧Grade3 1.3%)
特徴と注意点
特徴
エプコリタマブはCD3及びCD20に結合するヒト化IgG1二重特異性モノクローナル抗体
T細胞の細胞膜上に発現するCD3とB細胞性腫瘍の細胞膜上に発現するCD20の両者に結合することによりT細胞の増殖及び活性化を誘導し、 CD20陽性の腫瘍細胞を傷害する。
他の抗悪性腫瘍剤との併用について有効性及び安全性は確立していない。
適応
再発又は難治性の以下の疾患
①びまん性大細胞型B細胞リンパ腫
②高悪性度B細胞リンパ腫
③原発性縦隔大細胞型B細胞リンパ腫
④濾胞性リンパ腫のGrade3B
上記の疾患であり、 抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効又は治療後に再発した患者が対象.
投与スケジュール
副作用と対策
サイトカイン放出症候群 (CRS)
- CRSを軽減させるため本剤投与前後に下記の薬剤投与を行う.
- CRS発現までの期間中央値:16.0 (1-55)日.
- CRS発現から消失までの期間中央値:2.0 (1-27)日.
- 第1サイクルの各投与後は入院管理を検討すること.
- 少なくとも第1サイクルの初回の48mg投与後48時間は必ず入院管理とする.
- 緊急時に備えてトシリズマブを速やかに使用できるよう準備する.
免疫エフェクター細胞関連神経毒性症候群 (ICANS)
- ICANS (失語症、 意識レベルの変化、 認知能力の障害、 筋力低下、 痙攣発作等) が現れることがある.
- 自動車の運転等危険を伴う機械の操作に十分注意するよう指導する.
※製造販売業者が提供する免疫エフェクター細胞関連神経毒性症候群ガイダンス等に従い適切な処置を行うこと
- ICANS発現までの期間中央値:16.5 (8-141)日.
- ICANS発現から消失までの期間中央値:5.0 (1-9)日.
感染症
- 帯状疱疹等の再活性化やニューモシスチス・イロベチイ等の感染に注意する.
CRS軽減のための薬剤投与
≪1サイクル目≫
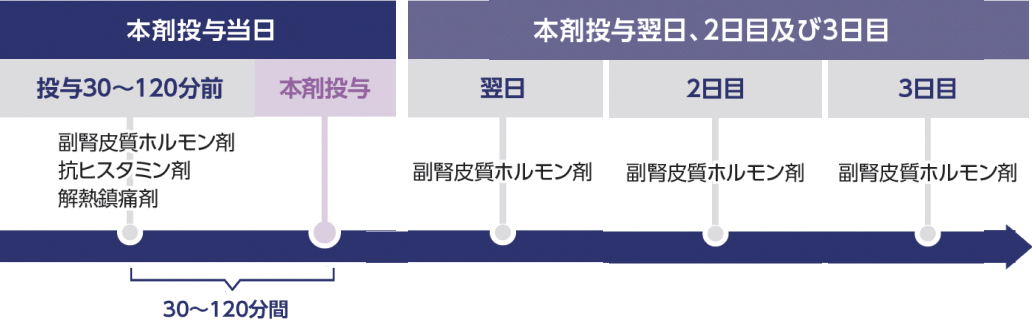
- 1日目 (投与日) 投与30~120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 2~4日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 8日目 (投与日) 投与30~120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 9~11日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 15日目 (投与日) 投与30-120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 16~18日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 22日目 (投与日) 投与30-120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 23~25日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
≪2サイクル目以降≫
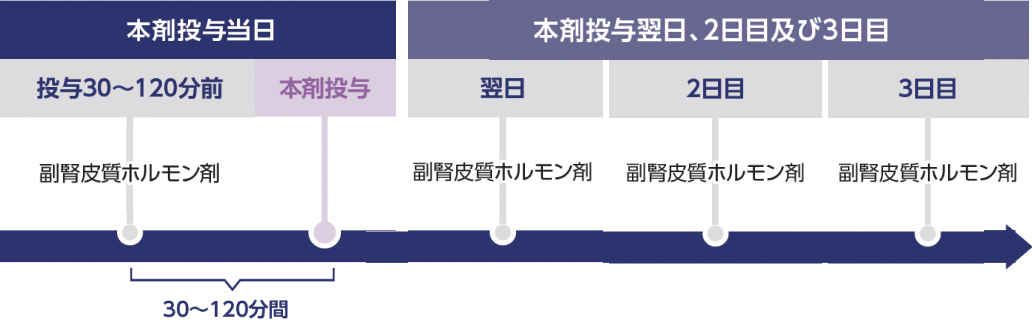
- Grade 2又は3のCRSが発現した患者は、 投与後Grade 2以上のCRSが現れなくなるまで副腎皮質ホルモン剤を投与.
- 1日目 (投与日) 投与30-120分前:副腎皮質ホルモン剤、
- 2~4日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 以降投与日及び投与翌日、 2日目、 3日目:副腎皮質ホルモン剤
CRSを軽減させるための薬剤推奨用量

*CRSを軽減させるための使用に対して国内未承認.
- プレドニゾロンのかわりにデキサメタゾン15mgを使用しても良い.
- 高用量ステロイド投与による副作用軽減のためデキサメタゾン12mgへの減量も検討する.
- 海外第Ⅰ/Ⅱ相試験 (GCT3013-01試験)¹⁾ の「最適化パート」では、 CRS予防の副腎皮質ホルモン剤はデキサメタゾン 15mg静脈内投与 (又は相当量) を使用しており、 CRSの発現状況は全Grade 37.0% (Grade 1: 25.9%、 Grade 2: 9.9%、 Grade 3: 1.2%)、 「用量拡大パート」では、 プレドニゾロン 100mg静脈内投与 (又は相当量) を使用しており、 CRSの発現状況は、 全Grade 49.6% (Grade 1: 30.2%、 Grade 2: 15.8%、 Grade 3: 3.6%) であった (ジェンマブ医療関係者向けサイトより引用).
CRS及びTLSを予防するための水分補給
- CRS及び腫瘍崩壊症候群 (TLS) 予防のため水分補給を十分に行う.

*適正使用ガイドより引用.
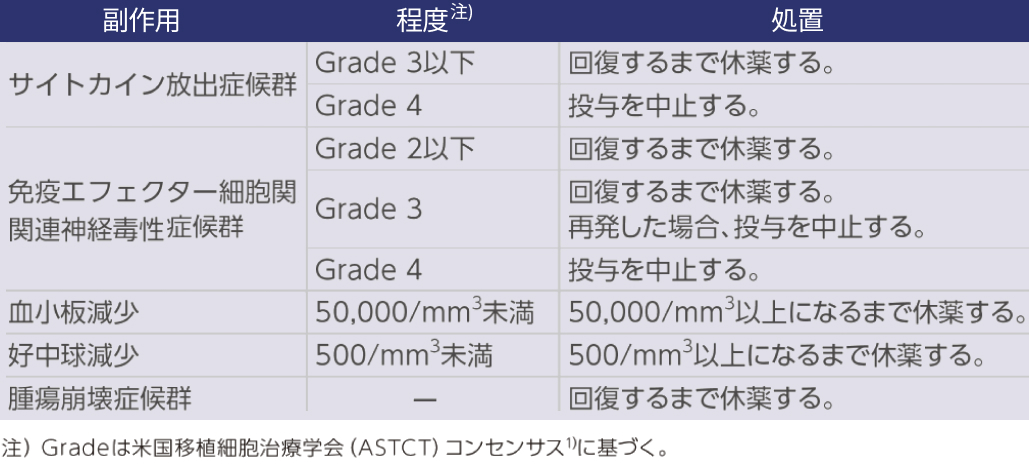
副作用発現時の休薬・中止基準
- 副作用が発現した場合には、 以下の基準を参考に、 本剤を休薬又は中止する.
本剤投与遅延後に投与を再開する場合
- 本剤の休薬後に投与を再開する場合は、 休薬前に予定されていた投与スケジュールで再開する.
- 以下のいずれかに該当する投与遅延があった場合は、 1サイクル目の投与方法に戻して再び投与を開始する.

- 以降は予定されていた次の投与サイクル (投与を延期したサイクルの次の投与サイクル) の1日目からの投与方法で投与を継続する.
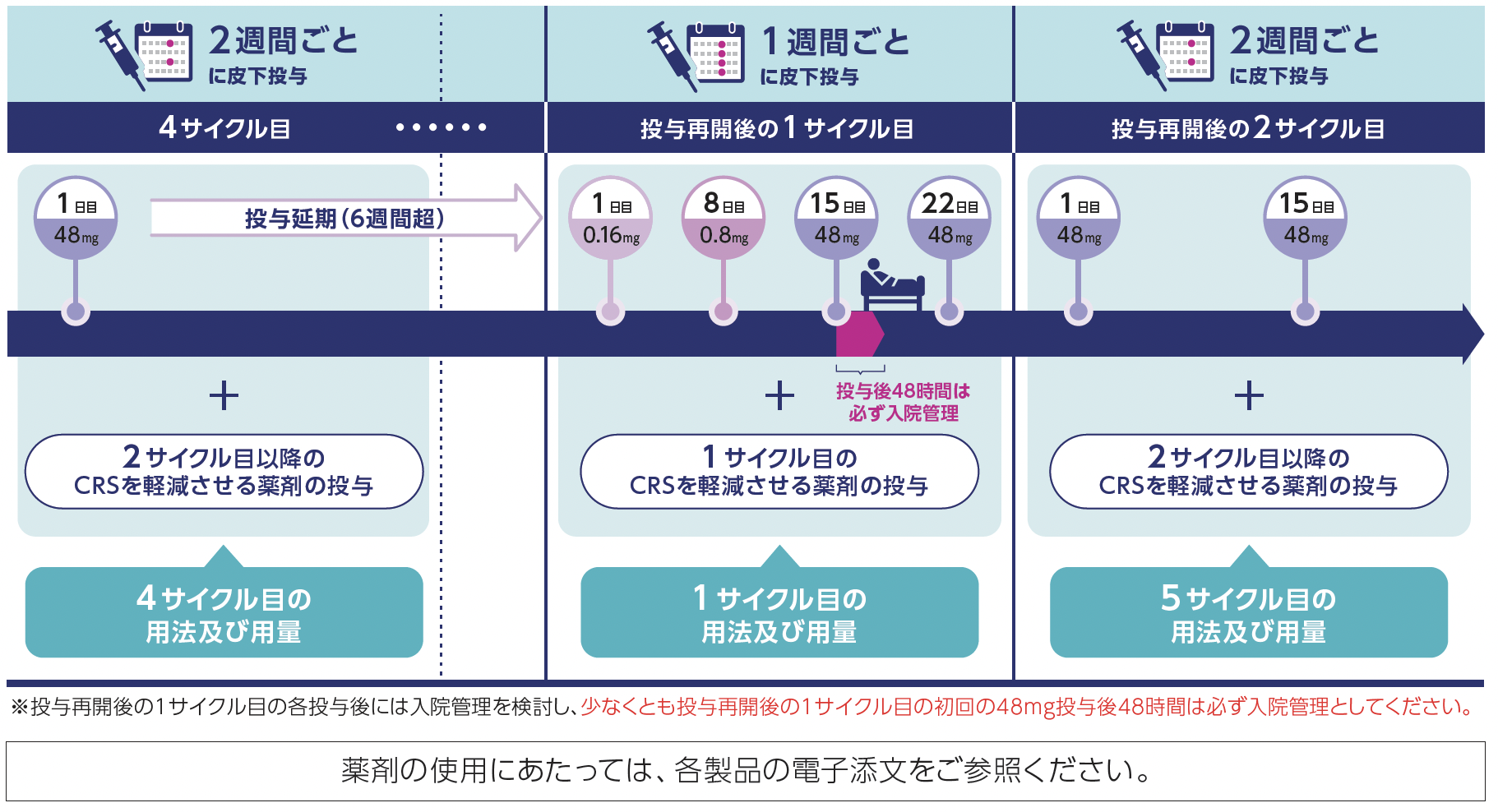
投与方法に関する注意事項
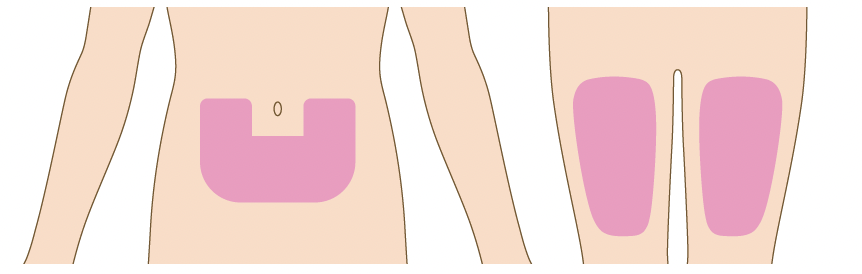
- 大腿部、 腹部等に左右交互に投与するなど同一注射部位を避ける (特に週1回投与時).
- 薬剤調製後は速やかに使用する. 希釈後直ちに使用できない場合は2-8℃で遮光保存し24時間以内に使用する. 室温保存する場合は調製開始から投与まで12時間以内とする.
関連する臨床試験の結果
EPCORE-NHL-1試験 (GCT3013-01試験)¹⁾
概要
- 海外第II相、 非盲検、 単群試験.
- 再発又は難治性のアグレッシブB細胞性非ホジキンリンパ腫 157例.
びまん性大細胞型B細胞リンパ腫 (DLBCL) 139例、 高悪性度B細胞リンパ腫 (HGBCL) 9例、 原発性縦隔大細胞型B細胞リンパ腫 (PMBCL) 4例)、 濾胞性リンパ腫 (FL) Grade3B 5例
結果
- 全奏効率:63.1% (95%CI 55.0-70.6).
- DLBCL:61.9% (95%CI 53.3-70.0).
- その他:72.2% (95%CI 46.5-90.3).
- 完全奏効率:38.9% (95%CI 31.2-46.9).
- DLBCL:38.8% (95%CI 30.7-47.5).
- その他:38.9% (95%CI 17.3-64.3).
- 奏効期間中央値:12.0ヵ月 (95%CI 6.6-not reached).
- 6ヵ月時点の奏効率:62.2% (95%CI 51.1-71.4).
- 9ヵ月時点の奏効率:60.6% (95%CI 49.3-70.0).
- 完全奏効期間中央値:12.0ヵ月 (95%CI 9.7-not reached).
- 無増悪生存期間中央値:4.4ヵ月 (95%CI 3.0-7.9).
- 全生存期間中央値:未到達 (95%CI 11.3-not reached).
- 奏効までの期間中央値:1.4ヵ月 (95%CI 1.0-8.4).
- 完全奏効までの期間中央値:2.7ヵ月 (95%CI 1.2-11.2).
- 投与中止に至った有害事象:12例 (COVID-19 2例、骨髄異型性症候群 2例等).
- 死亡に至った有害事象:9例 (COVID-19 2例、進行性多巣性白質脳症、 免疫エフェクター細胞関連神経毒性症候群、 意識消失、 心筋梗塞、 全身健康状態悪化、 肝毒性、 肺塞栓症各1例).
EPCORE NHL-3試験²⁾
概要
- 国内第I/II相、 非盲検、 単群試験.
- 対象:再発又は難治性のDLBCL* 36例.
*DLBCL NOS及びDouble/triple-hit DLBCLで抗CD20抗体薬を含む2レジメン以上の化学療法後の再発又は難治性例
結果
- 追跡期間中央値:8.4ヵ月 (1.5-12.0ヵ月).
- 全奏効率:55.6% (95%CI 38.1-72.1).
- 完全奏効率:44.4% (95%CI 27.9-61.9).
- 奏効期間中央値:未到達 (95%CI 4.2-未到達).
- 無増悪生存期間中央値:4.1ヵ月 (95%CI 1.2-未到達).
- 全生存期間中央値:未到達 (95%CI 8.1-未到達).
特に注目すべき有害事象
- CRS:全Grade 83.3% (Grade 1 50.0%、 Grade 2 25.0%、 Grade 3 8.3%).
- ICANS:全Grade 2.8% (Grade 1 2.8%)
- 感染症:全Grade 44.4% (Grade 3/4 19.4%)
- 血球減少:記載省略
参考文献
最終更新:2024年6月12日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
Epcoritamab
Epcoritamab:エプコリタマブ(エプキンリ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 0.16mg 皮下投与 | 1 | day 1 |
| 0.8mg 皮下投与 | 1 | day 8 |
| 48mg 皮下投与 | 1 | day 15、 22 |
| 48mg 皮下投与 | 2、 3 | day 1、 8、 15、 22 |
| 48mg 皮下投与 | 4-9 | day 1、 15 |
| 48mg 皮下投与 | 10- | day 1 |
前投薬
| 1サイクル目 (day 1、8、15、22):副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤 (30-120分前). |
| 1サイクル目のepcoritamab投与後1、 2、 3日目:副腎皮質ホルモン剤. |
| 2サイクル目以降:前回投与時にGrade2以上のCRSを認めた場合、 1サイクル目と同様の副腎皮質ホルモン剤を使用する. |
| より詳細なCRS軽減のための薬剤投与は概要欄参照. |
| CRS:cytokine release syndrome (サイトカイン放出症候群) |
その他
| CRSの緊急時に備えてトシリズマブを速やかに使用できるよう準備する. |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*「アッヴィ製薬株式会社」 の外部サイトへ遷移します
*アッヴィ、ジェンマブの共同販売
主な有害事象
EPCORE-NHL-1試験 (GCT3013-01試験)¹⁾ より引用.
骨髄抑制
- 好中球減少症 (≧Grade3 14.6%)
- 貧血 (≧Grade3 10.2%)
- 血小板減少症 (≧Grade3 5.7%)
主な有害事象
- サイトカイン放出症候群 (49.7%、 ≧Grade3 2.5%)
- 発熱 (23.6%、 ≧Grade3 0.0%)
- 倦怠感 (22.9%、 ≧Grade3 1.9%)
- 下痢 (20.4%、 ≧Grade3 0.0%)
- 悪心 (19.7%、 ≧Grade3 1.3%)
- 注射部位反応 (19.7%、 ≧Grade3 0.0%)
- 腹痛 (14.0%、 ≧Grade3 1.9%)
- 頭痛 (13.4%、 ≧Grade3 0.6%)
- 便秘 (12.7%、 ≧Grade3 0.0%)
- 食欲減退 (12.4%、 ≧Grade3 0.6%)
- 嘔吐 (12.1%、 ≧Grade3 0.6%)
- 末梢浮腫 (10.8%、 ≧Grade3 0.0%)
- 背部痛 (10.2%、 ≧Grade3 0.6%)
その他重要な有害事象
- サイトカイン放出症候群 (49.7%、 ≧Grade3 2.5%)
- 免疫エフェクター細胞関連神経毒性症候群 (6.4%、 ≧Grade3 0.6%)
- Clinical-腫瘍崩壊症候群 (1.3%、 ≧Grade3 1.3%)
特徴と注意点
特徴
エプコリタマブはCD3及びCD20に結合するヒト化IgG1二重特異性モノクローナル抗体
T細胞の細胞膜上に発現するCD3とB細胞性腫瘍の細胞膜上に発現するCD20の両者に結合することによりT細胞の増殖及び活性化を誘導し、 CD20陽性の腫瘍細胞を傷害する。
他の抗悪性腫瘍剤との併用について有効性及び安全性は確立していない。
適応
再発又は難治性の以下の疾患
①びまん性大細胞型B細胞リンパ腫
②高悪性度B細胞リンパ腫
③原発性縦隔大細胞型B細胞リンパ腫
④濾胞性リンパ腫のGrade3B
上記の疾患であり、 抗CD20モノクローナル抗体製剤を含む少なくとも2つの標準的な治療が無効又は治療後に再発した患者が対象.
投与スケジュール

副作用と対策
サイトカイン放出症候群 (CRS)
- CRSを軽減させるため本剤投与前後に下記の薬剤投与を行う.
- CRS発現までの期間中央値:16.0 (1-55)日.
- CRS発現から消失までの期間中央値:2.0 (1-27)日.
- 第1サイクルの各投与後は入院管理を検討すること.
- 少なくとも第1サイクルの初回の48mg投与後48時間は必ず入院管理とする.
- 緊急時に備えてトシリズマブを速やかに使用できるよう準備する.
免疫エフェクター細胞関連神経毒性症候群 (ICANS)
- ICANS (失語症、 意識レベルの変化、 認知能力の障害、 筋力低下、 痙攣発作等) が現れることがある.
- 自動車の運転等危険を伴う機械の操作に十分注意するよう指導する.
※製造販売業者が提供する免疫エフェクター細胞関連神経毒性症候群ガイダンス等に従い適切な処置を行うこと
- ICANS発現までの期間中央値:16.5 (8-141)日.
- ICANS発現から消失までの期間中央値:5.0 (1-9)日.
感染症
- 帯状疱疹等の再活性化やニューモシスチス・イロベチイ等の感染に注意する.
CRS軽減のための薬剤投与
≪1サイクル目≫

- 1日目 (投与日) 投与30~120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 2~4日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 8日目 (投与日) 投与30~120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 9~11日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 15日目 (投与日) 投与30-120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 16~18日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 22日目 (投与日) 投与30-120分前:副腎皮質ホルモン剤、 抗ヒスタミン剤、 解熱鎮痛剤
- 23~25日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
≪2サイクル目以降≫

- Grade 2又は3のCRSが発現した患者は、 投与後Grade 2以上のCRSが現れなくなるまで副腎皮質ホルモン剤を投与.
- 1日目 (投与日) 投与30-120分前:副腎皮質ホルモン剤、
- 2~4日目 (投与翌日、 2日目、 3日目):副腎皮質ホルモン剤
- 以降投与日及び投与翌日、 2日目、 3日目:副腎皮質ホルモン剤
CRSを軽減させるための薬剤推奨用量

*CRSを軽減させるための使用に対して国内未承認.
- プレドニゾロンのかわりにデキサメタゾン15mgを使用しても良い.
- 高用量ステロイド投与による副作用軽減のためデキサメタゾン12mgへの減量も検討する.
- 海外第Ⅰ/Ⅱ相試験 (GCT3013-01試験)¹⁾ の「最適化パート」では、 CRS予防の副腎皮質ホルモン剤はデキサメタゾン 15mg静脈内投与 (又は相当量) を使用しており、 CRSの発現状況は全Grade 37.0% (Grade 1: 25.9%、 Grade 2: 9.9%、 Grade 3: 1.2%)、 「用量拡大パート」では、 プレドニゾロン 100mg静脈内投与 (又は相当量) を使用しており、 CRSの発現状況は、 全Grade 49.6% (Grade 1: 30.2%、 Grade 2: 15.8%、 Grade 3: 3.6%) であった (ジェンマブ医療関係者向けサイトより引用).
CRS及びTLSを予防するための水分補給
- CRS及び腫瘍崩壊症候群 (TLS) 予防のため水分補給を十分に行う.

*適正使用ガイドより引用.
副作用発現時の休薬・中止基準
- 副作用が発現した場合には、 以下の基準を参考に、 本剤を休薬又は中止する.

本剤投与遅延後に投与を再開する場合
- 本剤の休薬後に投与を再開する場合は、 休薬前に予定されていた投与スケジュールで再開する.
- 以下のいずれかに該当する投与遅延があった場合は、 1サイクル目の投与方法に戻して再び投与を開始する.

- 以降は予定されていた次の投与サイクル (投与を延期したサイクルの次の投与サイクル) の1日目からの投与方法で投与を継続する.

投与方法に関する注意事項

- 大腿部、 腹部等に左右交互に投与するなど同一注射部位を避ける (特に週1回投与時).
- 薬剤調製後は速やかに使用する. 希釈後直ちに使用できない場合は2-8℃で遮光保存し24時間以内に使用する. 室温保存する場合は調製開始から投与まで12時間以内とする.
関連する臨床試験の結果
EPCORE-NHL-1試験 (GCT3013-01試験)¹⁾
概要
- 海外第II相、 非盲検、 単群試験.
- 再発又は難治性のアグレッシブB細胞性非ホジキンリンパ腫 157例.
びまん性大細胞型B細胞リンパ腫 (DLBCL) 139例、 高悪性度B細胞リンパ腫 (HGBCL) 9例、 原発性縦隔大細胞型B細胞リンパ腫 (PMBCL) 4例)、 濾胞性リンパ腫 (FL) Grade3B 5例
結果
- 全奏効率:63.1% (95%CI 55.0-70.6).
- DLBCL:61.9% (95%CI 53.3-70.0).
- その他:72.2% (95%CI 46.5-90.3).
- 完全奏効率:38.9% (95%CI 31.2-46.9).
- DLBCL:38.8% (95%CI 30.7-47.5).
- その他:38.9% (95%CI 17.3-64.3).
- 奏効期間中央値:12.0ヵ月 (95%CI 6.6-not reached).
- 6ヵ月時点の奏効率:62.2% (95%CI 51.1-71.4).
- 9ヵ月時点の奏効率:60.6% (95%CI 49.3-70.0).
- 完全奏効期間中央値:12.0ヵ月 (95%CI 9.7-not reached).
- 無増悪生存期間中央値:4.4ヵ月 (95%CI 3.0-7.9).
- 全生存期間中央値:未到達 (95%CI 11.3-not reached).
- 奏効までの期間中央値:1.4ヵ月 (95%CI 1.0-8.4).
- 完全奏効までの期間中央値:2.7ヵ月 (95%CI 1.2-11.2).
- 投与中止に至った有害事象:12例 (COVID-19 2例、骨髄異型性症候群 2例等).
- 死亡に至った有害事象:9例 (COVID-19 2例、進行性多巣性白質脳症、 免疫エフェクター細胞関連神経毒性症候群、 意識消失、 心筋梗塞、 全身健康状態悪化、 肝毒性、 肺塞栓症各1例).
EPCORE NHL-3試験²⁾
概要
- 国内第I/II相、 非盲検、 単群試験.
- 対象:再発又は難治性のDLBCL* 36例.
*DLBCL NOS及びDouble/triple-hit DLBCLで抗CD20抗体薬を含む2レジメン以上の化学療法後の再発又は難治性例
結果
- 追跡期間中央値:8.4ヵ月 (1.5-12.0ヵ月).
- 全奏効率:55.6% (95%CI 38.1-72.1).
- 完全奏効率:44.4% (95%CI 27.9-61.9).
- 奏効期間中央値:未到達 (95%CI 4.2-未到達).
- 無増悪生存期間中央値:4.1ヵ月 (95%CI 1.2-未到達).
- 全生存期間中央値:未到達 (95%CI 8.1-未到達).
特に注目すべき有害事象
- CRS:全Grade 83.3% (Grade 1 50.0%、 Grade 2 25.0%、 Grade 3 8.3%).
- ICANS:全Grade 2.8% (Grade 1 2.8%)
- 感染症:全Grade 44.4% (Grade 3/4 19.4%)
- 血球減少:記載省略
参考文献
最終更新:2024年6月12日
執筆担当:北里大学病院薬剤部 宮島律子
監修医師:東海大学血液腫瘍内科 扇屋大輔
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。

