治療スケジュール
概要
監修医師
VEN:ベネトクラクス(ベネクレクスタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg/body 経口 | 1 | Day 1 |
| 200mg/body 経口 | 1 | Day 2 |
| 400mg/body 経口 | 1 | Day 3~28 |
| 400mg/body 経口 | 2~ | Day 1~28 |
AZA:アザシチジン(ビダーザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 75mg/m² 皮下注or点滴静注 | 1~ | Day 1~7 |
前投薬
| AZA投与7日間は5-HT3受容体拮抗薬を使用. |
その他
| 1コースは28日間. |
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*適正使用ガイドは「アッヴィ合同会社」 の外部サイトへ遷移します.
*適正使用ガイドは「日本新薬株式会社」 の外部サイトへ遷移します.
主な有害事象
VIALE-A試験¹⁾より引用
骨髄抑制
- 好中球減少 (≧Grade3 42%)
- 貧血 (≧Grade3 26%)
- 血小板減少 (≧Grade3 45%)
主な有害事象
- 発熱性好中球減少症 (42%、 ≧Grade3 42%)
- 肺炎 (23%、 ≧Grade3 20%)
- 低カリウム血症 (29%、 ≧Grade3 11%)
その他重要な有害事象
- 嘔気 (44%、 ≧Grade3 2%)
- 便秘 (41%、 ≧Grade3 1%)
- 嘔吐 (30%、 ≧Grade3 2%)
特徴と注意点
作用機序と適応
- ベネトクラクスは、 BCL2阻害薬 (BH3オンリータンパクの模倣薬)でBCL2の抗アポトーシス作用を阻害しアポトーシスへ導く.
- アザシチジンは、 DNAに取り込まれてDNAのメチル化を抑制することで遺伝子発現を回復させ、 またRNAに取り込まれることでタンパク合成を阻害して殺細胞効果を示す.
- 本レジメンは、 強力化学療法が適応とならない高齢者 (65歳以上) 急性骨髄性白血病に適用される.
副作用と対策
- 腫瘍量が多い場合腫瘍崩壊症候群が出現するため十分な予防が必要.
- ベネトクラクスが最大用量に達するDay3までは1日1~2回の血液検査を推奨.
- 外来管理が可能 (皮下注および内服治療のため) とされているが骨髄抑制や感染症の頻度を考慮すると入院下での導入が望ましい.
- 強力な化学療法や移植が適応とならない高齢者へも使用可.
- CYP3Aで代謝されるためCYP3A阻害作用のある薬剤を併用する場合にはベネトクラクスの減量が必要 (下記).
- 1サイクル目の21日目頃に骨髄検査を行い、 以下の対応を行う.²⁾
- Blast <5%なら、 好中球数≧1,000/µlに回復するまでG-CSFを投与する.
- Blast >5%なら、 VEN+AZAの2サイクル目を開始する. 2サイクル目の21-28日目に骨髄検査を行う.
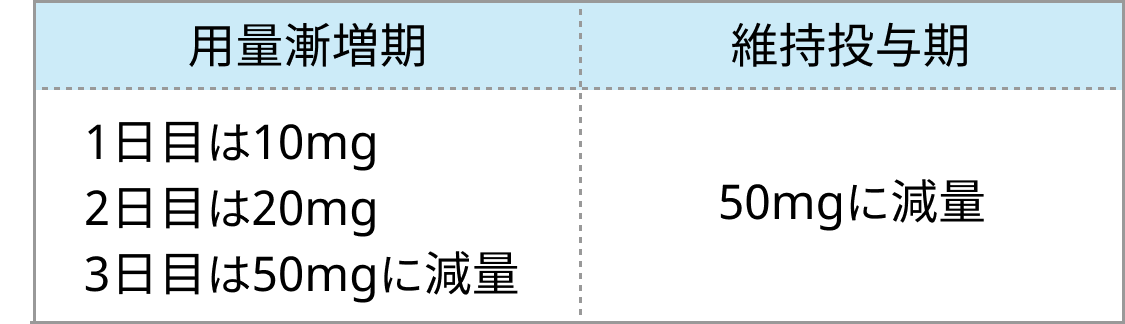
CYP阻害剤併用時のベネトクラクス用量
- 中等度のCYP3A阻害剤

- 強いCYP3A阻害剤
関連する臨床試験の結果
VIALE-A試験¹⁾
概要
- 国際共同ランダム化二重盲検第3相試験.
- 対象 : 強力な寛解導入療法の適応とならない未治療急性骨髄性白血病.
- アザシチジン療法に対するベネトクラクスの上乗せ効果を検証.
- 治療介入 : ベネトクラクス+アザシチジン (VEN+AZA群) vs プラセボ+アザシチジン (AZA群).
結果
- 追跡期間中央値 : 20.5ヵ月.
- 全生存期間中央値 : VEN+AZA群 14.7ヵ月 vs AZA群 9.6ヵ月 (HR 0.66、 95%CI 0.52-0.85、 p<0.001).
- 完全寛解率 : VEN+AZA群 36.7% vs AZA群 17.9% (p<0.001).
- 複合完全寛解率 : VEN+AZA群 66.4% vs AZA群 28.3% (p<0.001).
複合完全寛解率 : 完全寛解率+血球回復が不完全な完全寛解率
- 有害事象 (VEN+AZA群 vs AZA群で記載) : 嘔気 (44% vs 35%)、 血小板減少G3/4 (45% vs 38%)、 好中球減少 (42% vs 28%)、 発熱性好中球減少症 (42% vs 19%)、 感染 (84% vs 67%)、 重篤な有害事象 (83% vs 73%). *その他のVEN+AZAの有害事象は上記有害事象の項を参照.
結論
- VEN+AZAはAZA単剤と比較し未治療急性骨髄性白血病患者の生存期間を延長する.
参考文献
最終更新 : 2025年6月4日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
VEN+AZA
ベネトクラクス、 アザシチジン
2025年06月04日更新
VEN:ベネトクラクス(ベネクレクスタ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 100mg/body 経口 | 1 | Day 1 |
| 200mg/body 経口 | 1 | Day 2 |
| 400mg/body 経口 | 1 | Day 3~28 |
| 400mg/body 経口 | 2~ | Day 1~28 |
AZA:アザシチジン(ビダーザ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 75mg/m² 皮下注or点滴静注 | 1~ | Day 1~7 |
前投薬
| AZA投与7日間は5-HT3受容体拮抗薬を使用. |
その他
| 1コースは28日間. |
概要
本コンテンツは特定の治療法を推奨するものではございません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*適正使用ガイドは「アッヴィ合同会社」 の外部サイトへ遷移します.
*適正使用ガイドは「日本新薬株式会社」 の外部サイトへ遷移します.
主な有害事象
VIALE-A試験¹⁾より引用
骨髄抑制
- 好中球減少 (≧Grade3 42%)
- 貧血 (≧Grade3 26%)
- 血小板減少 (≧Grade3 45%)
主な有害事象
- 発熱性好中球減少症 (42%、 ≧Grade3 42%)
- 肺炎 (23%、 ≧Grade3 20%)
- 低カリウム血症 (29%、 ≧Grade3 11%)
その他重要な有害事象
- 嘔気 (44%、 ≧Grade3 2%)
- 便秘 (41%、 ≧Grade3 1%)
- 嘔吐 (30%、 ≧Grade3 2%)
特徴と注意点
作用機序と適応
- ベネトクラクスは、 BCL2阻害薬 (BH3オンリータンパクの模倣薬)でBCL2の抗アポトーシス作用を阻害しアポトーシスへ導く.
- アザシチジンは、 DNAに取り込まれてDNAのメチル化を抑制することで遺伝子発現を回復させ、 またRNAに取り込まれることでタンパク合成を阻害して殺細胞効果を示す.
- 本レジメンは、 強力化学療法が適応とならない高齢者 (65歳以上) 急性骨髄性白血病に適用される.
副作用と対策
- 腫瘍量が多い場合腫瘍崩壊症候群が出現するため十分な予防が必要.
- ベネトクラクスが最大用量に達するDay3までは1日1~2回の血液検査を推奨.
- 外来管理が可能 (皮下注および内服治療のため) とされているが骨髄抑制や感染症の頻度を考慮すると入院下での導入が望ましい.
- 強力な化学療法や移植が適応とならない高齢者へも使用可.
- CYP3Aで代謝されるためCYP3A阻害作用のある薬剤を併用する場合にはベネトクラクスの減量が必要 (下記).
- 1サイクル目の21日目頃に骨髄検査を行い、 以下の対応を行う.²⁾
- Blast <5%なら、 好中球数≧1,000/µlに回復するまでG-CSFを投与する.
- Blast >5%なら、 VEN+AZAの2サイクル目を開始する. 2サイクル目の21-28日目に骨髄検査を行う.
CYP阻害剤併用時のベネトクラクス用量
- 中等度のCYP3A阻害剤

- 強いCYP3A阻害剤

関連する臨床試験の結果
VIALE-A試験¹⁾
概要
- 国際共同ランダム化二重盲検第3相試験.
- 対象 : 強力な寛解導入療法の適応とならない未治療急性骨髄性白血病.
- アザシチジン療法に対するベネトクラクスの上乗せ効果を検証.
- 治療介入 : ベネトクラクス+アザシチジン (VEN+AZA群) vs プラセボ+アザシチジン (AZA群).
結果
- 追跡期間中央値 : 20.5ヵ月.
- 全生存期間中央値 : VEN+AZA群 14.7ヵ月 vs AZA群 9.6ヵ月 (HR 0.66、 95%CI 0.52-0.85、 p<0.001).
- 完全寛解率 : VEN+AZA群 36.7% vs AZA群 17.9% (p<0.001).
- 複合完全寛解率 : VEN+AZA群 66.4% vs AZA群 28.3% (p<0.001).
複合完全寛解率 : 完全寛解率+血球回復が不完全な完全寛解率
- 有害事象 (VEN+AZA群 vs AZA群で記載) : 嘔気 (44% vs 35%)、 血小板減少G3/4 (45% vs 38%)、 好中球減少 (42% vs 28%)、 発熱性好中球減少症 (42% vs 19%)、 感染 (84% vs 67%)、 重篤な有害事象 (83% vs 73%). *その他のVEN+AZAの有害事象は上記有害事象の項を参照.
結論
- VEN+AZAはAZA単剤と比較し未治療急性骨髄性白血病患者の生存期間を延長する.
参考文献
最終更新 : 2025年6月4日
執筆担当 : 北里大学病院薬剤部 宮島律子
監修医師 : 東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。