本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 中等度催吐性
- ドキシル® (添付文書¹⁾)
- パラプラチン® (添付文書²⁾)
*中外製薬株式会社の外部サイトへ遷移します
用法用量
AGO-OVAR 2.21/ENGOT-ov 18試験⁵⁾
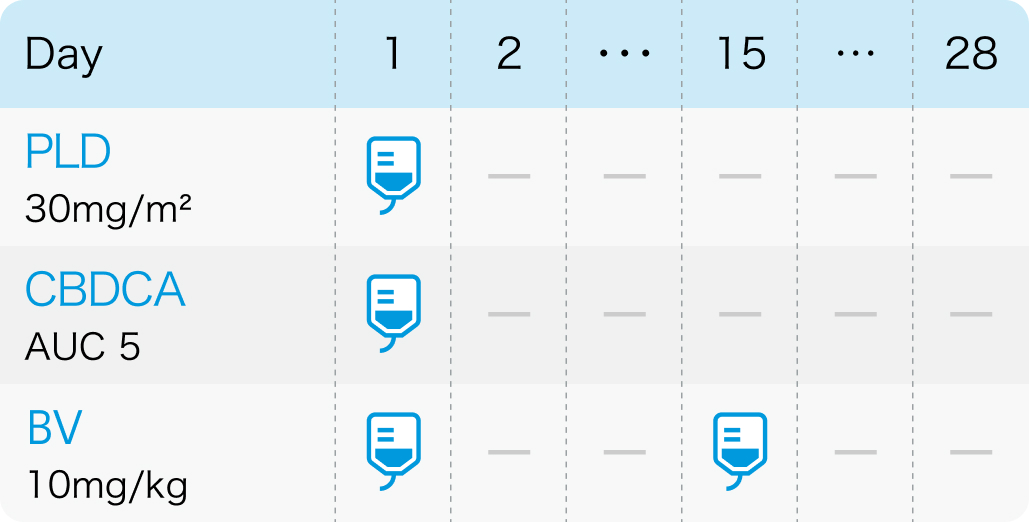
6サイクル目終了後はBV15mg/kgを3週間間隔で投与
Lancet Oncol. 2020 May;21(5):699-709⁵⁾より作図、 引用
電子添文の用法および用量
ドキソルビシン : 1日1回50mg/m²を1mg/分の速度で静脈内投与し、 その後4週間休薬
ドキシル®電子添文 (2024年1月改訂 第1版)¹⁾より引用
カルボプラチン : 1日1回300~400mg/m²を投与し、 少なくとも4週間休薬
パラプラチン®電子添文 (2023年5月改訂 第3版)²⁾より引用
ベバシズマブ : 他の抗悪性腫瘍剤との併用において、 1回10mg/kgを2週間間隔又は1回15mg/kgを3週間間隔で点滴静脈内注射
アバスチン®電子添文 (2024年3月改訂 第5版)³⁾より引用
前投薬・投与スケジュール例
‐ DEX 3.3mg+生食 100mL
‐ NK₁+5-HT₃+生食 50ml (30分)
‐ PLD 30mg/m²+5%ブ糖液 100mL (day1、 60分)
‐ CBDCA AUC5+生食 250mL (day1、30~60分)
‐ BV 15mg/kg+生食 100mL
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
AGO-OVAR 2.21/ENGOT-ov 18試験⁵⁾
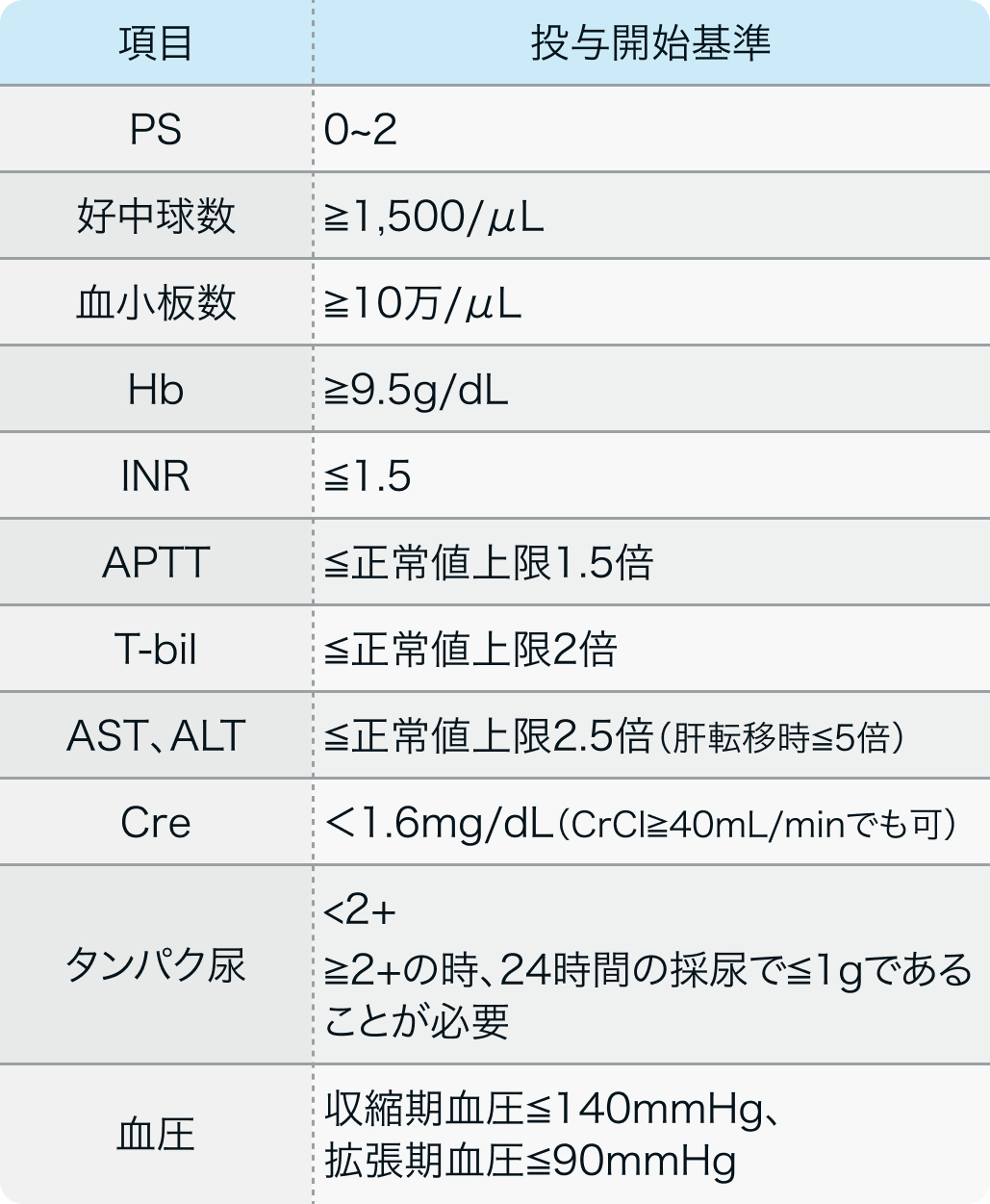
Lancet Oncol. 2020 May;21(5):699-709⁵⁾より作図
減量・休薬・中止基準
リポソーム化ドキソルビシン電子添文¹⁾の減量・休薬・中止基準

ドキシル®電子添文 (2024年1月改訂 第1版)¹⁾より作図
KeyData|臨床試験結果
AGO-OVAR 2.21/ENGOT-ov 18試験⁵⁾
対象: 初回のプラチナベースの化学療法後6ヵ月以上経過した再発卵巣癌、 原発性腹膜癌、 または卵管癌患者682例
方法: PLD + CBDCA + BV群 vs GC (GEM + CBDCA) + BV群
【有効性】PLD + CBDCA + BV群
- mPFS 13.3ヵ月
- mOS 31.9ヵ月
【安全性】
≧Grade3の主な有害事象
- 好中球数減少 12.0%
- 発熱性好中球減少症 0.9%
- 高血圧 27.7%
- 蛋白尿 5.4%
- 静脈血栓塞栓症 1.8%
- 心不全 0.6%
全てのGradeの有害事象
- 中枢神経系出血 1.2%
- 瘻孔形成 0.9%
- 消化管穿孔 0.6%
- 後天性可逆性脳症候群 (PRES) 0.3%
Lancet Oncol. 2020 May;21(5):699-709⁵⁾より引用
エキスパートによるワンポイント
AGO-OVAR2.21/ENGOT-ov18試験⁵⁾
本レジメンと、 GC (GEM+CBDCA) + BV療法とを比較したRCTです。 プライマリーエンドポイントのPFS (無増悪生存期間) は有意にCD+BV療法が優っていました (13.3 vs 11.6ヵ月、 HR=0.81、 95% CI : 0.68-0.96、 p=0.012)。 また、 OS (全生存期間) も、 CD+BV療法のほうが良い傾向にありました (27.8 vs 25.5ヵ月、 p=0.032)。 副作用は、 好中球数減少がGC療法に多く出現しました。 その他の副作用は同程度でした。
CD (CBDCA+PLD)+BV療法の臨床的意義
AGO-OVAR 2.21/ENGOT-ov18試験⁵⁾は、 CD+BV療法とGC+BV療法を比較した初の臨床試験であり、 PFS、 OSともに優っていたCD+BV療法は、 再発プラチナ感受性卵巣癌に対して、 最有力の治療選択肢となるかと思われます。 ただし、 初回治療にBVを投与された患者に、 再発後もBVを追加することの意義について (Beyond Progression) は、 まだ証明がありません。
BVの重篤な有害事象として、 出血、 瘻孔、 塞栓などがあります。 特に、 腸管切除をした患者、 炎症性腸疾患のある患者には、 有意に重篤有害事象が出現しやすいというエビデンス⁶⁾がありますので、 そのような患者は投与は避けるべきです。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- バクスター. ドキシル®電子添文 (2024年1月改訂 第1版) [最終閲覧 : 2024/03/21]
- クリニジェン株式会社. パラプラチン®電子添文 (2023年5月改訂 第3版) [最終閲覧 : 2024/03/14]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/03/21]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2022年6月作成) [最終閲覧 : 2024/03/21]
- Bevacizumab and platinum-based combinations for recurrent ovarian cancer: a randomised, open-label, phase 3 trial. Lancet Oncol. 2020 May;21(5):699-709. PMID: 32305099
- Risk factors for GI adverse events in a phase III randomized trial of bevacizumab in first-line therapy of advanced ovarian cancer: A Gynecologic Oncology Group Study. J Clin Oncol. 2014 Apr 20;32(12):1210-7. PMID: 24637999
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
PLD + CBDCA + BV
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
【催吐性】 中等度催吐性
- ドキシル® (添付文書¹⁾)
- パラプラチン® (添付文書²⁾)
*中外製薬株式会社の外部サイトへ遷移します
用法用量
AGO-OVAR 2.21/ENGOT-ov 18試験⁵⁾

6サイクル目終了後はBV15mg/kgを3週間間隔で投与
Lancet Oncol. 2020 May;21(5):699-709⁵⁾より作図、 引用
電子添文の用法および用量
ドキソルビシン : 1日1回50mg/m²を1mg/分の速度で静脈内投与し、 その後4週間休薬
ドキシル®電子添文 (2024年1月改訂 第1版)¹⁾より引用
カルボプラチン : 1日1回300~400mg/m²を投与し、 少なくとも4週間休薬
パラプラチン®電子添文 (2023年5月改訂 第3版)²⁾より引用
ベバシズマブ : 他の抗悪性腫瘍剤との併用において、 1回10mg/kgを2週間間隔又は1回15mg/kgを3週間間隔で点滴静脈内注射
アバスチン®電子添文 (2024年3月改訂 第5版)³⁾より引用
前投薬・投与スケジュール例
‐ DEX 3.3mg+生食 100mL
‐ NK₁+5-HT₃+生食 50ml (30分)
‐ PLD 30mg/m²+5%ブ糖液 100mL (day1、 60分)
‐ CBDCA AUC5+生食 250mL (day1、30~60分)
‐ BV 15mg/kg+生食 100mL
日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生提供
投与開始基準
AGO-OVAR 2.21/ENGOT-ov 18試験⁵⁾

Lancet Oncol. 2020 May;21(5):699-709⁵⁾より作図
減量・休薬・中止基準
リポソーム化ドキソルビシン電子添文¹⁾の減量・休薬・中止基準

ドキシル®電子添文 (2024年1月改訂 第1版)¹⁾より作図
KeyData|臨床試験結果
AGO-OVAR 2.21/ENGOT-ov 18試験⁵⁾
対象: 初回のプラチナベースの化学療法後6ヵ月以上経過した再発卵巣癌、 原発性腹膜癌、 または卵管癌患者682例
方法: PLD + CBDCA + BV群 vs GC (GEM + CBDCA) + BV群
【有効性】PLD + CBDCA + BV群
- mPFS 13.3ヵ月
- mOS 31.9ヵ月
【安全性】
≧Grade3の主な有害事象
- 好中球数減少 12.0%
- 発熱性好中球減少症 0.9%
- 高血圧 27.7%
- 蛋白尿 5.4%
- 静脈血栓塞栓症 1.8%
- 心不全 0.6%
全てのGradeの有害事象
- 中枢神経系出血 1.2%
- 瘻孔形成 0.9%
- 消化管穿孔 0.6%
- 後天性可逆性脳症候群 (PRES) 0.3%
Lancet Oncol. 2020 May;21(5):699-709⁵⁾より引用
エキスパートによるワンポイント
AGO-OVAR2.21/ENGOT-ov18試験⁵⁾
本レジメンと、 GC (GEM+CBDCA) + BV療法とを比較したRCTです。 プライマリーエンドポイントのPFS (無増悪生存期間) は有意にCD+BV療法が優っていました (13.3 vs 11.6ヵ月、 HR=0.81、 95% CI : 0.68-0.96、 p=0.012)。 また、 OS (全生存期間) も、 CD+BV療法のほうが良い傾向にありました (27.8 vs 25.5ヵ月、 p=0.032)。 副作用は、 好中球数減少がGC療法に多く出現しました。 その他の副作用は同程度でした。
CD (CBDCA+PLD)+BV療法の臨床的意義
AGO-OVAR 2.21/ENGOT-ov18試験⁵⁾は、 CD+BV療法とGC+BV療法を比較した初の臨床試験であり、 PFS、 OSともに優っていたCD+BV療法は、 再発プラチナ感受性卵巣癌に対して、 最有力の治療選択肢となるかと思われます。 ただし、 初回治療にBVを投与された患者に、 再発後もBVを追加することの意義について (Beyond Progression) は、 まだ証明がありません。
BVの重篤な有害事象として、 出血、 瘻孔、 塞栓などがあります。 特に、 腸管切除をした患者、 炎症性腸疾患のある患者には、 有意に重篤有害事象が出現しやすいというエビデンス⁶⁾がありますので、 そのような患者は投与は避けるべきです。
監修 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
出典
- バクスター. ドキシル®電子添文 (2024年1月改訂 第1版) [最終閲覧 : 2024/03/21]
- クリニジェン株式会社. パラプラチン®電子添文 (2023年5月改訂 第3版) [最終閲覧 : 2024/03/14]
- 中外製薬株式会社. アバスチン®電子添文 (2024年3月改訂 第5版) [最終閲覧 : 2024/03/21]
- 中外製薬株式会社. アバスチン®適正使用ガイド (2022年6月作成) [最終閲覧 : 2024/03/21]
- Bevacizumab and platinum-based combinations for recurrent ovarian cancer: a randomised, open-label, phase 3 trial. Lancet Oncol. 2020 May;21(5):699-709. PMID: 32305099
- Risk factors for GI adverse events in a phase III randomized trial of bevacizumab in first-line therapy of advanced ovarian cancer: A Gynecologic Oncology Group Study. J Clin Oncol. 2014 Apr 20;32(12):1210-7. PMID: 24637999
最終更新日 : 2024年8月3日
監修医師 : 日本医科大学 武蔵小杉病院 腫瘍内科教授 勝俣 範之先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。