Atezolizumab:Atezolizumab(テセントリク®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,200mg/body 点滴 | 1~ | Day1 |
BV:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 15mg/kg 点滴 | 1~ | Day1 |
その他
| 1コース21日間。 |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク® (アテゾリズマブ)
抗PD-L1抗体 *中外製薬株式会社の外部サイトへ遷移します
アバスチン® (ベバシズマブ)
抗VEGF抗体 *中外製薬の外部サイトへ遷移します
用法用量
IMbrave150試験⁴⁾のプロトコル
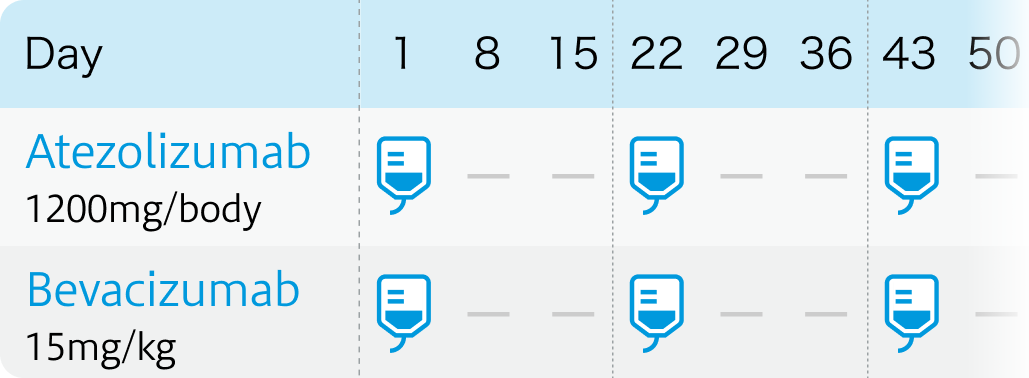
N Engl J Med. 2020 May 14;382(20):1894-1905⁴⁾より作図
投与開始基準
IMbrave150試験⁴⁾のプロトコル
- 18歳以上
- 組織学的に確認された局所進行又は転移及び/又は切除不能なHCCを有する患者
- 肝硬変がある場合、 組織学的検査・細胞診又はAASLD基準に基づいて臨床的に確認された、 局所進行又は転移及び/又は切除不能なHCCを有する患者
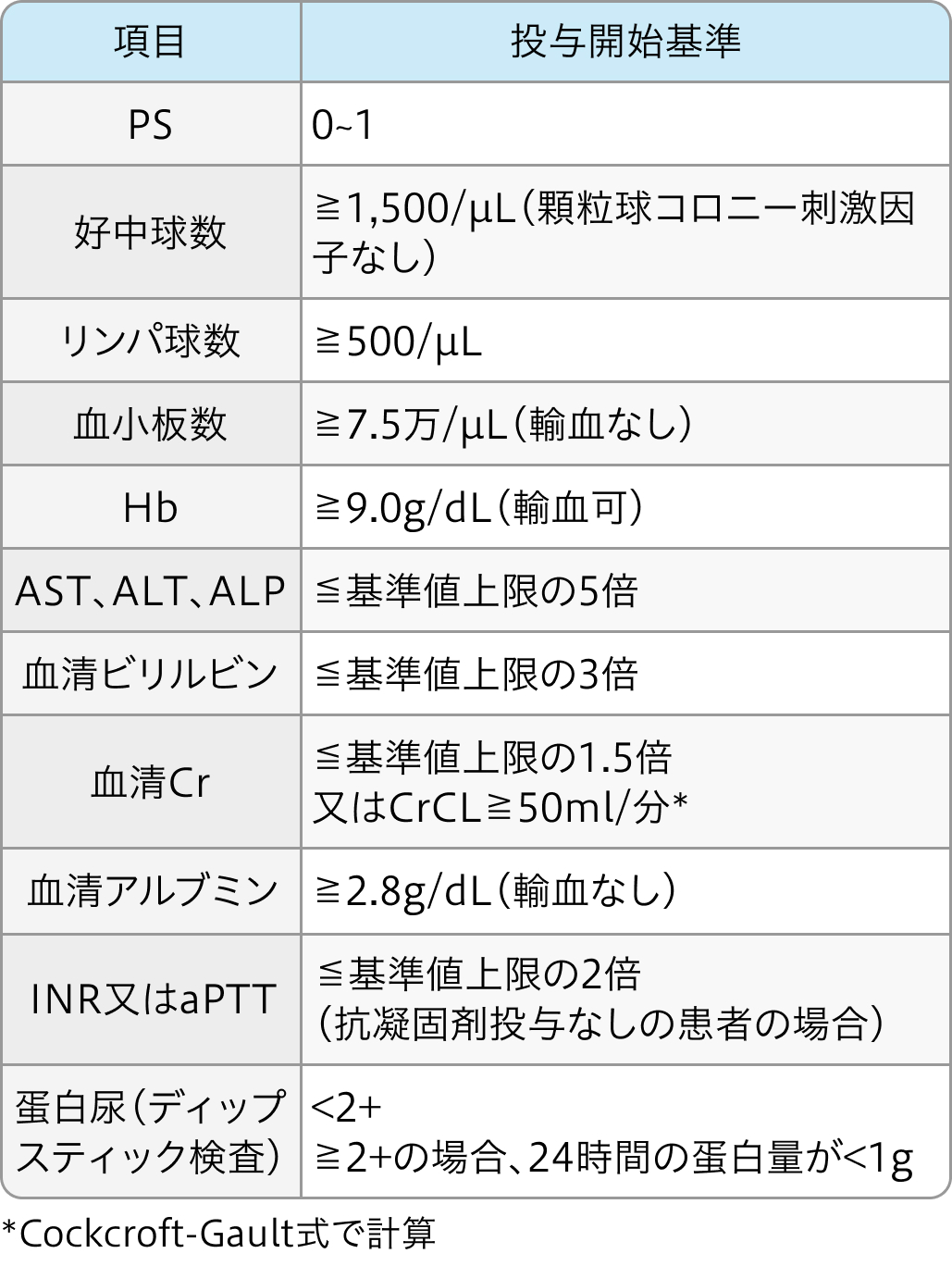
N Engl J Med. 2020 May 14;382(20):1894-1905⁴⁾より作図
休薬・中止基準
アテゾリズマブ電子添文¹⁾の基準
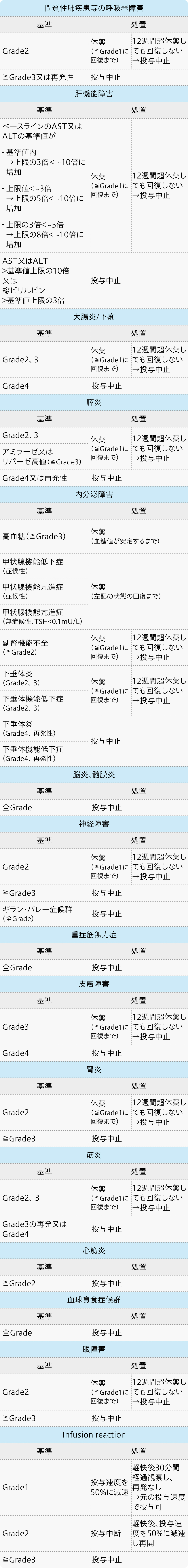
テセントリク®電子添文 (2024年7月改訂 第7版)¹⁾より作図
主な有害事象
IMbrave150試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 血小板数減少 10.6% (3.3%)
- 倦怠感 20.4% (2.4%)
- 下痢 18.8% (1.8%)
- 食欲減退 17.6% (1.2%)
- 発熱 17.9% (1.2%)
- 便秘 13.4% (0%)
- 腹痛 12.2% (1.2%)
- 嘔気 12.2% (0.3%)
- 体重減少 11.2% (0%)
- 無力症 6.7% (0.3%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧症 29.8% (15.2%)
- 蛋白尿 20.1% (3.0%)
- 脱毛症 1.2% (0%)
- 手足症候群 0.9% (0%)
N Engl J Med. 2020 May 14;382(20):1894-1905⁴⁾より引用
上手に使うためのワンポイント
血圧測定と尿検査が必要
IMbrave150試験⁴⁾では高血圧 (23.7%)、 蛋白尿 (18.8%) が高頻度に出現することが報告されており、 早期発見が必要
UPC比の活用
IMbrave150試験⁴⁾では尿蛋白2+が出現したときは24時間蓄尿を行い、 蛋白尿2g/24時間以上は休薬基準とされていた。 UPC比 (尿蛋白/クレアチニン比) は1日尿蛋白排泄量とよく相関することが知られており、 24時間蓄尿は実施が困難な場合にはUPC比で代用を積極的に検討する。
執筆 : 神奈川県立がんセンター 消化器内科 福島 泰斗先生
特徴と注意点
肝癌診療ガイドラインの扱い
切除不能肝細胞癌に対する一次薬物療法として推奨される化学療法レジメンである。
本レジメンは肝予備能が良好なChild-Pugh分類Aの症例に対して推奨され、 Child-Pugh分類A以外は臨床試験の対象外であり、 安全性が確認されていない。
ベバシズマブは出血リスク
ベバシズマブは出血のリスクを高める可能性があり、 レジメン開始前に上部消化管内視鏡検査を行い、 出血リスクのある静脈瘤を認めた場合は予防的処置を実施する必要がある。 活動性の心血管系疾患を合併する場合は投与を避ける。
執筆 : 神奈川県立がんセンター 消化器内科 福島 泰斗先生
関連する臨床試験|IMbrave150試験⁴⁾
全身治療歴のない局所進行転移性または切除不能な肝細胞癌患者において、 アテゾリズマブとベバシズマブの併用療法の効果を、 ソラフェニブ単剤投与を対照に検証した第Ⅲ相ランダム化比較試験IMbrave150の結果より、 全生存期間 (OS) と無増悪生存期間 (PFS) に対する有効性が示された。
OS中央値
- アテゾリズマブ+ベバシズマブ群 : 19.2ヵ月
(95%CI 17.0-23.7ヵ月)
- ソラフェニブ群 : 13.4ヵ月
(95%CI 11.4-16.9ヵ月)
HR 0.66 (95%CI 0.52-0.85)、 p<0.001
OS率 (6ヵ月、 12ヵ月、 18ヵ月)
- アテゾリズマブ+ベバシズマブ群 : 84.8%、 67%、 52%
- ソラフェニブ群 : 72.2%、 56%、 40%
PFS中央値
- アテゾリズマブ+ベバシズマブ群 : 6.9ヵ月
(95%CI 5.7-8.6ヵ月)
- ソラフェニブ群 : 4.3ヵ月
(95%CI 4.0-5.6ヵ月)
HR 0.65 (95%CI 0.53-0.81)、 p<0.001
ORR
- アテゾリズマブ+ベバシズマブ群 : 30%
(95%CI 25-35%)
- ソラフェニブ群 : 11%
(95%CI 7-17%)
p<0.001
サブグループ解析
- OSは、 肝細胞癌の原因が非ウイルス性の患者以外のサブグループで、 アテゾリズマブ+ベバシズマブ群で長かった。
- PFSとORRは、 肝細胞癌の原因が非ウイルス性の患者も含め、 全てのサブグループにおいてアテゾリズマブ+ベバシズマブ群が有効であった。
奏効期間 (中央値)
- アテゾリズマブ+ベバシズマブ群 : 18.1ヵ月
(95%CI 14.6ヵ月-NE)
- ソラフェニブ群 : 14.9ヵ月
(95%CI 4.9-17.0ヵ月)
患者報告アウトカム (QOL悪化までの期間中央値)
- アテゾリズマブ+ベバシズマブ群 : 11.2ヵ月
- ソラフェニブ群 : 3.6ヵ月
HR 0.63 (95%CI 0.46-0.85)
出典
- 中外製薬株式会社. テセントリク®電子添文 (2025年12月改訂 第12版)
- 中外製薬株式会社. テセントリク®適正使用ガイド (2025年12月改訂)
- 中外製薬株式会社. アバスチン®電子添文 (2025年4月改訂 第6版)
- Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020 May 14;382(20):1894-1905. PMID: 32402160
最終更新日 : 2026年1月7日
執筆医 : 神奈川県立がんセンター 消化器内科 福島 泰斗先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Atezolizumab + BV
Atezolizumab:Atezolizumab(テセントリク®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 1,200mg/body 点滴 | 1~ | Day1 |
BV:Bevacizumab(アバスチン®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 15mg/kg 点滴 | 1~ | Day1 |
その他
| 1コース21日間。 |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
テセントリク® (アテゾリズマブ)
抗PD-L1抗体 *中外製薬株式会社の外部サイトへ遷移します
アバスチン® (ベバシズマブ)
抗VEGF抗体 *中外製薬の外部サイトへ遷移します
用法用量
IMbrave150試験⁴⁾のプロトコル

N Engl J Med. 2020 May 14;382(20):1894-1905⁴⁾より作図
投与開始基準
IMbrave150試験⁴⁾のプロトコル
- 18歳以上
- 組織学的に確認された局所進行又は転移及び/又は切除不能なHCCを有する患者
- 肝硬変がある場合、 組織学的検査・細胞診又はAASLD基準に基づいて臨床的に確認された、 局所進行又は転移及び/又は切除不能なHCCを有する患者

N Engl J Med. 2020 May 14;382(20):1894-1905⁴⁾より作図
休薬・中止基準
アテゾリズマブ電子添文¹⁾の基準

テセントリク®電子添文 (2024年7月改訂 第7版)¹⁾より作図
主な有害事象
IMbrave150試験⁴⁾
主な有害事象 (カッコ内はGrade3~4)
- 血小板数減少 10.6% (3.3%)
- 倦怠感 20.4% (2.4%)
- 下痢 18.8% (1.8%)
- 食欲減退 17.6% (1.2%)
- 発熱 17.9% (1.2%)
- 便秘 13.4% (0%)
- 腹痛 12.2% (1.2%)
- 嘔気 12.2% (0.3%)
- 体重減少 11.2% (0%)
- 無力症 6.7% (0.3%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧症 29.8% (15.2%)
- 蛋白尿 20.1% (3.0%)
- 脱毛症 1.2% (0%)
- 手足症候群 0.9% (0%)
N Engl J Med. 2020 May 14;382(20):1894-1905⁴⁾より引用
上手に使うためのワンポイント
血圧測定と尿検査が必要
IMbrave150試験⁴⁾では高血圧 (23.7%)、 蛋白尿 (18.8%) が高頻度に出現することが報告されており、 早期発見が必要
UPC比の活用
IMbrave150試験⁴⁾では尿蛋白2+が出現したときは24時間蓄尿を行い、 蛋白尿2g/24時間以上は休薬基準とされていた。 UPC比 (尿蛋白/クレアチニン比) は1日尿蛋白排泄量とよく相関することが知られており、 24時間蓄尿は実施が困難な場合にはUPC比で代用を積極的に検討する。
執筆 : 神奈川県立がんセンター 消化器内科 福島 泰斗先生
特徴と注意点
肝癌診療ガイドラインの扱い
切除不能肝細胞癌に対する一次薬物療法として推奨される化学療法レジメンである。
本レジメンは肝予備能が良好なChild-Pugh分類Aの症例に対して推奨され、 Child-Pugh分類A以外は臨床試験の対象外であり、 安全性が確認されていない。
ベバシズマブは出血リスク
ベバシズマブは出血のリスクを高める可能性があり、 レジメン開始前に上部消化管内視鏡検査を行い、 出血リスクのある静脈瘤を認めた場合は予防的処置を実施する必要がある。 活動性の心血管系疾患を合併する場合は投与を避ける。
執筆 : 神奈川県立がんセンター 消化器内科 福島 泰斗先生
関連する臨床試験|IMbrave150試験⁴⁾
全身治療歴のない局所進行転移性または切除不能な肝細胞癌患者において、 アテゾリズマブとベバシズマブの併用療法の効果を、 ソラフェニブ単剤投与を対照に検証した第Ⅲ相ランダム化比較試験IMbrave150の結果より、 全生存期間 (OS) と無増悪生存期間 (PFS) に対する有効性が示された。
OS中央値
- アテゾリズマブ+ベバシズマブ群 : 19.2ヵ月
(95%CI 17.0-23.7ヵ月)
- ソラフェニブ群 : 13.4ヵ月
(95%CI 11.4-16.9ヵ月)
HR 0.66 (95%CI 0.52-0.85)、 p<0.001
OS率 (6ヵ月、 12ヵ月、 18ヵ月)
- アテゾリズマブ+ベバシズマブ群 : 84.8%、 67%、 52%
- ソラフェニブ群 : 72.2%、 56%、 40%
PFS中央値
- アテゾリズマブ+ベバシズマブ群 : 6.9ヵ月
(95%CI 5.7-8.6ヵ月)
- ソラフェニブ群 : 4.3ヵ月
(95%CI 4.0-5.6ヵ月)
HR 0.65 (95%CI 0.53-0.81)、 p<0.001
ORR
- アテゾリズマブ+ベバシズマブ群 : 30%
(95%CI 25-35%)
- ソラフェニブ群 : 11%
(95%CI 7-17%)
p<0.001
サブグループ解析
- OSは、 肝細胞癌の原因が非ウイルス性の患者以外のサブグループで、 アテゾリズマブ+ベバシズマブ群で長かった。
- PFSとORRは、 肝細胞癌の原因が非ウイルス性の患者も含め、 全てのサブグループにおいてアテゾリズマブ+ベバシズマブ群が有効であった。
奏効期間 (中央値)
- アテゾリズマブ+ベバシズマブ群 : 18.1ヵ月
(95%CI 14.6ヵ月-NE)
- ソラフェニブ群 : 14.9ヵ月
(95%CI 4.9-17.0ヵ月)
患者報告アウトカム (QOL悪化までの期間中央値)
- アテゾリズマブ+ベバシズマブ群 : 11.2ヵ月
- ソラフェニブ群 : 3.6ヵ月
HR 0.63 (95%CI 0.46-0.85)
出典
- 中外製薬株式会社. テセントリク®電子添文 (2025年12月改訂 第12版)
- 中外製薬株式会社. テセントリク®適正使用ガイド (2025年12月改訂)
- 中外製薬株式会社. アバスチン®電子添文 (2025年4月改訂 第6版)
- Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med. 2020 May 14;382(20):1894-1905. PMID: 32402160
最終更新日 : 2026年1月7日
執筆医 : 神奈川県立がんセンター 消化器内科 福島 泰斗先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
