Regorafenib:Regorafenib(スチバーガ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 160mg/日 分1 経口 | 1~ | Day1~21 |
その他
| 1コース28日間 (3週間投与、 1週休薬) |
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*バイエル薬品株式会社の外部サイトへ遷移します
用法用量
RESORCE試験³⁾のプロトコル

Lancet. 2017 Jan 7;389(10064):56-66³⁾より作図
投与開始基準
RESORCE試験³⁾のプロトコル
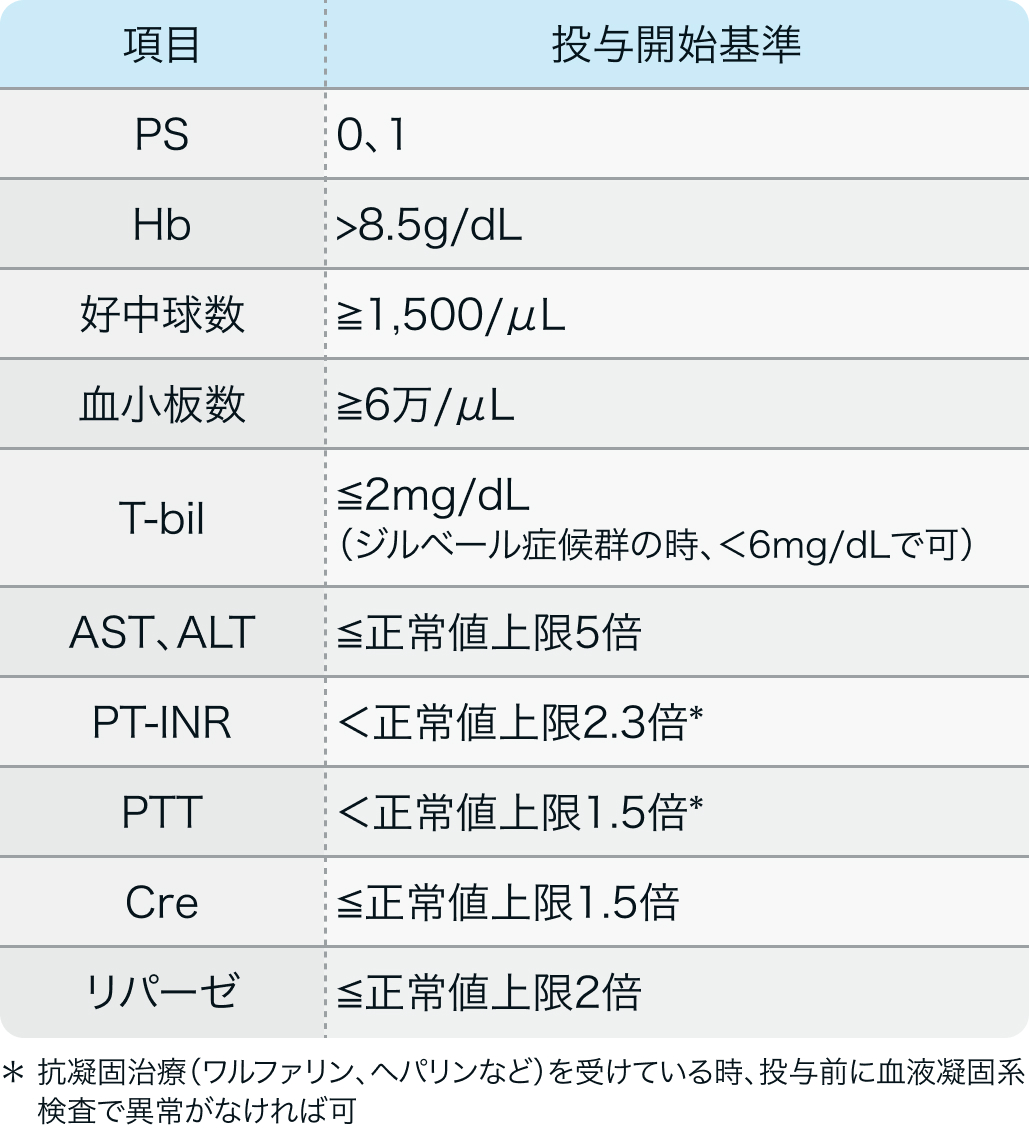
スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
減量・休薬・中止基準
適正使用ガイド²⁾の基準

レゴラフェニブはUGT1A1によるグルクロン酸抱合を阻害する。
そのため、 ジルベール症候群の患者においては間接型ビリルビンが上昇することがあり、 ASTまたはALTの上昇を認めた場合はビリルビン値の基準によらず、 上図で規定するASTまたはALTの基準に従う
スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
初回基準量と減量レベル

スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
主な有害事象
RESORCE試験試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 手足症候群 52.4% (12.6%)
- 下痢 33.4% (2.4%)
- 疲労 29.4% (6.4%)
- 高血圧 23.3% (13.1%)
- 食欲不振 23.5% (2.7%)
- 血中ビリルビン増加 18.7% (6.7%)
- 腹痛 9.1% (1.3%)
- AST増加 12.8% (5.1%)
- 発熱 3.7% (0%)
- 悪心 10.7% (0.3%)
- 便秘 6.4% (0%)
- 腹水 2.1% (0.8%)
- 貧血 6.1% (1.6%)
- 四肢浮腫 3.2% (0.3%)
- ALT増加 7.8% (2.1%)
- 低アルブミン血症 2.4% (0.5%)
- その他の全身障害および投与部位状態 2.1% (1.3%)
- 体重減少 7.2% (1.1%)
- 口腔粘膜炎 11.2% (1.1%)
- 嘔吐 7.2% (0.3%)
- その他の検査値異常 4.8% (0.3%)
- 背部痛 0.5% (0.3%)
- 血小板減少症 5.1% (2.1%)
- 咳 1.1% (0%)
- 低リン酸血症 5.9% (4.8%)
- 嗄声 9.1% (0%)
Lancet. 2017 Jan 7;389(10064):56-66³⁾より引用
上手に使うためのワンポイント
RESORCE試験³⁾はソラフェニブに忍容性がありかつ抵抗性の Child-Pugh Aを対象とした試験である。 サブ解析において前治療であるソラフェニブ開始時点のChildは5点の方が6点よりも有意に本レジメンの予後が良好であった。 したがって本レジメンを有効に使用するためには前治療のソラフェニブを肝予備能の良い状態で始める必要がある。
RESORCE試験³⁾での主な副作用の発現率は,手掌・足底発赤知覚不全症候群51.1%、 下痢33.7%、 食欲減退23. 5%、 高血圧23.3%、 疲労21.4%であった。 前治療ソラフェニブの副作用の再現性が比較的高いため前治療から引き続いて対策を行い、 減量、 休薬を行うことで対応できる場合が多い。 特に手足症候群ではあらかじめ保湿、 刺激除去、 角質処理をすることが重要である。
執筆医:九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
特徴と注意点
本レジメンは切除不能肝細胞癌に対するソラフェニブ後の二次治療としてRESORCE試験³⁾においてプラセボに対して優越性を示し最初に承認された。 本薬剤はソラフェニブにフッ素が結合したもので毒性のプロファイルもソラフェニブと酷似しているためRESORCE試験¹⁾ではソラフェニブ不耐症例を除きソラフェニブに十分認容性がある (病勢進行前の28日間に20日以上ソラフェニブ400mg以上を内服できている) 症例のみを対象としていることに注意が必要である。
1日1回160mgを3週間投与1週間休薬という投与スケジュールであり他の薬剤のように連日投与でないことにも気をつける必要がある。 また空腹時及び高脂肪食後の投与はAUC、 Cmaxを低下させるため避けることとされている。
執筆 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
関連する臨床試験
RESORCE試験³⁾
Sorafenib治療中に増悪した肝細胞癌患者573例に対するRegorafenibの有効性と安全性を検証する国際共同プラセボ対照二重盲検第III相試験。 主要評価項目はOS、 副次評価項目はPFS、 TTP (time to progression)、 奏効率、 病勢コントロール率に設定された。
Lancet. 2017 Jan 7;389(10064):56-66.
出典
- バイエル薬品株式会社. スチバーガ®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/6/14]
- バイエル薬品株式会社. スチバーガ®適正使用ガイド (2020年3月作成) [最終閲覧 : 2024/6/14]
- Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017 Jan 7;389(10064):56-66. PMID: 27932229
最終更新日 : 2024年8月21日
執筆医 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
Regorafenib
Regorafenib:Regorafenib(スチバーガ®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 160mg/日 分1 経口 | 1~ | Day1~21 |
その他
| 1コース28日間 (3週間投与、 1週休薬) |
概要
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*バイエル薬品株式会社の外部サイトへ遷移します
用法用量
RESORCE試験³⁾のプロトコル

Lancet. 2017 Jan 7;389(10064):56-66³⁾より作図
投与開始基準
RESORCE試験³⁾のプロトコル

スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
減量・休薬・中止基準
適正使用ガイド²⁾の基準

レゴラフェニブはUGT1A1によるグルクロン酸抱合を阻害する。
そのため、 ジルベール症候群の患者においては間接型ビリルビンが上昇することがあり、 ASTまたはALTの上昇を認めた場合はビリルビン値の基準によらず、 上図で規定するASTまたはALTの基準に従う
スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
初回基準量と減量レベル

スチバーガ®適正使用ガイド (2020年3月作成)²⁾より作図
主な有害事象
RESORCE試験試験³⁾
主な有害事象 (カッコ内はGrade3~4)
- 手足症候群 52.4% (12.6%)
- 下痢 33.4% (2.4%)
- 疲労 29.4% (6.4%)
- 高血圧 23.3% (13.1%)
- 食欲不振 23.5% (2.7%)
- 血中ビリルビン増加 18.7% (6.7%)
- 腹痛 9.1% (1.3%)
- AST増加 12.8% (5.1%)
- 発熱 3.7% (0%)
- 悪心 10.7% (0.3%)
- 便秘 6.4% (0%)
- 腹水 2.1% (0.8%)
- 貧血 6.1% (1.6%)
- 四肢浮腫 3.2% (0.3%)
- ALT増加 7.8% (2.1%)
- 低アルブミン血症 2.4% (0.5%)
- その他の全身障害および投与部位状態 2.1% (1.3%)
- 体重減少 7.2% (1.1%)
- 口腔粘膜炎 11.2% (1.1%)
- 嘔吐 7.2% (0.3%)
- その他の検査値異常 4.8% (0.3%)
- 背部痛 0.5% (0.3%)
- 血小板減少症 5.1% (2.1%)
- 咳 1.1% (0%)
- 低リン酸血症 5.9% (4.8%)
- 嗄声 9.1% (0%)
Lancet. 2017 Jan 7;389(10064):56-66³⁾より引用
上手に使うためのワンポイント
RESORCE試験³⁾はソラフェニブに忍容性がありかつ抵抗性の Child-Pugh Aを対象とした試験である。 サブ解析において前治療であるソラフェニブ開始時点のChildは5点の方が6点よりも有意に本レジメンの予後が良好であった。 したがって本レジメンを有効に使用するためには前治療のソラフェニブを肝予備能の良い状態で始める必要がある。
RESORCE試験³⁾での主な副作用の発現率は,手掌・足底発赤知覚不全症候群51.1%、 下痢33.7%、 食欲減退23. 5%、 高血圧23.3%、 疲労21.4%であった。 前治療ソラフェニブの副作用の再現性が比較的高いため前治療から引き続いて対策を行い、 減量、 休薬を行うことで対応できる場合が多い。 特に手足症候群ではあらかじめ保湿、 刺激除去、 角質処理をすることが重要である。
執筆医:九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
特徴と注意点
本レジメンは切除不能肝細胞癌に対するソラフェニブ後の二次治療としてRESORCE試験³⁾においてプラセボに対して優越性を示し最初に承認された。 本薬剤はソラフェニブにフッ素が結合したもので毒性のプロファイルもソラフェニブと酷似しているためRESORCE試験¹⁾ではソラフェニブ不耐症例を除きソラフェニブに十分認容性がある (病勢進行前の28日間に20日以上ソラフェニブ400mg以上を内服できている) 症例のみを対象としていることに注意が必要である。
1日1回160mgを3週間投与1週間休薬という投与スケジュールであり他の薬剤のように連日投与でないことにも気をつける必要がある。 また空腹時及び高脂肪食後の投与はAUC、 Cmaxを低下させるため避けることとされている。
執筆 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
関連する臨床試験
RESORCE試験³⁾
Sorafenib治療中に増悪した肝細胞癌患者573例に対するRegorafenibの有効性と安全性を検証する国際共同プラセボ対照二重盲検第III相試験。 主要評価項目はOS、 副次評価項目はPFS、 TTP (time to progression)、 奏効率、 病勢コントロール率に設定された。
Lancet. 2017 Jan 7;389(10064):56-66.
出典
- バイエル薬品株式会社. スチバーガ®電子添文 (2024年2月改訂 第3版) [最終閲覧 : 2024/6/14]
- バイエル薬品株式会社. スチバーガ®適正使用ガイド (2020年3月作成) [最終閲覧 : 2024/6/14]
- Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017 Jan 7;389(10064):56-66. PMID: 27932229
最終更新日 : 2024年8月21日
執筆医 : 九州がんセンター 消化器・肝胆膵内科部長 杉本理恵 先生
監修医 : 神奈川県立がんセンター 消化器内科 上野 誠先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
