本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
*エーザイ株式会社の外部サイトへ遷移します
投与スケジュール
電子添文の用法及び用量
1コース3週間
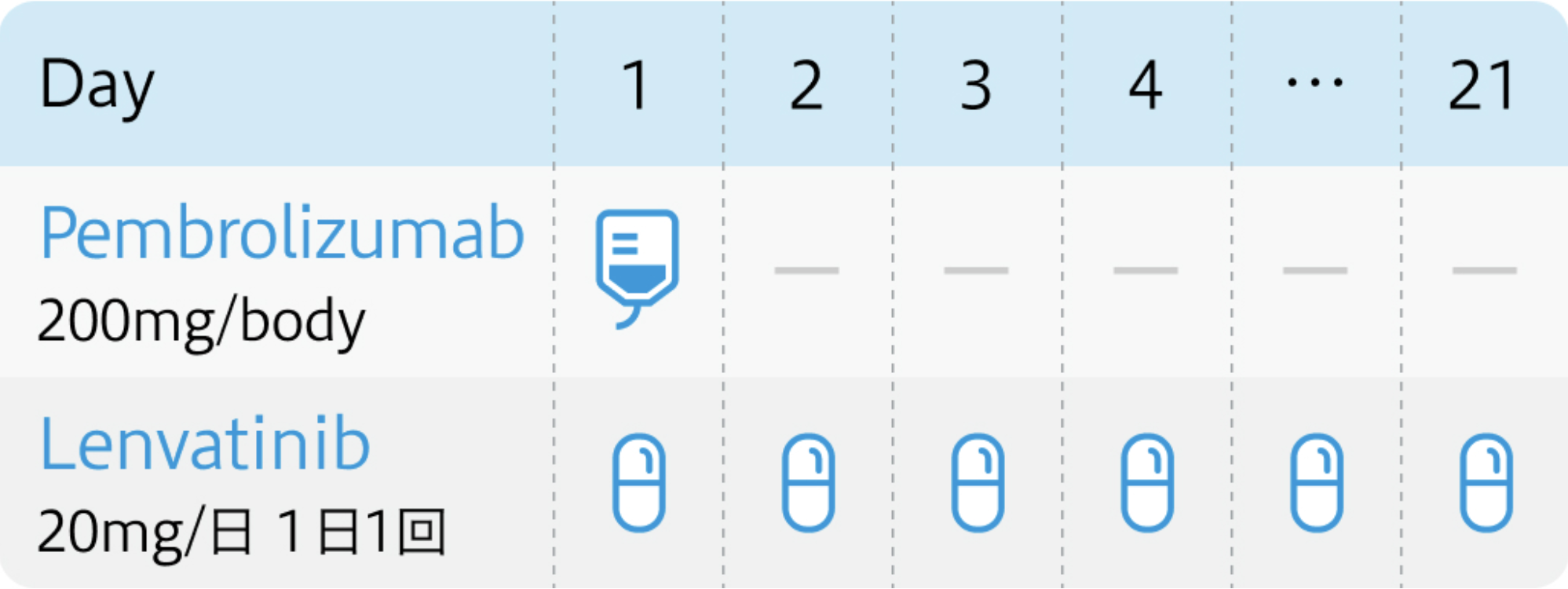
キイトルーダ®電子添文 (2024年5月改訂 第16版)¹⁾、 レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
1コース6週間
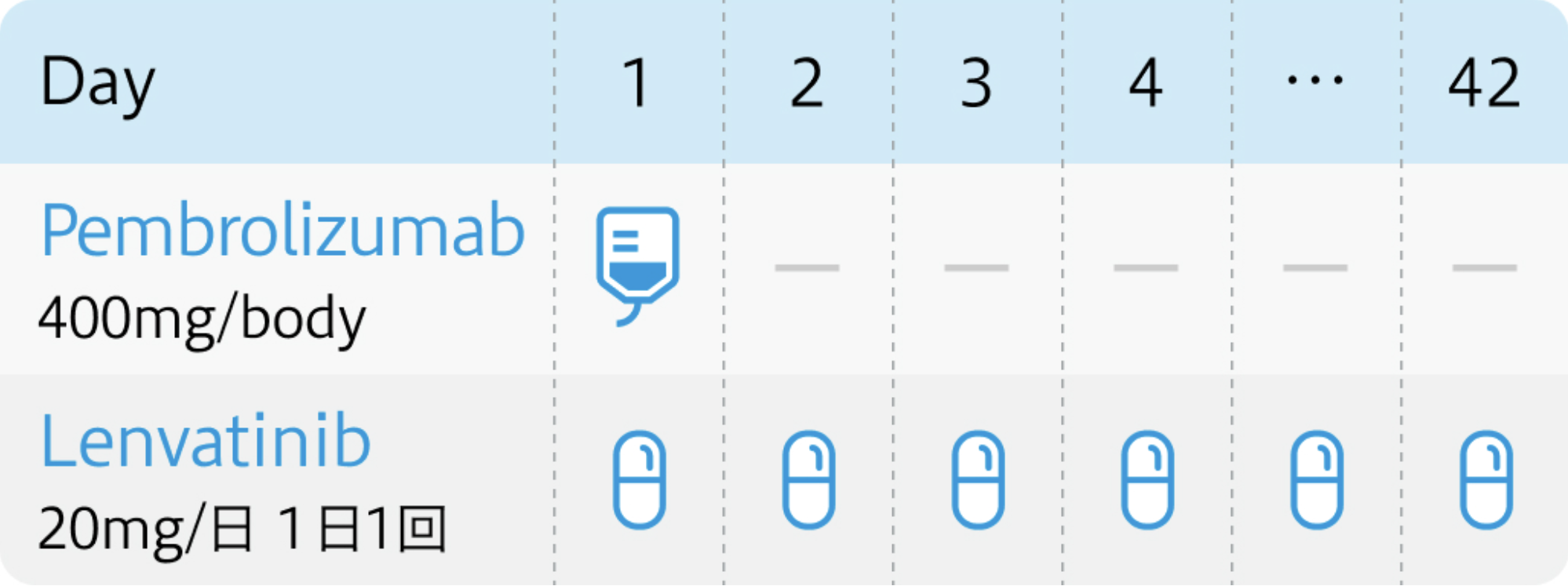
キイトルーダ®電子添文 (2024年5月改訂 第18版)¹⁾、 レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
特徴と注意点
血管新生阻害薬を用いた免疫併用療法で最後に承認されたレジメンであり (2022年2月25日)、 CLEAR試験⁵⁾においてスニチニブと比較しPFS、 OS、 RRの改善があった。
ペムブロリズマブと併用するレンバチニブの初回投与量は20mgであるため、 投与初期から注意深い副作用マネジメントが必要である。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
CLEAR試験⁵⁾
化学療法未治療の根治切除不能又は転移性腎細胞癌患者1,069例を対象としたペムブロリズマブ+レンバチニブ併用又はレンバチニブ+エベロリムス併用とスニチニブ単独の有効性及び安全性を比較検討するための国際共同無作為化非盲検第Ⅲ相試験。 結果、 無増悪生存期間 (PFS) 及び全生存期間 (OS) に対するレンバチニブとペムブロリズマブの併用投与の有益性が示された。
PFS中央値 (95%CI)
- PEM+LEN群 : 23.9ヵ月 (20.8-27.7)
- HR 0.39 (0.32-0.49)、 P<0.001
スニチニブ群に対して
- LEN+EVE群 : 14.7ヵ月 (11.1-16.7)
- HR 0.65 (0.53-0.80)、 P<0.001
スニチニブ群に対して
- スニチニブ群 : 9.2ヵ月 (6.0-11.0)
追加報告のPFS中央値
- PEM + LEN群 : 23.3ヵ月 (20.8-27.7)
- スニチニブ群 : 9.2ヵ月 (6.0-11.0)
HR 0.42 (95%CI 0.34-0.52)
OS中央値 (95%CI)
初回報告時、 両群いずれも未到達だった。
- PEM+LEN群 vs スニチニブ群 HR 0.66 (0.49-0.88)、 P=0.005
- LEN+EVE群 vs スニチニブ群 HR 1.15 (0.88-1.50)、 P=0.30
追加報告のOS中央値
- PEM+LEN群 : 未到達 (41.5ヵ月-推定不能)
- スニチニブ群 : 未到達 (38.4ヵ月-推定不能)
HR 0.72 (95%CI 0.55-0.93)
OS率 [1年時、 1.5年時、 2年時、 3年時]
- PEM+LEN群 : 91.4、 86.9、 80.2、 65.5%
- LEN+EVE群 : 66.1% *2年時のみ
- スニチニブ群 : 80.2、 73.8、 69.7、 61.8%
ORR (95%CI)、 うち完全奏効率
- PEM+LEN群 : 71.0% (66.3-75.7%)、16.1%
- LEN+EVE群 : 53.5% (48.3-58.7%)、9.8%
- スニチニブ群 : 36.1% (31.2-41.1%)、4.2%
奏効期間中央値 (95%CI)
- PEM+LEN群 : 25.8ヵ月 (22.1-27.9ヵ月)
- LEN+EVE群 : 16.6ヵ月 (14.6-20.6ヵ月)
- スニチニブ群 14.6ヵ月 : (9.4-16.7ヵ月)
主な有害事象 (カッコ内はGrade3~4)
- 貧血 5.7% (0.9%)
- 血小板数減少 5.7% (0.9%)
- 血小板減少症 3.7% (0.3%)
- 白血球数減少 2.8% (0.3%)
- 好中球数減少 2.3% (1.7%)
- 好中球減少症 2.3% (0.3%)
- 白血球減少症 1.1% (0%)
- 下痢 54.5% (8.2%)
- 食欲減退 34.9% (3.4%)
- 疲労 32.1% (3.1%)
- 口内炎 32.1% (1.7%)
- 悪心 26.7% (1.7%)
- 嘔吐 15.9% (1.4%)
- 便秘 6.8% (0.3%)
- 発熱 4.5% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧 52.3% (25.3%)
- 甲状腺機能低下症 42.6% (1.1%)
- 手掌足底発赤知覚不全症候群 28.1% (4.0%)
- 蛋白尿 27.6% (7.4%)
- 甲状腺機能亢進症 6.3% (0%)
N Engl J Med. 2021 Apr 8;384(14):1289-1300⁵⁾より引用
各プロトコル
投与開始基準
CLEAR試験⁵⁾のプロトコル
局所進行性または転移性の淡明細胞型腎細胞がんの組織学的または細胞学的診断のある18歳以上の患者で以下を満たすもの
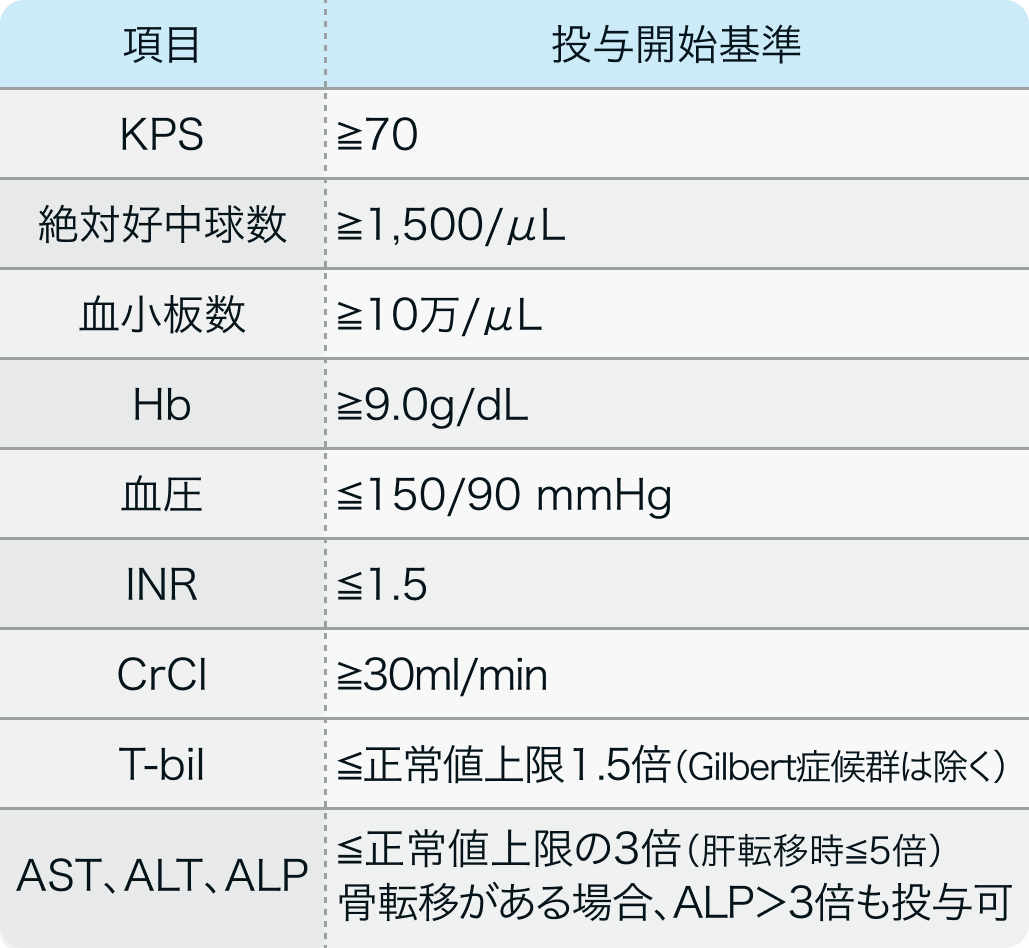
N Engl J Med. 2021 Apr 8;384(14):1289-1300⁵⁾より作図
減量・休薬・中止基準
ペムブロリズマブ電子添文¹⁾の基準

キイトルーダ®電子添文 (2024年5月改訂 第18版)¹⁾より作図
レンバチニブ電子添文³⁾の基準
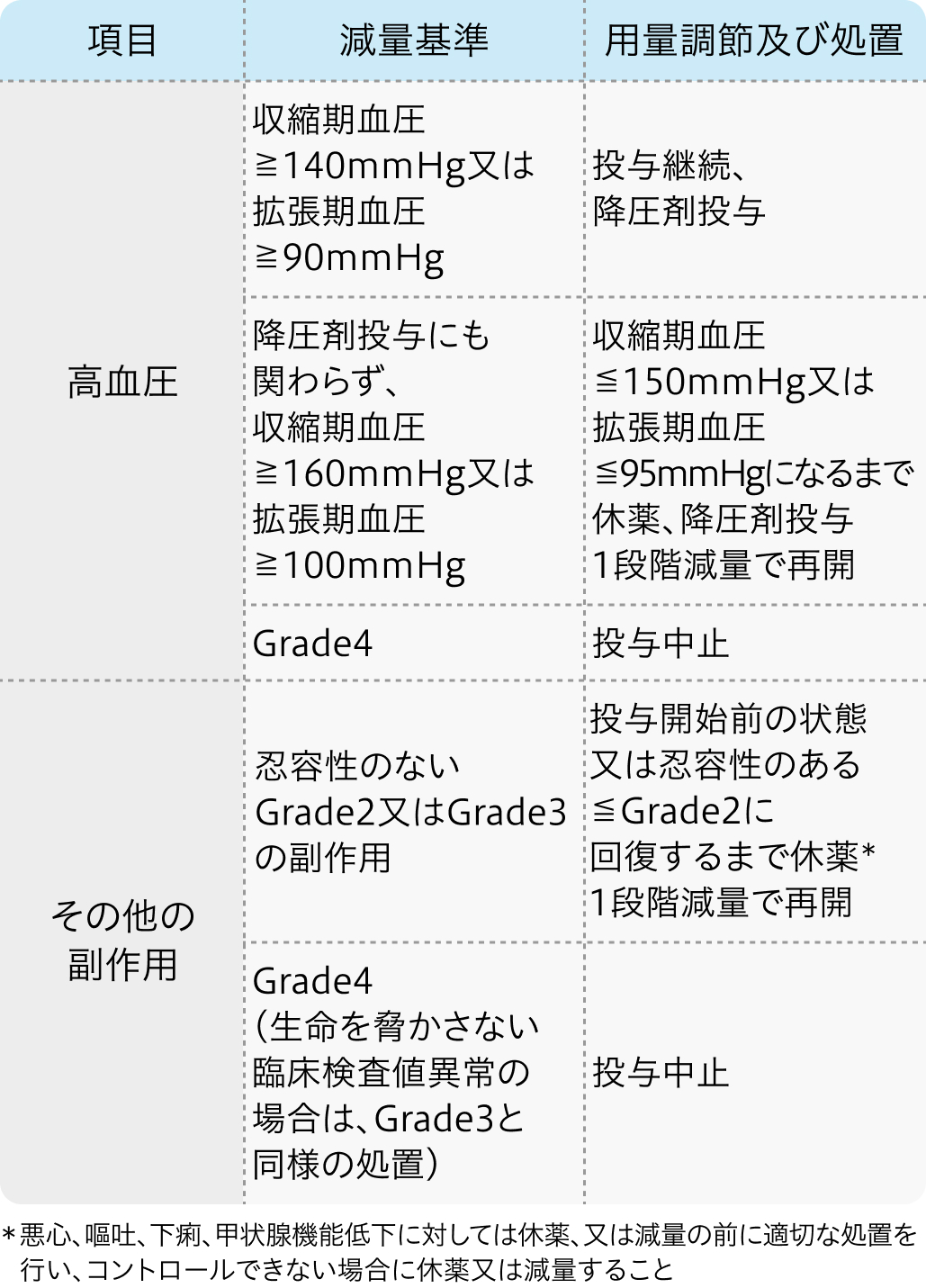
レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
初回基準量と減量レベル

レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
出典
- MSD製薬. キイトルーダ®電子添文 (2024年5月改訂 第18版) [最終閲覧 : 2024/07/01]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/07/01]
- エーザイ株式会社. レンビマ®電子添文 (2024年2月改訂 第5版) [最終閲覧 : 2024/03/14]
- エーザイ株式会社. レンビマ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/03/14]
- N Engl J Med. 2021;384:1289–1300.
最終更新日 : 2024年8月29日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
Pembrolizumab + Lenvatinib
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
*MSD製薬の外部サイトへ遷移します
*エーザイ株式会社の外部サイトへ遷移します
投与スケジュール
電子添文の用法及び用量
1コース3週間

キイトルーダ®電子添文 (2024年5月改訂 第16版)¹⁾、 レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
1コース6週間

キイトルーダ®電子添文 (2024年5月改訂 第18版)¹⁾、 レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
特徴と注意点
血管新生阻害薬を用いた免疫併用療法で最後に承認されたレジメンであり (2022年2月25日)、 CLEAR試験⁵⁾においてスニチニブと比較しPFS、 OS、 RRの改善があった。
ペムブロリズマブと併用するレンバチニブの初回投与量は20mgであるため、 投与初期から注意深い副作用マネジメントが必要である。
監修 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
KeyData|臨床試験結果
CLEAR試験⁵⁾
化学療法未治療の根治切除不能又は転移性腎細胞癌患者1,069例を対象としたペムブロリズマブ+レンバチニブ併用又はレンバチニブ+エベロリムス併用とスニチニブ単独の有効性及び安全性を比較検討するための国際共同無作為化非盲検第Ⅲ相試験。 結果、 無増悪生存期間 (PFS) 及び全生存期間 (OS) に対するレンバチニブとペムブロリズマブの併用投与の有益性が示された。
PFS中央値 (95%CI)
- PEM+LEN群 : 23.9ヵ月 (20.8-27.7)
- HR 0.39 (0.32-0.49)、 P<0.001
スニチニブ群に対して
- LEN+EVE群 : 14.7ヵ月 (11.1-16.7)
- HR 0.65 (0.53-0.80)、 P<0.001
スニチニブ群に対して
- スニチニブ群 : 9.2ヵ月 (6.0-11.0)
追加報告のPFS中央値
- PEM + LEN群 : 23.3ヵ月 (20.8-27.7)
- スニチニブ群 : 9.2ヵ月 (6.0-11.0)
HR 0.42 (95%CI 0.34-0.52)
OS中央値 (95%CI)
初回報告時、 両群いずれも未到達だった。
- PEM+LEN群 vs スニチニブ群 HR 0.66 (0.49-0.88)、 P=0.005
- LEN+EVE群 vs スニチニブ群 HR 1.15 (0.88-1.50)、 P=0.30
追加報告のOS中央値
- PEM+LEN群 : 未到達 (41.5ヵ月-推定不能)
- スニチニブ群 : 未到達 (38.4ヵ月-推定不能)
HR 0.72 (95%CI 0.55-0.93)
OS率 [1年時、 1.5年時、 2年時、 3年時]
- PEM+LEN群 : 91.4、 86.9、 80.2、 65.5%
- LEN+EVE群 : 66.1% *2年時のみ
- スニチニブ群 : 80.2、 73.8、 69.7、 61.8%
ORR (95%CI)、 うち完全奏効率
- PEM+LEN群 : 71.0% (66.3-75.7%)、16.1%
- LEN+EVE群 : 53.5% (48.3-58.7%)、9.8%
- スニチニブ群 : 36.1% (31.2-41.1%)、4.2%
奏効期間中央値 (95%CI)
- PEM+LEN群 : 25.8ヵ月 (22.1-27.9ヵ月)
- LEN+EVE群 : 16.6ヵ月 (14.6-20.6ヵ月)
- スニチニブ群 14.6ヵ月 : (9.4-16.7ヵ月)
主な有害事象 (カッコ内はGrade3~4)
- 貧血 5.7% (0.9%)
- 血小板数減少 5.7% (0.9%)
- 血小板減少症 3.7% (0.3%)
- 白血球数減少 2.8% (0.3%)
- 好中球数減少 2.3% (1.7%)
- 好中球減少症 2.3% (0.3%)
- 白血球減少症 1.1% (0%)
- 下痢 54.5% (8.2%)
- 食欲減退 34.9% (3.4%)
- 疲労 32.1% (3.1%)
- 口内炎 32.1% (1.7%)
- 悪心 26.7% (1.7%)
- 嘔吐 15.9% (1.4%)
- 便秘 6.8% (0.3%)
- 発熱 4.5% (0%)
注意すべき有害事象 (カッコ内はGrade3~4)
- 高血圧 52.3% (25.3%)
- 甲状腺機能低下症 42.6% (1.1%)
- 手掌足底発赤知覚不全症候群 28.1% (4.0%)
- 蛋白尿 27.6% (7.4%)
- 甲状腺機能亢進症 6.3% (0%)
N Engl J Med. 2021 Apr 8;384(14):1289-1300⁵⁾より引用
各プロトコル
投与開始基準
CLEAR試験⁵⁾のプロトコル
局所進行性または転移性の淡明細胞型腎細胞がんの組織学的または細胞学的診断のある18歳以上の患者で以下を満たすもの

N Engl J Med. 2021 Apr 8;384(14):1289-1300⁵⁾より作図
減量・休薬・中止基準
ペムブロリズマブ電子添文¹⁾の基準

キイトルーダ®電子添文 (2024年5月改訂 第18版)¹⁾より作図
レンバチニブ電子添文³⁾の基準

レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
初回基準量と減量レベル

レンビマ®電子添文 (2024年2月改訂 第5版)³⁾より作図
出典
- MSD製薬. キイトルーダ®電子添文 (2024年5月改訂 第18版) [最終閲覧 : 2024/07/01]
- MSD製薬. キイトルーダ®適正使用ガイド (2024年5月作成) [最終閲覧 : 2024/07/01]
- エーザイ株式会社. レンビマ®電子添文 (2024年2月改訂 第5版) [最終閲覧 : 2024/03/14]
- エーザイ株式会社. レンビマ®適正使用ガイド (2024年2月作成) [最終閲覧 : 2024/03/14]
- N Engl J Med. 2021;384:1289–1300.
最終更新日 : 2024年8月29日
監修医師 : 国立がん研究センター東病院 腫瘍内科 近藤 千紘先生
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。