治療スケジュール
概要
監修医師
Valemetostat:バレメトスタット(エザルミア®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg 1日1回 経口 (空腹時) | 1~ | Day 1~ |
その他
| 強いCYP3A阻害剤やP糖蛋白阻害剤との併用時は用量調節を行う (概要欄参照) |
| 副作用発現時は、 休薬、 減量又は中止 (概要欄参照) |
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
J201試験¹⁾ より引用 (適正使用ガイド²⁾ の情報を参照し作成)
骨髄抑制
- 血小板減少 (80%、 ≧Grade3 32%)
- 貧血 (52%、 ≧Grade3 32%)
- 好中球減少 (28%、 ≧Grade3 12%)
- リンパ球減少 (24%、 ≧Grade3 16%)
- 白血球減少 (20%、 ≧Grade3 12%)
- 発熱性好中球減少症 (8%、 ≧Grade3 8%)
主な有害事象
- 脱毛症 (40%)
- 味覚不全 (36%)
- 食欲減退 (16%)
- 倦怠感 (12%)
- 口内炎 (12%)
その他重要な有害事象
感染症
- CMV感染再燃 (8%、 ≧Grade3 4%)
- CMV血症 (8%)
- CMV性脈絡網膜炎 (4%、 ≧Grade3 4%)
- 肺炎 (4%、 ≧Grade3 4%)
- 股部白癬 (4%)
代謝及び栄養障害
- 低亜鉛血症 (8%)
- 低アルブミン血症 (4%)
- 低リン血症 (4%)
- 高カルシウム血症 (4%)
- 亜鉛欠乏 (4%)
胃腸障害
- 悪心 (8%)
- 下部消化管出血 (4%、 ≧Grade3 4%)
- 下痢 (4%)
- 腹部不快感 (4%)
- 腹部膨満 (4%)
その他
- 疲労 (8%)
- 発熱 (8%)
- ALT増加 (8%)
- 皮膚乾燥 (8%)
- 肝機能異常 (4%、 ≧Grade3 4%)
- 急性腎障害 (4%、 ≧Grade3 4%)
- 慢性腎臓病 (4%、 ≧Grade3 4%)
- 感覚鈍麻 (4%)
- 心不全 (4%)
- 高血圧 (4%)
- 四肢静脈血栓症 (4%)
- 肺出血 (4%)
- 発疹 (4%)
- 多形紅斑 (4%)
- 湿疹 (4%)
- 爪の障害 (4%)
- 紅斑性皮疹 (4%)
- 蛋白尿 (4%)
- AST増加 (4%)
- QT延長 (4%)
- 体重減少 (4%)
- ヘモグロビン減少 (4%)
特徴と注意点
- 本剤はエピジェネティクス*領域の低分子医薬品で、 EZH1及びEZH2を選択的に阻害する.
*DNA配列の変化を伴わない遺伝子発現変化を誘導する分子メカニズム
- EZH1及びEZH2は、 多くの血液がんで発現しているヒストンメチル化酵素 (H3K27トリメチル化酵素)であり、 がん抑制遺伝子の不活性化に関係.
- 再発又は難治性の成人T細胞白血病・リンパ腫の標準治療レジメンは確立されておらず、 モガムリズマブ治療歴を有する患者を含めた臨床試験の結果から、 臨床的に意義のある選択肢の一つとなりうる.
- 食後投与はCmax及びAUC低下の報告があるため、 空腹時に投与 (食事の1時間前から食後2時間までの間の服用は避ける).
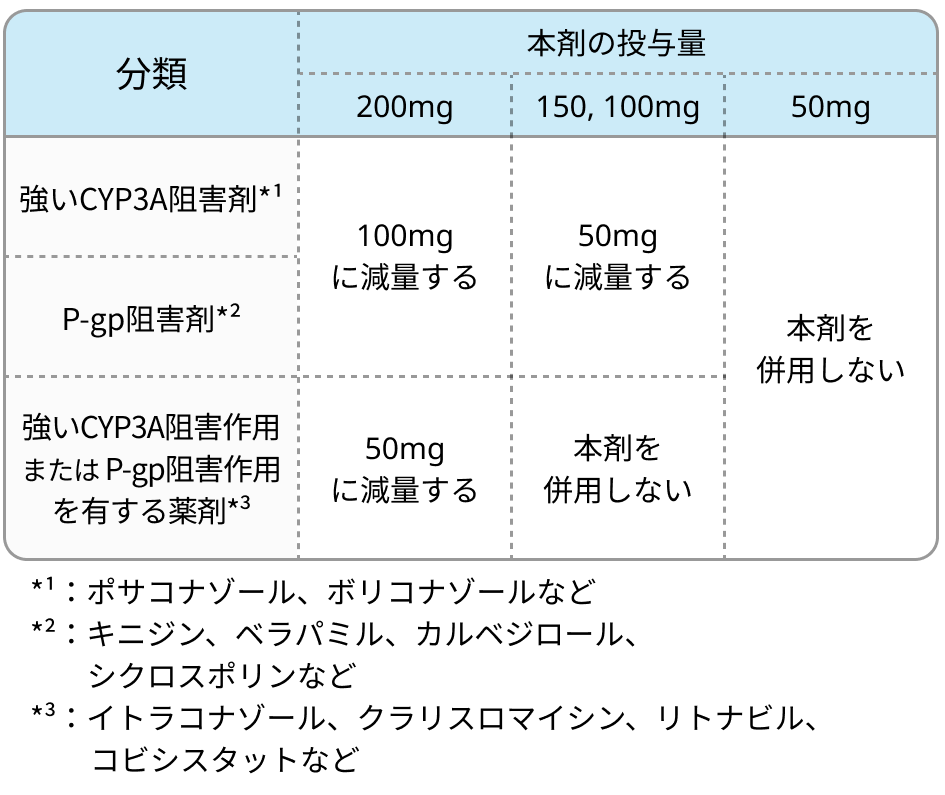
- 本剤の血中濃度上昇リスクとなるため、 強いCYP3A阻害薬やP糖蛋白 (P-gp) 阻害薬との併用に注意.
- 動物実験において、 胚・胎児毒性 (着床後胚損失率の高値) 及び催奇形性の報告あり、 投与中及び最終投与後2週間は適切な避妊を行うよう指導.
CYP3A阻害剤やP-gp阻害剤と併用時の用量調節
感染対策
- ニューモシスチス・イロベチイ:ST合剤及び同等の効能/効果を有する薬剤による予防投与を推奨.
- その他の感染症 (HBV、 CMV、 VZV、 結核):J201試験では規定なし. 担当医の判断で検討.
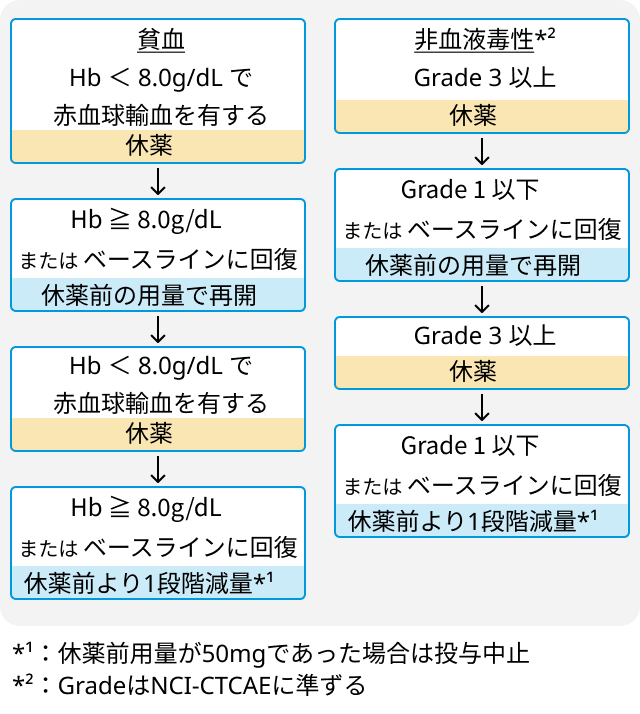
副作用と対策

関連する臨床試験の結果
J201試験¹⁾
概要
- 国内第2相試験.
- 再発又は難治性の成人T細胞白血病リンパ腫患者25例を対象.
- 疾患が進行するか、 許容できない毒性が現れるまでバレメトスタット200mg/日を投与.
- 主要評価項目:ORR
- 副次評価項目:疾患領域における最良の奏効、 DOR、 薬物動態、 安全性.
ORR:全奏効率 DOR:奏効期間
結果
- 年齢中央値69.0歳.
- ORR48.0% (90%CI, 30.5%~65.9%)、 うち完全寛解5例、 部分緩解7例.
- モガムリズマブによる前治療群のORR45.8%、 うち完全緩解4例、 部分緩解7例.
- DOR中央値:未到達 (NR;95%CI, 1.87ヵ月~NR).
- 治療薬投与下で発生した有害事象は管理可能であった.
- 有害事象 (≧20%):血小板減少、 貧血、 脱毛症、 味覚障害、 好中球減少、 リンパ球減少、 白血球減少、 食欲低下、 発熱.
- 有害事象 (≧Grade3):血小板減少症、 貧血、 リンパ球減少症、 白血球減少症、 好中球減少症.
- バレメトスタットは前治療歴のある患者において有望な有効性と忍容性を示した.
参考文献
最終更新:2025年1月14日
執筆担当:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
Valemetostat
バレメトスタット(エザルミア®)
2025年01月14日更新
Valemetostat:バレメトスタット(エザルミア®)
| 投与量 | コース | 投与日 |
|---|---|---|
| 200mg 1日1回 経口 (空腹時) | 1~ | Day 1~ |
その他
| 強いCYP3A阻害剤やP糖蛋白阻害剤との併用時は用量調節を行う (概要欄参照) |
| 副作用発現時は、 休薬、 減量又は中止 (概要欄参照) |
概要
本コンテンツは特定の治療法を推奨するものではございません. 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください.
薬剤情報
*適正使用ガイドは「第一三共株式会社」 の外部サイトへ遷移します.
主な有害事象
J201試験¹⁾ より引用 (適正使用ガイド²⁾ の情報を参照し作成)
骨髄抑制
- 血小板減少 (80%、 ≧Grade3 32%)
- 貧血 (52%、 ≧Grade3 32%)
- 好中球減少 (28%、 ≧Grade3 12%)
- リンパ球減少 (24%、 ≧Grade3 16%)
- 白血球減少 (20%、 ≧Grade3 12%)
- 発熱性好中球減少症 (8%、 ≧Grade3 8%)
主な有害事象
- 脱毛症 (40%)
- 味覚不全 (36%)
- 食欲減退 (16%)
- 倦怠感 (12%)
- 口内炎 (12%)
その他重要な有害事象
感染症
- CMV感染再燃 (8%、 ≧Grade3 4%)
- CMV血症 (8%)
- CMV性脈絡網膜炎 (4%、 ≧Grade3 4%)
- 肺炎 (4%、 ≧Grade3 4%)
- 股部白癬 (4%)
代謝及び栄養障害
- 低亜鉛血症 (8%)
- 低アルブミン血症 (4%)
- 低リン血症 (4%)
- 高カルシウム血症 (4%)
- 亜鉛欠乏 (4%)
胃腸障害
- 悪心 (8%)
- 下部消化管出血 (4%、 ≧Grade3 4%)
- 下痢 (4%)
- 腹部不快感 (4%)
- 腹部膨満 (4%)
その他
- 疲労 (8%)
- 発熱 (8%)
- ALT増加 (8%)
- 皮膚乾燥 (8%)
- 肝機能異常 (4%、 ≧Grade3 4%)
- 急性腎障害 (4%、 ≧Grade3 4%)
- 慢性腎臓病 (4%、 ≧Grade3 4%)
- 感覚鈍麻 (4%)
- 心不全 (4%)
- 高血圧 (4%)
- 四肢静脈血栓症 (4%)
- 肺出血 (4%)
- 発疹 (4%)
- 多形紅斑 (4%)
- 湿疹 (4%)
- 爪の障害 (4%)
- 紅斑性皮疹 (4%)
- 蛋白尿 (4%)
- AST増加 (4%)
- QT延長 (4%)
- 体重減少 (4%)
- ヘモグロビン減少 (4%)
特徴と注意点
- 本剤はエピジェネティクス*領域の低分子医薬品で、 EZH1及びEZH2を選択的に阻害する.
*DNA配列の変化を伴わない遺伝子発現変化を誘導する分子メカニズム
- EZH1及びEZH2は、 多くの血液がんで発現しているヒストンメチル化酵素 (H3K27トリメチル化酵素)であり、 がん抑制遺伝子の不活性化に関係.
- 再発又は難治性の成人T細胞白血病・リンパ腫の標準治療レジメンは確立されておらず、 モガムリズマブ治療歴を有する患者を含めた臨床試験の結果から、 臨床的に意義のある選択肢の一つとなりうる.
- 食後投与はCmax及びAUC低下の報告があるため、 空腹時に投与 (食事の1時間前から食後2時間までの間の服用は避ける).
- 本剤の血中濃度上昇リスクとなるため、 強いCYP3A阻害薬やP糖蛋白 (P-gp) 阻害薬との併用に注意.
- 動物実験において、 胚・胎児毒性 (着床後胚損失率の高値) 及び催奇形性の報告あり、 投与中及び最終投与後2週間は適切な避妊を行うよう指導.
CYP3A阻害剤やP-gp阻害剤と併用時の用量調節

感染対策
- ニューモシスチス・イロベチイ:ST合剤及び同等の効能/効果を有する薬剤による予防投与を推奨.
- その他の感染症 (HBV、 CMV、 VZV、 結核):J201試験では規定なし. 担当医の判断で検討.
副作用と対策


関連する臨床試験の結果
J201試験¹⁾
概要
- 国内第2相試験.
- 再発又は難治性の成人T細胞白血病リンパ腫患者25例を対象.
- 疾患が進行するか、 許容できない毒性が現れるまでバレメトスタット200mg/日を投与.
- 主要評価項目:ORR
- 副次評価項目:疾患領域における最良の奏効、 DOR、 薬物動態、 安全性.
ORR:全奏効率 DOR:奏効期間
結果
- 年齢中央値69.0歳.
- ORR48.0% (90%CI, 30.5%~65.9%)、 うち完全寛解5例、 部分緩解7例.
- モガムリズマブによる前治療群のORR45.8%、 うち完全緩解4例、 部分緩解7例.
- DOR中央値:未到達 (NR;95%CI, 1.87ヵ月~NR).
- 治療薬投与下で発生した有害事象は管理可能であった.
- 有害事象 (≧20%):血小板減少、 貧血、 脱毛症、 味覚障害、 好中球減少、 リンパ球減少、 白血球減少、 食欲低下、 発熱.
- 有害事象 (≧Grade3):血小板減少症、 貧血、 リンパ球減少症、 白血球減少症、 好中球減少症.
- バレメトスタットは前治療歴のある患者において有望な有効性と忍容性を示した.
参考文献
最終更新:2025年1月14日
執筆担当:牛久愛和総合病院薬剤センタ- 秋場孝則
監修医師:東海大学血液腫瘍内科 扇屋大輔
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(血液)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。
