概要
監修医師
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
VEGFR、 PDGFR、 c-Kitマルチキナーゼ阻害薬 パゾパニブ
*ノバルティス ファーマの外部サイトへ遷移します
用法用量
電子添文¹⁾、 VEG110727試験³⁾のプロトコル
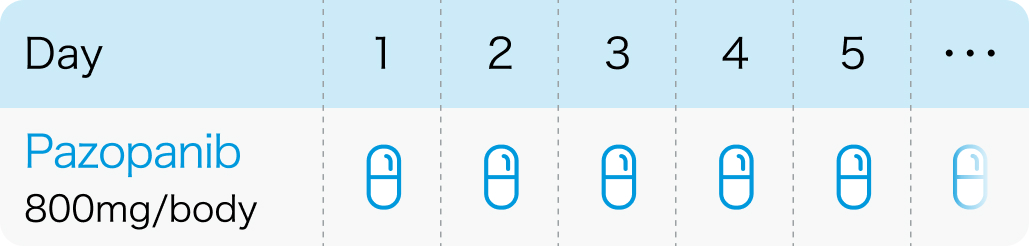
1日1回800mgを食事の1時間以上前または食後2時間以降に経口投与
食後投与で、 Cmax及びAUCが上昇するとの報告あり
ヴォトリエント®電子添文 (2024年2月改訂第2版)¹⁾、 Jpn J Clin Oncol. 2016 Mar;46(3):248-53³⁾より作図
投与開始基準
適正使用ガイド²⁾の基準
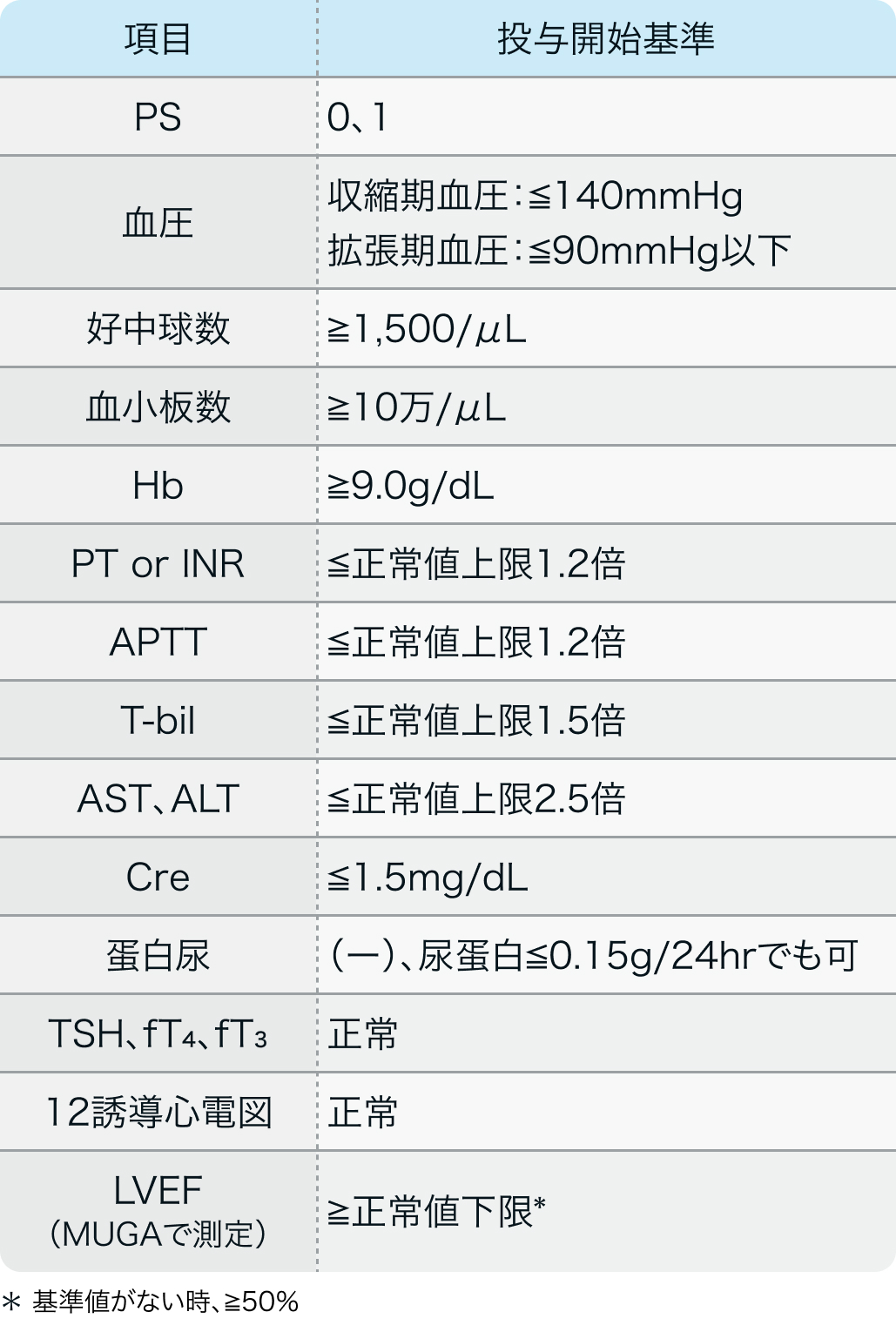
ヴォトリエント®適正使用ガイド (2021年1月改訂)²⁾より作図
減量・休薬・中止基準
電子添文¹⁾の減量・休薬・中止基準
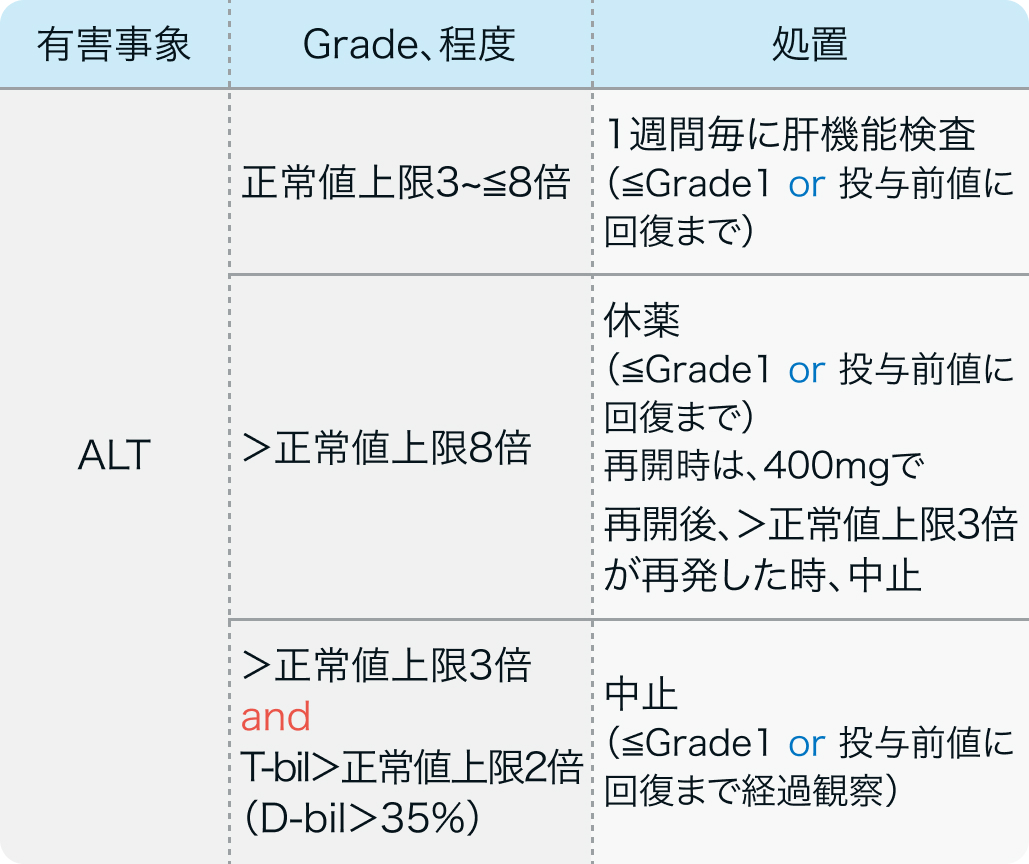
ヴォトリエント®電子添文 (2024年2月改訂第2版)¹⁾ より作図
副作用の発現により用量を減量して投与を継続する場合、 症状、 重症度等に応じて、 200mgずつ減量。 減量後に増量する場合、 200mgずつ増量、 ただし、 800mgを超えない。
ヴォトリエント®電子添文 (2024年2月改訂第2版)¹⁾ より引用
主な有害事象
VEG110727試験³
日本人の主な有害事象 (カッコ内はGrade3~4)
- 体重減少 64.5% (3.2%)
- 悪心 58.1% (0%)
- 倦怠感 58.1% (3.2%)
- 髪の色の変化 58.1% (0%)
- 食欲減退 58.1% (6.5%)
- 下痢 54.8% (6.5%)
- 高血圧 51.6% (16.1%)
- 味覚障害 41.9% (0%)
- 嘔吐 35.5% (0%)
- 剥脱性発疹 35.5% (0%)
- 便秘 29.0% (0%)
- 皮膚障害 29.0% (3.2%)
- 筋骨格系の痛み 25.8% (3.2%)
- 筋肉痛 25.8% (3.2%)
- 脱毛症 22.6% (0%)
- 頭痛 22.6% (0%)
- 胸痛 19.4% (3.2%)
- 咳 19.4% (0%)
- 胃腸の痛み 19.4% (0%)
- 鼻咽頭炎 19.4% (0%)
- 腫瘍痛 19.4% (9.7%)
- 末梢浮腫 16.1% (6.5%)
- 口内炎 16.1% (0%)
- 皮膚の色素減少 16.1% (0%)
- 掻痒 16.1% (0%)
- 不安 12.9% (0%)
- 末梢感覚神経障害 12.9% (0%)
- 消化不良 9.7% (0%)
- 発声障害 9.7% (0%)
- 耳鼻咽喉科の異常検査 9.7% (0%)
- 異常な毛の成長 9.7% (0%)
- 左室機能不全 9.7% (0%)
- 発熱 9.7% (0%)
- 眠気 9.7% (0%)
Jpn J Clin Oncol. 2016 Mar;46(3):248-53³⁾より引用
エキスパートによるワンポイント
2次治療以降の選択肢に
- 皮膚血管肉腫の2次治療以降に選択される。 日本も参加した国際共同第Ⅲ相臨床試験 (PALETTE試験³⁾) では既治療の悪性軟部腫瘍患者に対してプラセボと比較して無増悪生存期間を有意に延長し、 2012年に保険収載された。
- パクリタキセル使用後の2次治療の候補としては、 他にドセタキセル、 エリブリン、 トラベクテジン等があるが、 これらの比較試験は存在せず患者の状態や既往歴、 合併症および薬剤の特性などから治療薬を選択する。
- なお、 化学療法未治療例における有効性及び安全性は確立しておらず1次治療としては推奨されない。
- パクリタキセルによる1次化学療法後に増悪した原発性皮膚血管肉腫患者に対する2次化学療法として、 パゾパニブの有効性、 安全性を検証する臨床試験がJCOG皮膚腫瘍グループで実施され、 2025年に結果が報告される予定である。
臨床試験結果は奏効率20%
- PALETTE試験³⁾では悪性軟部腫瘍を対象に無増悪生存期間がプラセボ1.6ヵ月に対し4.6ヵ月と有意な延長を認めたが、 対象に含まれていた血管肉腫患者は6例のみであった。 その後、 EORTCよる後ろ向き観察研究⁴⁾により血管肉腫40例に対し奏効率20%、 無増悪生存期間中央値3か月、 全生存期間中央値9.9ヵ月と報告された。
- 腎細胞癌では血中濃度が低い症例では無増悪生存期間が短いことが報告されており⁴⁾、 血管肉腫でも同様の結果なのかは今後の検証が必要である。
高血圧に注意
- 日本人患者では毛髪変色、 食欲減退、 下痢、 疲労、 高血圧、 悪心の副作用が多く見られた。 高血圧の発生頻度は血中濃度と相関があると報告されている⁵⁾。
- 高齢者の多い血管肉腫では高血圧や心血管障害の既往を有する患者が多く注意を要する。 また頻度の高い副作用に食欲低下や倦怠感、 疲労があり、 高齢者ではこれらの副作用でも減量や休薬を要することがある。
肝機能障害は減量を考慮
- パゾパニブ1回800mgを食事の1時間以上前または食後2時間以降に経口投与する。 肝機能障害がある場合は減量を考慮する。 副作用発現時は許容できないGrade2以上の場合は休薬し、 Grade1以下になってから200mg減量して再開する。 Grade4やGrade1に回復しない場合は中止する。
- パゾパニブの血中濃度に影響する使用頻度の高い薬剤としてプロトンポンプ阻害薬があり、 内服薬の確認をしておく。
出典
- ノバルティス ファーマ. ヴォトリエント®電子添文 (2024年2月改訂第2版) [最終閲覧 : 2024/11/12]
- ノバルティス ファーマ. ヴォトリエント®適正使用ガイド (2021年1月改訂) [最終閲覧 : 2024/11/12]
- A randomized, double-blind, placebo-controlled, Phase III study of pazopanib in patients with soft tissue sarcoma: results from the Japanese subgroup. Jpn J Clin Oncol. 2016 Mar;46(3):248-53. PMID: 26864131
- Pazopanib in advanced vascular sarcomas: an EORTC Soft Tissue and Bone Sarcoma Group (STBSG) retrospective analysis. Acta Oncol. 2017 Jan;56(1):88-92. PMID: 27838944
- Relationships between pazopanib exposure and clinical safety and efficacy in patients with advanced renal cell carcinoma. Br J Cancer. 2014 Nov 11;111(10):1909-16. PMID: 25349968
最終更新日 : 2024年11月12日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
Pazopanib
パゾパニブ (ヴォトリエント®)
2024年11月12日更新
本コンテンツは特定の治療法を推奨するものではありません。 個々の患者の病態や、 実際の薬剤情報やガイドラインを確認の上、 利用者の判断と責任でご利用ください。
薬剤情報
VEGFR、 PDGFR、 c-Kitマルチキナーゼ阻害薬 パゾパニブ
*ノバルティス ファーマの外部サイトへ遷移します
用法用量
電子添文¹⁾、 VEG110727試験³⁾のプロトコル

1日1回800mgを食事の1時間以上前または食後2時間以降に経口投与
食後投与で、 Cmax及びAUCが上昇するとの報告あり
ヴォトリエント®電子添文 (2024年2月改訂第2版)¹⁾、 Jpn J Clin Oncol. 2016 Mar;46(3):248-53³⁾より作図
投与開始基準
適正使用ガイド²⁾の基準

ヴォトリエント®適正使用ガイド (2021年1月改訂)²⁾より作図
減量・休薬・中止基準
電子添文¹⁾の減量・休薬・中止基準

ヴォトリエント®電子添文 (2024年2月改訂第2版)¹⁾ より作図
副作用の発現により用量を減量して投与を継続する場合、 症状、 重症度等に応じて、 200mgずつ減量。 減量後に増量する場合、 200mgずつ増量、 ただし、 800mgを超えない。
ヴォトリエント®電子添文 (2024年2月改訂第2版)¹⁾ より引用
主な有害事象
VEG110727試験³
日本人の主な有害事象 (カッコ内はGrade3~4)
- 体重減少 64.5% (3.2%)
- 悪心 58.1% (0%)
- 倦怠感 58.1% (3.2%)
- 髪の色の変化 58.1% (0%)
- 食欲減退 58.1% (6.5%)
- 下痢 54.8% (6.5%)
- 高血圧 51.6% (16.1%)
- 味覚障害 41.9% (0%)
- 嘔吐 35.5% (0%)
- 剥脱性発疹 35.5% (0%)
- 便秘 29.0% (0%)
- 皮膚障害 29.0% (3.2%)
- 筋骨格系の痛み 25.8% (3.2%)
- 筋肉痛 25.8% (3.2%)
- 脱毛症 22.6% (0%)
- 頭痛 22.6% (0%)
- 胸痛 19.4% (3.2%)
- 咳 19.4% (0%)
- 胃腸の痛み 19.4% (0%)
- 鼻咽頭炎 19.4% (0%)
- 腫瘍痛 19.4% (9.7%)
- 末梢浮腫 16.1% (6.5%)
- 口内炎 16.1% (0%)
- 皮膚の色素減少 16.1% (0%)
- 掻痒 16.1% (0%)
- 不安 12.9% (0%)
- 末梢感覚神経障害 12.9% (0%)
- 消化不良 9.7% (0%)
- 発声障害 9.7% (0%)
- 耳鼻咽喉科の異常検査 9.7% (0%)
- 異常な毛の成長 9.7% (0%)
- 左室機能不全 9.7% (0%)
- 発熱 9.7% (0%)
- 眠気 9.7% (0%)
Jpn J Clin Oncol. 2016 Mar;46(3):248-53³⁾より引用
エキスパートによるワンポイント
2次治療以降の選択肢に
- 皮膚血管肉腫の2次治療以降に選択される。 日本も参加した国際共同第Ⅲ相臨床試験 (PALETTE試験³⁾) では既治療の悪性軟部腫瘍患者に対してプラセボと比較して無増悪生存期間を有意に延長し、 2012年に保険収載された。
- パクリタキセル使用後の2次治療の候補としては、 他にドセタキセル、 エリブリン、 トラベクテジン等があるが、 これらの比較試験は存在せず患者の状態や既往歴、 合併症および薬剤の特性などから治療薬を選択する。
- なお、 化学療法未治療例における有効性及び安全性は確立しておらず1次治療としては推奨されない。
- パクリタキセルによる1次化学療法後に増悪した原発性皮膚血管肉腫患者に対する2次化学療法として、 パゾパニブの有効性、 安全性を検証する臨床試験がJCOG皮膚腫瘍グループで実施され、 2025年に結果が報告される予定である。
臨床試験結果は奏効率20%
- PALETTE試験³⁾では悪性軟部腫瘍を対象に無増悪生存期間がプラセボ1.6ヵ月に対し4.6ヵ月と有意な延長を認めたが、 対象に含まれていた血管肉腫患者は6例のみであった。 その後、 EORTCよる後ろ向き観察研究⁴⁾により血管肉腫40例に対し奏効率20%、 無増悪生存期間中央値3か月、 全生存期間中央値9.9ヵ月と報告された。
- 腎細胞癌では血中濃度が低い症例では無増悪生存期間が短いことが報告されており⁴⁾、 血管肉腫でも同様の結果なのかは今後の検証が必要である。
高血圧に注意
- 日本人患者では毛髪変色、 食欲減退、 下痢、 疲労、 高血圧、 悪心の副作用が多く見られた。 高血圧の発生頻度は血中濃度と相関があると報告されている⁵⁾。
- 高齢者の多い血管肉腫では高血圧や心血管障害の既往を有する患者が多く注意を要する。 また頻度の高い副作用に食欲低下や倦怠感、 疲労があり、 高齢者ではこれらの副作用でも減量や休薬を要することがある。
肝機能障害は減量を考慮
- パゾパニブ1回800mgを食事の1時間以上前または食後2時間以降に経口投与する。 肝機能障害がある場合は減量を考慮する。 副作用発現時は許容できないGrade2以上の場合は休薬し、 Grade1以下になってから200mg減量して再開する。 Grade4やGrade1に回復しない場合は中止する。
- パゾパニブの血中濃度に影響する使用頻度の高い薬剤としてプロトンポンプ阻害薬があり、 内服薬の確認をしておく。
出典
- ノバルティス ファーマ. ヴォトリエント®電子添文 (2024年2月改訂第2版) [最終閲覧 : 2024/11/12]
- ノバルティス ファーマ. ヴォトリエント®適正使用ガイド (2021年1月改訂) [最終閲覧 : 2024/11/12]
- A randomized, double-blind, placebo-controlled, Phase III study of pazopanib in patients with soft tissue sarcoma: results from the Japanese subgroup. Jpn J Clin Oncol. 2016 Mar;46(3):248-53. PMID: 26864131
- Pazopanib in advanced vascular sarcomas: an EORTC Soft Tissue and Bone Sarcoma Group (STBSG) retrospective analysis. Acta Oncol. 2017 Jan;56(1):88-92. PMID: 27838944
- Relationships between pazopanib exposure and clinical safety and efficacy in patients with advanced renal cell carcinoma. Br J Cancer. 2014 Nov 11;111(10):1909-16. PMID: 25349968
最終更新日 : 2024年11月12日
監修医師 : 国立がん研究センター中央病院 皮膚腫瘍科 中野英司先生
こちらの記事の監修医師
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
HOKUTO編集部
編集・作図:編集部、 監修:所属専門医師。各領域の第一線の専門医が複数在籍。最新トピックに関する独自記事を配信中。
レジメン(皮膚)
がん薬物療法における治療計画をまとめたものです。
主要論文や適正使用ガイドをもとにした用量調整プロトコール、 有害事象対応をご紹介します。
なお、 本ツールは医師向けの教育用資料であり、 実臨床での使用は想定しておりません。 最新の添付文書やガイドラインを必ずご確認下さい。
また、 一般の方への情報提供ではないことを予めご了承ください。